骨转移是EGFR-TKI耐药的主要模式之一,约30%的三代EGFR-TKI耐药以新发骨转移的形式出现。尽管免疫治疗已经成为EGFR-TKI耐药后的标准治疗方案,但对于存在骨转移的患者,免疫治疗对全身病灶均疗效不佳,缓解差、生存短。因此,对于骨转移的EGFR-TKI耐药患者,后续治疗面临巨大挑战。近期发表于Cancer Cell的最新成果显示:骨转移是全身问题、骨转移可通过“RANKL-OPN全身免疫抑制链”导致骨外病灶形成“冷肿瘤”、抑制全身免疫治疗疗效。临床常用的骨保护药物RANKL抑制剂地舒单抗有望阻断这一过程,实现逆转骨外免疫抑制、与免疫治疗协同增效,带来全身获益。
基于此,【肿瘤资讯】特邀上海交通大学医学院附属胸科医院杨轶教授分享一例存在骨转移的EGFR-TKI耐药患者在免疫治疗长期SD后联合地舒单抗最终达到PR的案例。该例患者长期存在多发骨转移,在三代EGFR-TKI耐药后长期接受免疫治疗,达到并维持SD约10个月,在联合地舒单抗后原发灶进一步缩小,突破SD实现PR,直观展示了地舒单抗为骨转移患者逆转免疫抑制、带来全身获益的重要价值。此外,本期内容邀请了上海交通大学医学院附属胸科医院李子明教授对该病例进行点评,详情如下。
上海交通大学医学院附属胸科医院肿瘤科
上海市肺部肿瘤临床医学中心
2019-2020年美国杜克大学医学中心访问学者
上海市浦江人才计划(D类)
主持国家自然科学基金青年科学基金项目一项
中国临床肿瘤协作中心(CSCO)会员
中国医药教育协会肿瘤免疫治疗专业委员会委员
上海市肿瘤防治联盟肺癌专业委员会委员
上海市女医师协会肺癌专业委员会委员
上海交通大学医学院附属胸科医院肿瘤科主任
上海交通大学博士生导师
中华医学会肿瘤学分会青委委员
中国临床肿瘤学会 (CSCO) 青委委员
中国抗癌协会肺癌专业委员会委员兼内科学组秘书
美国纽约叶史瓦大学爱因斯坦医学院访问学者(2014.8-2015.9)
获得:上海市青年拔尖人才、上海市优秀学术带头人
上海市浦江人才、上海市人才发展基金
主要研究方向为肺癌多学科综合治疗的基础与临床研究,擅长肺癌微创肿瘤消融术
病例介绍
一、基本情况
患者信息:女性,48岁。
主诉:体检发现肺部结节1月。
现病史:患者于2021年6月体检发现右肺阴影,PET-CT提示右肺小叶近纵膈旁肺癌伴纵膈淋巴结转移、全身多发骨转移。为求进一步诊治,患者于2021年6月11日来院就诊。
既往史与个人史:无特殊既往病史,无吸烟史。
二、辅助检查
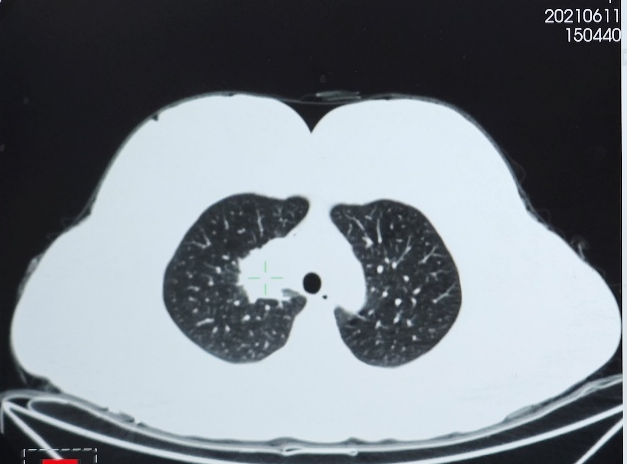
● 胸部CT(2021年6月11日):右肺上叶实性肿块影,大小约34×33mm,考虑肺癌;右肺门及纵隔淋巴结肿大。两肺多发微小结节。
● 病理活检(2021年6月17日):气管镜下淋巴结活检,病理诊断为腺癌。免疫组化:CK (+), TTF-1 (+), P40(-), CD5/6(-), Napsin A(+)。
● 分子病理检测(2021年7月2日):EGFR基因19号外显子缺失(19-del),丰度32.96%;TP53基因突变,丰度27.81%。PD-L1表达(TPS):5%。
三、初步诊断
右肺上叶腺癌(cT2aN2M1c,IVB期),伴纵隔淋巴结及多发骨转移,EGFR 19-del(+)。
四、治疗过程与疗效评估
一线治疗(2021年7月6日 - 2023年10月24日):
➤ 治疗方案:第三代EGFR-TKI单药口服治疗。
患者在2023年5、6、10月行局部放疗,分别为左侧股骨放疗(30Gy/10Fx);L5椎体放疗(30Gy/10Fx) ,L4椎体放疗(30Gy/10Fx) 。
➤ 疗效评估:口服TKI持续治疗约2年,患者病情稳定,最佳疗效PR。
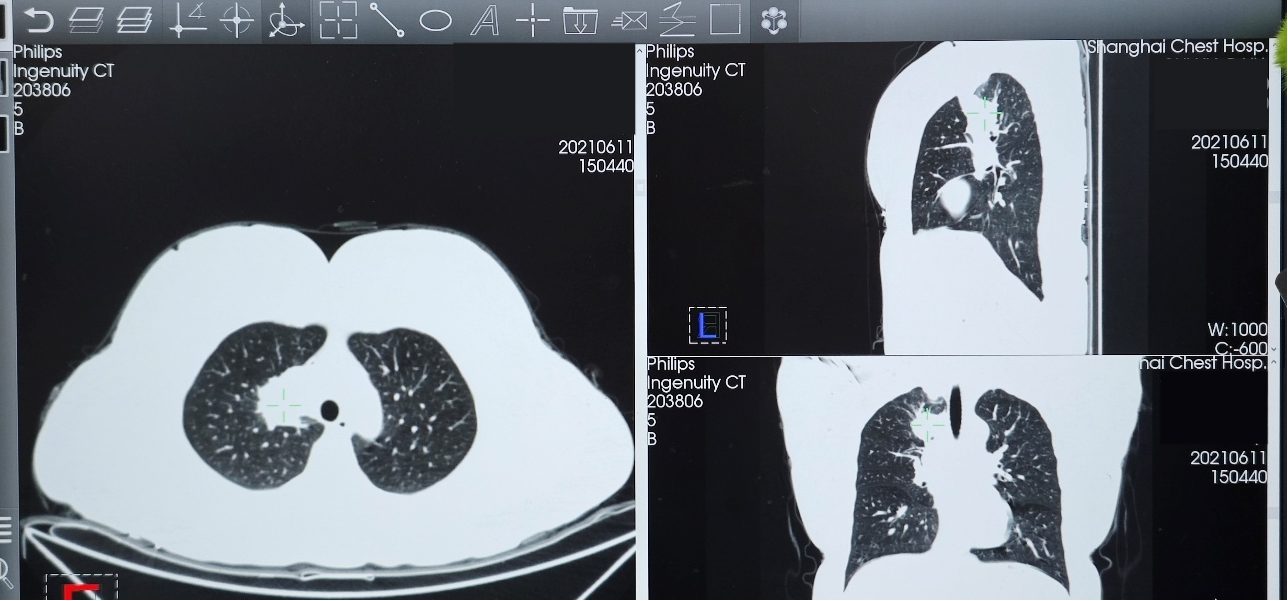
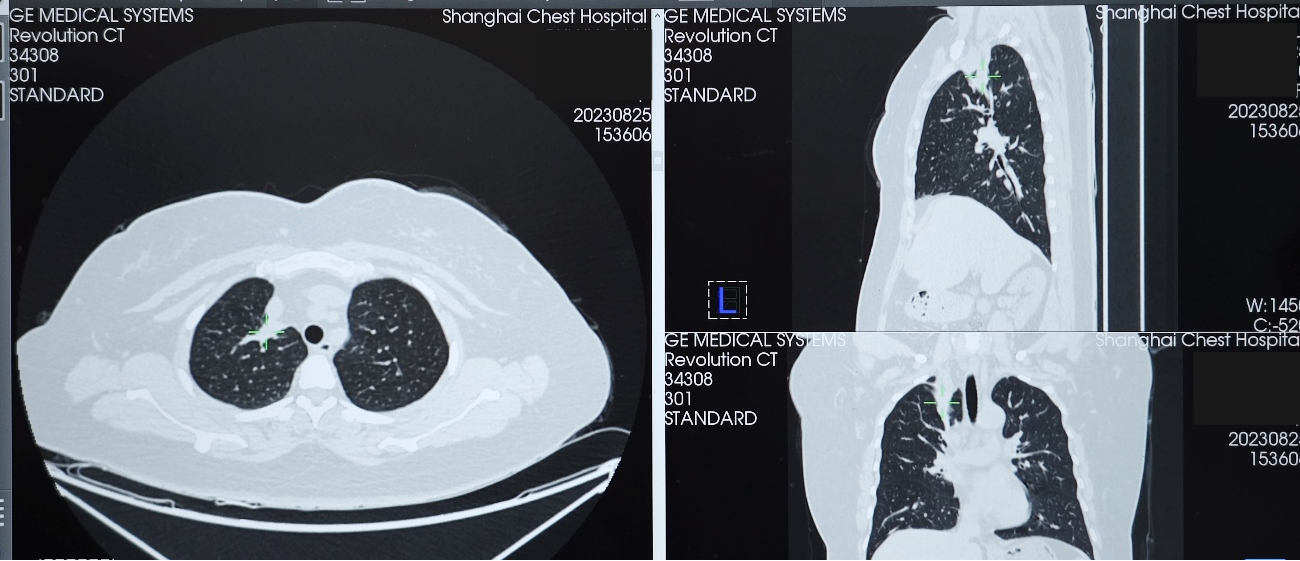
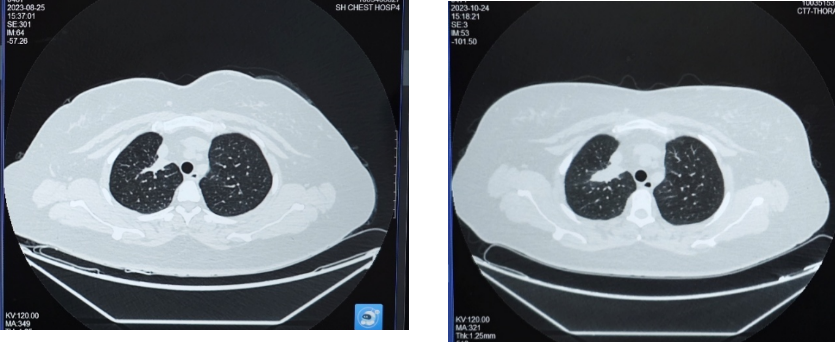
2023年10月24日复查胸部CT,示右肺上叶实性肿块影,大小约37×15mm,与2023年8月25日CT相比病灶增大,评估为靶向治疗耐药导致疾病进展(PD)。
二线治疗(2023年12月 7日- 至今):
➤ 治疗方案:经查患者无EGFR T790M突变和其他可用药靶点。根据指南推荐,于2023年12月7日开始行免疫联合治疗,方案为“含铂双药化疗+PD-1单抗+贝伐珠单抗”。
➤ 疗效评估:
第一阶段:2024年1月19日首次复查,肺部病灶较前缩小,大小约34×11mm;2024年4月22日复查,肺部病灶较老片相仿,疗效评价维持SD,治疗方案调整为“培美曲塞+PD-1单抗+贝伐珠单抗”,并开始使用双膦酸盐进行骨保护治疗。
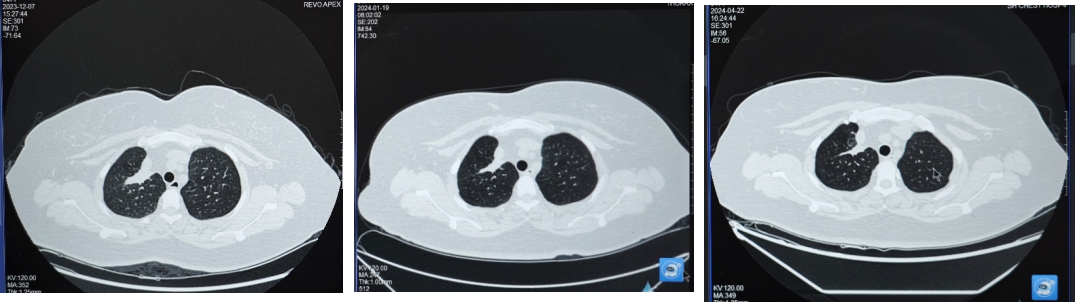
第二阶段:2024年10月21日,胸部CT示肺部原发灶大小较老片相仿,疗效评价维持SD。在前述全身免疫治疗方案的基础上,于2024年10月起将骨保护药物从双膦酸盐调整为地舒单抗(120mg,Q4W)。
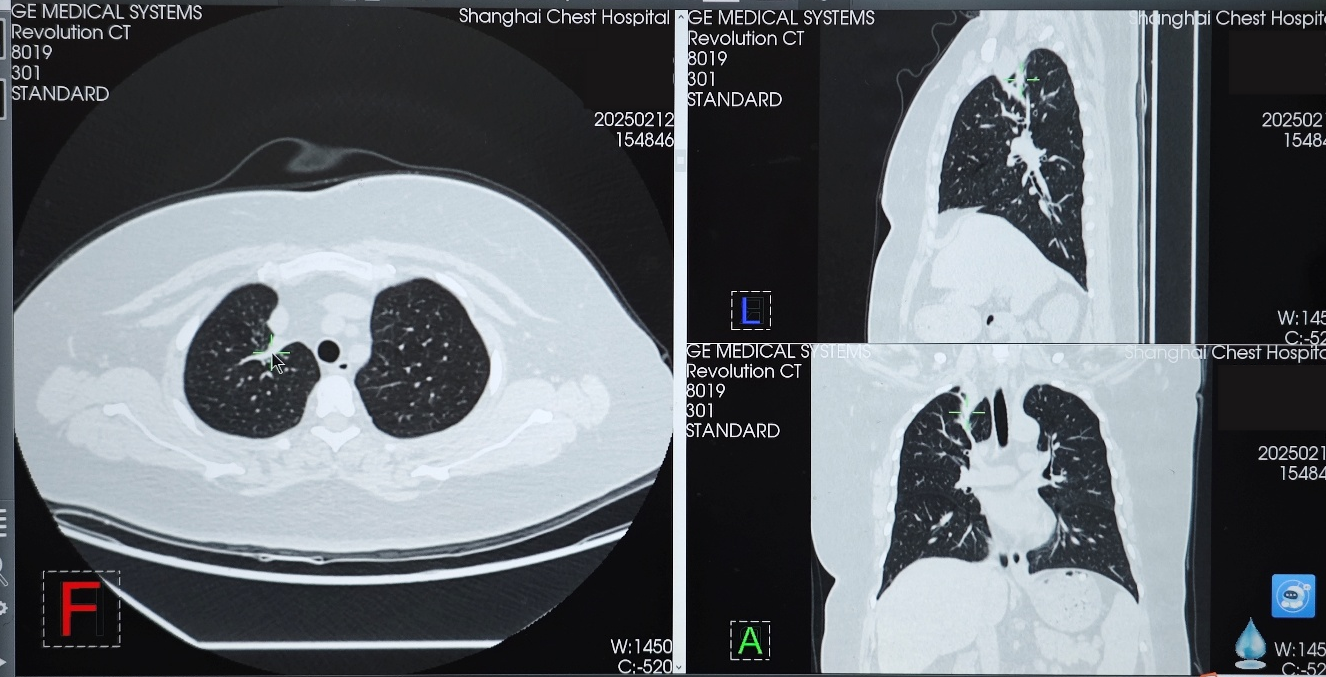
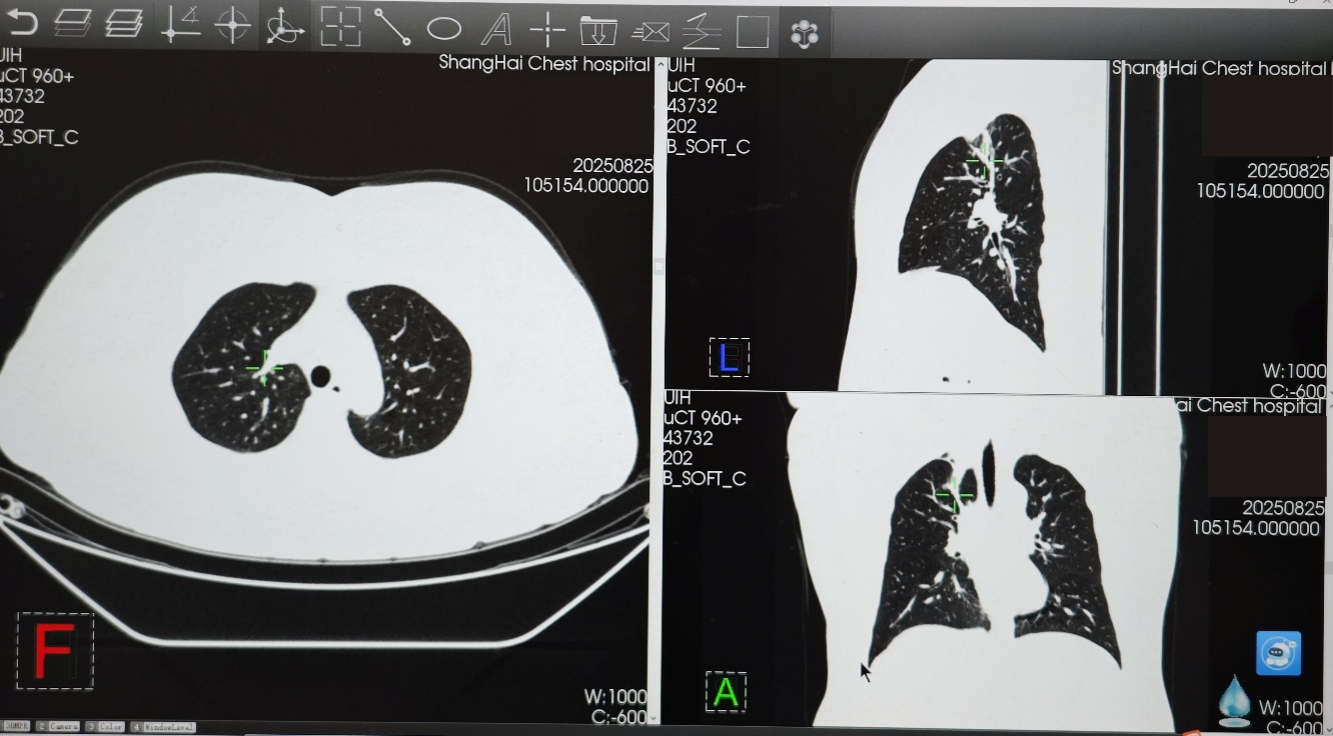
在变更骨保护药物方案前,患者免疫联合治疗达到并维持SD状态约10个月,在使用培美曲塞+PD-1+抗血管药物+地舒单抗后,患者肿瘤再次开始缩小,2025年2月复查胸部CT时,右肺上叶病灶缩小至24×11mm,达到PR。2025年8月复查胸部CT时,右肺上叶病灶进一步缩小至22×6mm,最佳疗效PR
➤ 骨转移管理与疗效评估:
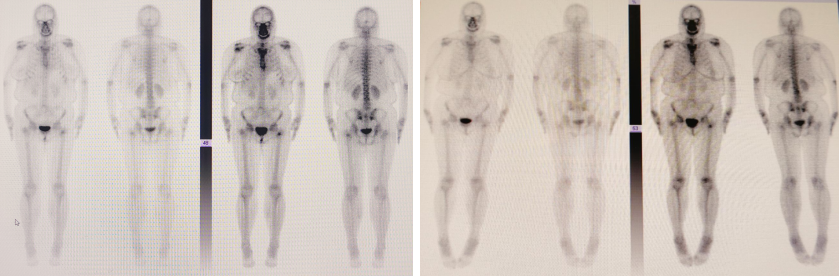
2024年4月23日,全身骨扫描提示出现右侧髂骨、L5椎体等新发骨转移。左侧股骨粗隆局部放射性骨肿瘤病灶,较前(2022年12月2日)大致相仿。随即开始使用双膦酸盐进行骨保护治疗,后转为地舒单抗治疗。
2025年1月9日复查骨扫描,显示此前(2024年4月23日)新发的右侧髂骨及L5椎体转移灶未再显影,骨转移情况显著好转。
五、病例小结
本例患者的诊疗历程清晰地展示了一个由靶向耐药转向联合治疗,并通过优化骨转移管理策略最终原发灶由SD进一步缓解为PR,地舒单抗的加入主力患者实现全身获益的过程:
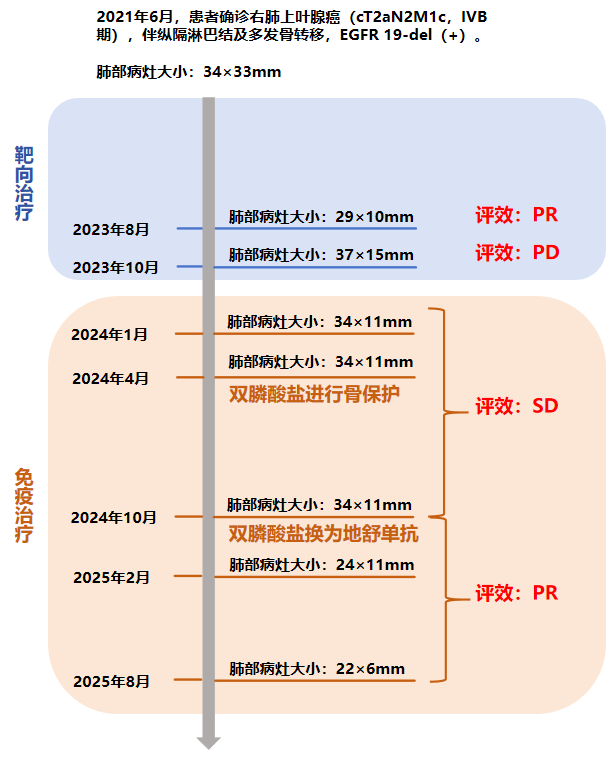
2021.07 - 2023.08: 第三代EGFR-TKI一线靶向治疗,长期控制病情,但骨转移阴霾初现。
2023.08 - 2023.10:出现靶向耐药,影像学评估为PD。
2023.12:启动“化疗+免疫+抗血管”四药联合二线治疗,初步控制病情。
2024.04:出现新发骨转移,开始联合双膦酸盐,同时肺部原发灶的免疫治疗疗效遭遇瓶颈
2024.10:将骨保护药物更换为地舒单抗。
2025.01-2025.08:免疫治疗联合地舒单抗后,肺部原发灶在长期SD后进一步缩小达到PR,地舒单抗可能突破了骨转移导致的免疫抑制,联合免疫治疗,助力实现逆转抑制、协同增效的全身获益。
病例点评
本例骨转移EGFR-TKI耐药患者的成功治疗,为临床实践提供了多方面的重要启示。首先,在EGFR-TKI耐药后,选择“化疗+免疫+抗血管”的联合模式是当前突破耐药困境的有效策略之一,成功遏制了疾病的进展,为后续治疗赢得了时间和机会。
其次,也是本病例最核心的亮点,在于骨转移管理策略的调整对整体病情的深远影响。既往我们对骨转移的认知是“局部问题”,可能导致SRE。后来我们发现骨转移内部是免疫抑制的[2-8],可能削弱骨转移灶的免疫治疗。但近期发表于Cancer Cell的最新研究则提示骨转移其实是“全身问题”,尤其是对于免疫治疗的负面影响早已超出骨骼范畴。骨转移灶过度活跃的破骨细胞分泌的大量骨桥蛋白(OPN),循环的OPN可以直接抑制肿瘤“骨外病灶”的CD8+T细胞的浸润,骨转移直接损害全身免疫治疗的疗效[9];,也就是我们最近常说的“RANKL-OPN全身免疫抑制链”。

地舒单抗作为一种RANKL抑制剂,在保护骨骼的同时,阻断了骨转移导致的“RANKL-OPN全身免疫抑制链”,和免疫治疗具有逆转抑制、协同增效的理论基础[9,10],大量已发表的回顾与前瞻性研究均表明,对于存在骨转移且需要使用免疫治疗的患者,免疫治疗期间联合地舒单抗可带来缓解与生存的全身治疗获益。
本例EGFR-TKI耐药患者在初诊时即出现多发骨转移,在二线治疗期间持续出现新发骨转移,预后本不容乐观。免疫治疗虽然起效,但仍面临疗效长期停滞、持续SD 10个月的困局。在患者的骨保护治疗换用地舒单抗后,肺部原发灶在此前长期SD的基础上再次出现了令人欣喜的持续缩小,最终实现了PR。我们认为,结合理论与临床上我们观察到的现象,这强烈提示,地舒单抗可能通过打破骨转移“RANKL-OPN全身免疫抑制链”,改善了全身免疫微环境,打破了骨转移带来的免疫抑制,从而“解锁”或增强了PD-1单抗的疗效,实现了“1+1>2”的协同增效。
综上所述,该病例生动地证明了,对于接受免疫治疗的骨转移患者,骨保护药物的选择可能会导致更加深远的影响,骨保护药物(如RANKL抑制剂地舒单抗)与免疫治疗的联合,不仅能有效控制骨转移局部问题,更能通过其独特的免疫调节机制,与ICB治疗协同增效,为患者带来全身性的生存获益[4, 7, 9]。
[1] Lin Y, Wang X, Li W, et al. Mechanisms of acquired resistance to third-generation EGFR tyrosine kinase inhibitors in NSCLC. J Hematol Oncol. 2020;13(1):3.
[2] Zhu Y, She J, Sun R, et al. Impact of Bone Metastasis on Prognosis in Non-Small Cell Lung Cancer Patients Treated With Immune Checkpoint Inhibitors: A Systematic Review and Meta-Analysis. Front Immunol. 2024;15:1493773.
[3] Landi L, D'Incà F, Gelibter A, et al. Bone Metastases and Immunotherapy in Patients With Advanced Non-Small-Cell Lung Cancer. J Immunother Cancer. 2019;7(1):316.
[4] Zhu YJ, Chang XS, Zhou R, et al. Bone Metastasis Attenuates Efficacy of Immune Checkpoint Inhibitors and Displays "Cold" Immune Characteristics in Non-Small Cell Lung Cancer. Lung Cancer. 2022;166:189-196.
[5] Abbott AG, Meyers DE, Elmi-Assadzadeh G, et al. Effectiveness of Immune Checkpoint Inhibitor Therapy on Bone Metastases in Non-Small-Cell Lung Cancer. Front Immunol. 2024;15:1379056.
[6] Botticelli A, Cirillo A, Scagnoli S, et al. The Agnostic Role of Site of Metastasis in Predicting Outcomes in Cancer Patients Treated With Immunotherapy. Vaccines (Basel). 2020;8(2):E203.
[7] Hamza FN, Mohammad KS. Immunotherapy in the Battle Against Bone Metastases: Mechanisms and Emerging Treatments. Pharmaceuticals (Basel). 2024;17(12):1591.
[8] Wytiaz V, Van Poznak C. Checkpoint Inhibitors in Bone Metastatic Disease in Solid Tumors. Curr Osteoporos Rep. 2023;21(4):323-329.
[9] Cheng JN, Jin Z, Su C, et al. Bone Metastases Diminish Extraosseous Response to Checkpoint Blockade Immunotherapy Through Osteopontin-Producing Osteoclasts. Cancer Cell. 2025;43(6):1093-1107.e9.
[10] Stopeck AT, Lipton A, Body JJ, et al. Denosumab compared with zoledronic acid for the treatment of bone metastases in patients with advanced breast cancer: a randomized, double-blind study. J Clin Oncol. 2010;28(35):5132-5139.
排版编辑:肿瘤资讯-IRIS











 苏公网安备32059002004080号
苏公网安备32059002004080号


