2025年9月14日,由中华医学会、中华医学会血液学分会主办,华中科技大学同济医学院血液病学研究所、国家血液系统疾病临床医学研究中心-北京大学血液病研究所承办的中华医学会第十九次血液学学术会议在北京成功召开。在会议期间,一场聚焦“新药时代高危弥漫大B细胞淋巴瘤(DLBCL)是否应一线选择自体造血干细胞移植(ASCT)”的辩论赛引发广泛关注。正方由首都医科大学附属北京天坛医院付林教授、深圳市人民医院周继豪教授、江苏省人民医院缪祎教授组成,反方则由首都医科大学附属北京同仁医院王亮教授、北京大学肿瘤医院张晨教授、浙江大学医学院附属第二医院刘辉教授应战。
这场辩论不仅是一场临床策略的交锋,更是对当前新药时代下高危DLBCL治疗路径的深刻反思。双方围绕“疗效是否确切”“新药是否可替代”“指南是否支持”“真实世界数据是否可信”等关键问题展开激烈讨论,展现了淋巴瘤领域最前沿的循证医学证据与临床实践经验。
高危DLBCL治疗的时代之问
DLBCL作为最常见的侵袭性非霍奇金淋巴瘤,约30%~40%的患者属于高危群体,其治疗一直是血液肿瘤领域的难点。传统治疗中,ASCT凭借巩固疗效、延长生存的优势,长期占据高危患者一线治疗的重要地位。然而,随着维泊妥珠单抗(Pola)、CAR-T细胞疗法、双特异性抗体等新药与新技术的涌现,临床治疗格局正在被重塑。
在这一背景下,“新药时代是否仍需将ASCT作为高危DLBCL一线巩固治疗选择”的争议日益凸显。本次辩论赛正是基于这一临床痛点,正方力证ASCT的不可替代性,反方则强调新药带来的治疗革新,双方的激烈辩论精准捕捉了当前临床决策的核心矛盾。

正方:ASCT 仍是高危 DLBCL 一线巩固的 “磐石”
正方以“化疗攻坚,移植守城”为核心论点,从患者获益、证据支撑与临床可及性三个维度展开论述,强调ASCT在高危DLBCL一线治疗中的核心地位。
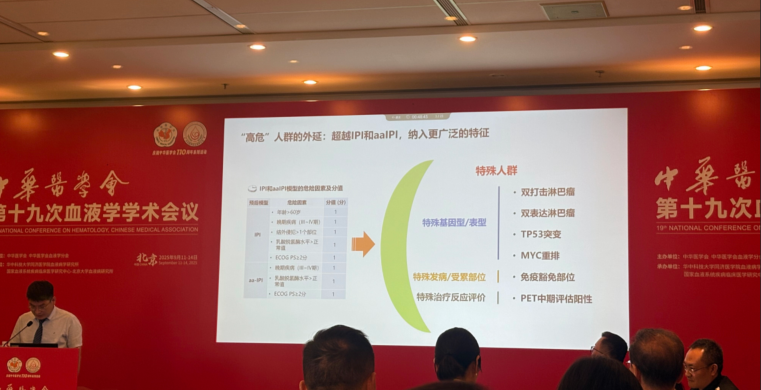
高危人群界定与移植获益的精准匹配
正方首先明确高危DLBCL的外延范畴,不仅包括IPI评分4-5分、年龄调整IPI评分3分的传统高危群体,还涵盖双打击淋巴瘤、双表达淋巴瘤、TP53突变、MYC重排及中期PET-CT阳性等特殊高危亚型。针对这类患者,SWOG 9704研究显示,ASCT一线巩固可使高危组无进展生存(PFS)率提升34%,总生存(OS)率提高18%,且P值达到0.001的统计学显著水平。
真实世界数据进一步佐证了这一获益:中国大样本研究显示,ASCT可使中高危患者3年PFS率和OS率分别提升22%;加拿大数据则表明,IPI 4-5分的高危患者经一线ASCT治疗后治愈率超70%。
正方辩手周继豪教授强调:“这些数据证实,在化疗敏感且达到PR/CR的患者中,ASCT能实现深度缓解与长期生存的双重目标。”
新药时代移植的不可替代性
面对反方提出的新药挑战,正方指出,当前新药研究存在诸多局限性:POLARIS研究虽显示Pola-R-CHP方案2年PFS率达76.7%,但5年PFS率仅为63.1%,仍有近40%患者面临复发风险;ZUMA-12研究纳入的是2个疗程治疗不敏感的1.5线患者,并非严格意义上的初治高危群体,其数据不能直接推广至一线治疗。
同时,正方强调,新药与移植并非对立关系。“新药诱导治疗的目标是实现缓解,而ASCT是在缓解基础上进一步巩固疗效、降低复发风险的关键手段。”付林教授指出,目前尚无任何研究证实新药诱导缓解后省略ASCT仍能获得同等生存获益,且对于TP53突变等新药尚未突破的高危亚型,ASCT仍是唯一明确有效的巩固方式。
临床可及性与实际治疗价值
从临床实践角度,正方认为ASCT具有不可比拟的可及性优势。随着DRG/DIP支付体系的推进,ASCT在国内多数三甲医院已实现普及,且70%~80%的入组患者可顺利完成治疗。相比之下,CAR-T细胞疗法费用高昂、双特异性抗体尚未完全纳入医保,且仅少数中心能开展分子分型指导下的精准用药,难以满足广大基层医院的临床需求。“对于无法获得新药治疗的患者,ASCT是保障生存的重要选择。”缪祎教授补充道。
反方:新药革新重构高危 DLBCL 一线治疗格局
反方以“新药时代,移植非必需”为核心,结合最新指南更新与前沿研究证据,论证高危DLBCL一线治疗已进入精准新药时代,ASCT的一线地位已被撼动。

传统移植证据的时代局限性与指南更新
反方直指正方援引的SWOG 9704、DLCL04等研究存在明显缺陷:前者约1/3患者未接受利妥昔单抗治疗,属于“利妥昔单抗前时代”的研究;后者采用大剂量化疗方案,毒性削弱了移植的生存优势,且对照组50%复发患者接受了挽救性移植,反而证明移植更适合后线治疗。
指南更新更是反方的重要论据:2019年NCCN指南已移除ASCT一线推荐,2025年最新版指南更明确指出“不推荐初治高危DLBCL患者一线采用ASCT巩固治疗”。“指南的迭代反映了证据体系的更新,新药已取代移植成为更优选择。”王亮教授强调。
新药疗法实现更深缓解与更优生存
反方通过多项前沿研究数据,展示了新药在高危DLBCL中的治疗优势。COALITION研究显示,格菲妥单抗联合Pola-R-CHP方案治疗高危患者,诱导治疗结束时基于cfDNA的微小残留病(MRD)阴性率达88%,24个月PFS和OS率分别达86%和90%以上,显著优于传统移植的疗效数据。
CAR-T细胞疗法与免疫检查点抑制剂同样表现亮眼:ZUMA-12研究中,高危患者接受CAR-T一线治疗后,客观缓解率(ORR)达92%,完全缓解(CR)率86%,3年PFS率达75.1%;阿替利珠单抗巩固治疗使高危患者2年无病生存(DFS)率达87.9%,纳武利尤单抗则使高级别B细胞淋巴瘤患者2年DFS提升至86%。
“这些数据已全面超越ASCT的历史疗效,且能实现更深层次的MRD阴性缓解。” 张晨教授指出。
精准分型与药物可及性的持续改善
反方提出,基因分型指导下的个体化治疗已成为趋势。Guidance 05研究显示,基于MCD、BN2、N1等基因亚型制定的Pola-RCHP+X方案,可进一步改善DLBCL疗效;国内研究也证实,R-CHOP联合伊布替尼、来那度胺等靶向药物的“RCHOP+X”方案,使高危患者CR率达87%,12个月PFS率达93%,显著优于传统R-CHOP方案。
在药物可及性方面,反方强调,Pola已纳入医保,CAR-T细胞疗法进入商保,双抗药物的可及性也在逐步提升,以往制约新药应用的费用问题正在得到解决。同时,NCCN指南已认可循环肿瘤DNA(ctDNA)在MRD检测中的价值,为精准疗效评估与治疗调整提供了工具支撑。
自由辩论:焦点问题的深度剖析
疗效评价:CR与长期生存的关系
反方以“为永远CR而战”为口号,强调深度缓解是长期生存的前提,新药带来的高MRD阴性率是实现持久缓解的关键;正方则反驳,CR仅是治疗阶梯,ASCT能将CR转化为更稳定的长期生存,且新药研究中部分患者的缓解持续时间仍需更长随访验证。
研究人群:初治与挽救治疗的界定
正方指出,反方援引的ZUMA-12研究纳入的是治疗不敏感的1.5线患者,与本次辩论“初治高危”的前提不符;反方则回应,即使是初治患者,Pola-R-CHP等方案的疗效已超越移植,且移植更适合作为复发难治后的挽救治疗手段。
精准治疗的现实可行性
反方认为基因分型指导的个体化治疗已近在眼前,Guidance系列研究已展示其潜力;正方则指出,国内多数中心无法开展全外显子+转录组测序,约50%患者无法明确分型,精准治疗尚未进入临床普及阶段。
总结:从辩论到临床——个体化决策是终极方向
这场辩论并未得出绝对统一的结论,但清晰勾勒出高危DLBCL一线治疗的核心原则:既不能固守传统移植的经验主义,也不应盲目推崇新药的技术优势,个体化分层决策才是未来的核心方向。
正如点评专家所指出的,辩论赛的价值不在于“非此即彼”的胜负判定,而在于通过证据碰撞明确不同治疗策略的适用边界:对于新药不可及、分子分型不明或TP53突变等特殊高危亚型患者,ASCT仍是安全有效的一线巩固选择;对于新药可及、经诱导治疗达到深度MRD阴性的患者,可考虑豁免ASCT,以减少治疗毒性并改善生活质量。
未来,随着更多头对头临床研究的开展、基因分型技术的普及以及新药可及性的提升,高危 DLBCL 的治疗将实现从“标准化”到“精准化”的跨越,真正实现“一人一策”的最优治疗目标。而这场辩论所展现的循证思维与临床智慧,无疑将为这一进程注入重要动力。
排版编辑:Mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


