

洛莫司汀(Lomustine),又称CCNU,是亚硝基脲类烷化剂家族的一员。作为一种单功能烷化剂,它能使DNA和RNA烷基化,并能诱导DNA链间交联,从而以细胞周期非依赖性的方式发挥抗肿瘤作用。洛莫司汀诱导的关键DNA损伤——O6-氯乙基鸟嘌呤的形成,可被O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)修复,这是其产生耐药的主要机制。此外,洛莫司汀还可能通过氨甲酰化作用抑制某些酶的功能,但该作用对临床疗效的贡献尚不明确。
作为一种高脂溶性药物,洛莫司汀能有效穿透血脑屏障,这使其成为治疗原发性脑肿瘤的理想候选药物。其主要剂量限制性毒性是延迟性骨髓抑制,通常在给药后5周左右达到峰值,因此其给药间隔通常为6-8周。
本文于2020年发表于Cancer Treatment Reviews1,探讨了洛莫司汀用于治疗胶质母细胞瘤的疗效和安全性,旨在为该药物的应用和未来探索方向提供参考。
洛莫司汀在复发性胶质母细胞瘤中的应用
表1总结了所有已发表的、以洛莫司汀作为对照组治疗复发性胶质母细胞瘤(GBM)的随机临床试验数据2-9。这些试验一致表明,洛莫司汀单药治疗的客观缓解率较低(约10%),中位无进展生存期(PFS)不超过2个月。6个月无进展生存率(PFS-6)——该类试验的常用终点——约为20%,这被广泛认为是评估新药疗效的基准。少数报告了MGMT启动子甲基化状态的试验显示,在MGMT启动子未甲基化的肿瘤中,洛莫司汀几乎没有活性4,6,8。
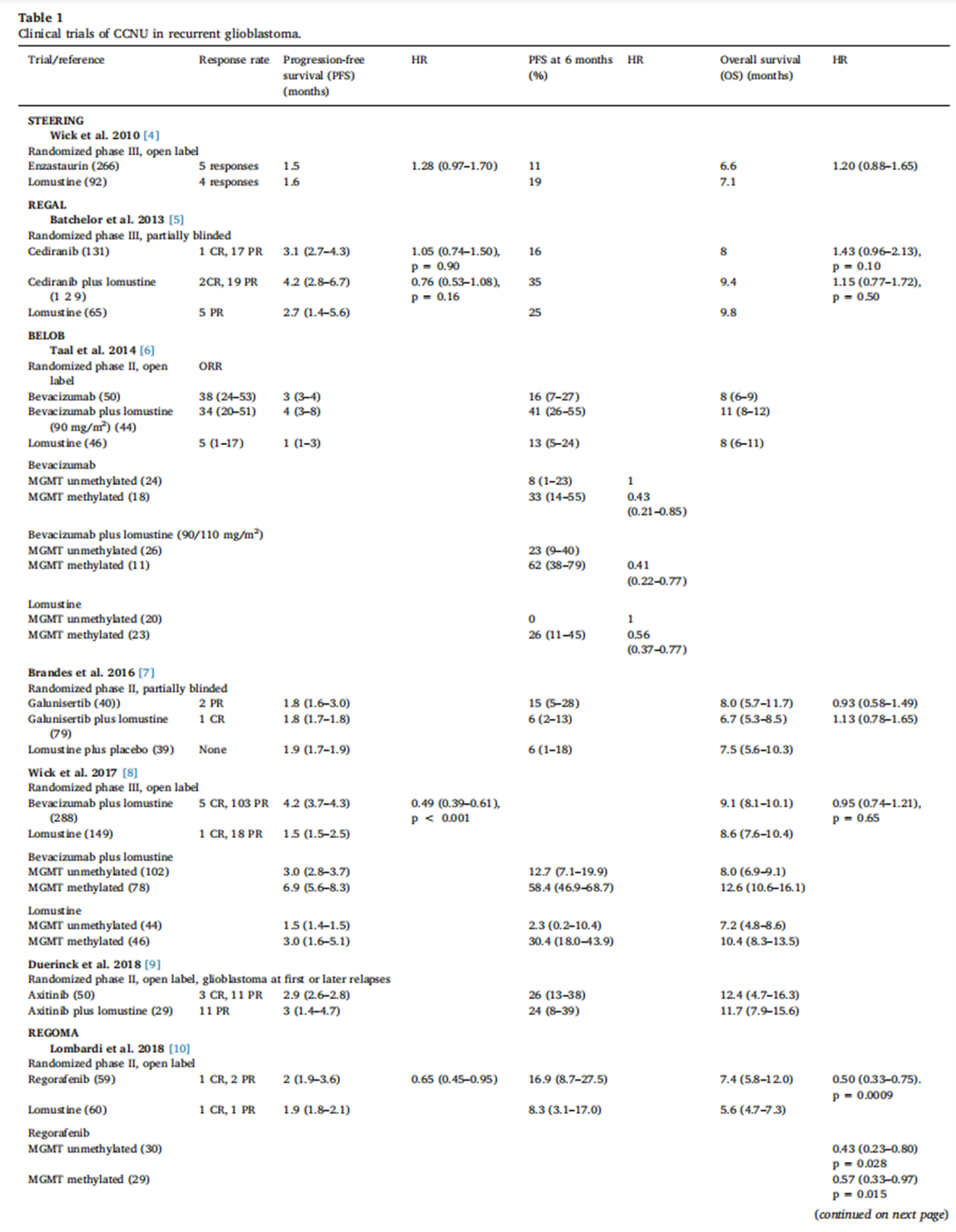

在这些试验中,随机化后的中位总生存期(OS)在6-9个月之间,试验间的OS差异可能主要由患者选择的差异驱动。在所有这些试验中,除了瑞戈非尼(Regorafenib)外,没有一种试验药物显示出优于洛莫司汀的疗效。然而,报告瑞戈非尼阳性结果的REGOMA试验是一项中等规模的II期研究,其两组间存在一些预后因素的不平衡(如瑞戈非尼组患者年龄更轻、MGMT甲基化比例更高),且该试验中洛莫司汀对照组的疗效似乎劣于历史数据,这些都使得其结论存在一定争议8。
值得注意的是,我们至今仍缺少一项将洛莫司汀与安慰剂或最佳支持治疗进行直接比较的随机试验,来明确证实其在复发性GBM中的确切疗效。比利时一项关于阿昔替尼(Axitinib)的小型研究或许最接近这种设计,该研究比较了阿西替尼联合洛莫司汀与阿西替尼单药治疗,出乎意料地发现加用洛莫司汀并未带来额外获益7。
洛莫司汀在新诊断胶质母细胞瘤中的探索
尽管洛莫司汀在复发GBM中地位稳固,但其在一线治疗中的角色一直不明确。早年在英国进行的PCV方案(包含洛莫司汀)用于新诊断GBM的试验结果令人失望10。然而,近年来,随着对分子标志物认识的加深,洛莫司汀在一线治疗中的价值被重新审视。
UKT-03是一项小型的II期研究,探索了洛莫司汀联合替莫唑胺(TMZ)及放疗的方案。其设计初衷是希望通过TMZ耗竭MGMT,从而增强洛莫司汀的疗效。结果显示,该联合方案对MGMT未甲基化的GBM无明显益处,但对MGMT甲基化的患者显示出强烈的生存获益信号11。基于此,一项随机III期试验(CeTeG/NOA-09)被启动,其结果进一步证实,在MGMT甲基化的新诊断GBM患者中,洛莫司汀-TMZ联合放疗方案优于标准的TMZ同步及辅助化疗方案12。
洛莫司汀作为PCV方案的关键组成部分
洛莫司汀最令人信服的疗效数据来自于其作为PCV方案(联合丙卡巴肼和长春新碱)的一部分。三项大型随机临床试验证实,在低级别(WHO II/III级)胶质瘤中,放疗联合PCV辅助化疗显著优于单纯放疗13-15。
亚组分析表明,PCV方案的疗效与肿瘤的分子特征密切相关:
在1p/19q共缺失的少突胶质细胞瘤中活性最强。
在IDH突变型星形细胞瘤中也显示出明确疗效。
在IDH野生型肿瘤(即大部分GBM)中的活性仍不确定。
PCV方案中各组分的贡献一直存在争议。长春新碱因其难以穿透血脑屏障且具有显著的神经毒性,其在方案中的必要性受到质疑。丙卡巴肼作为一种烷化剂,其单药活性低于TMZ16。因此,CeTeG/NOA-09试验探索的洛莫司汀联合TMZ方案,可以被看作是对PCV方案的一种优化和改良。
洛莫司汀的耐受性与安全性
洛莫司汀是一种具有中度致吐风险的化疗药物,需常规使用止吐药预防。其最主要的剂量限制性毒性是延迟性血小板减少,通常需要剂量调整、治疗延迟甚至停药。尽管存在骨髓抑制,但继发性骨髓增生异常综合征或白血病的风险在GBM患者中相对较低,这可能与患者有限的预期寿命有关。然而,随着PCV方案在预后更好的低级别胶质瘤患者中应用增多,这种远期并发症的风险值得关注。
非血液学毒性中,肝毒性偶有报道。肺纤维化是亚硝基脲类药物一种罕见但可能危及生命的毒性,但在临床试验中其发生率极低。
结论与未来方向
尽管存在局限性,洛莫司汀目前仍是除TMZ外,在胶质瘤治疗中应用最广泛的药物。在欧洲,它与贝伐珠单抗一同被EANO指南定义为复发性GBM的标准治疗选择17。同时,它也是IDH突变型胶质瘤标准治疗方案PCV的关键组成部分。
未来的研究方向可能包括:
1、优化毒性管理:探索使用血小板生成素受体激动剂(如罗米司亭)等药物来减轻洛莫司汀引起的血小板减少,从而可能实现更优的药物暴露。
2、基于分子标志物的精准治疗:在未来的临床试验设计中,应根据MGMT启动子甲基化状态对患者进行分层,并设定不同的疗效预期。
毫无疑问,洛莫司汀在过去和未来都将在胶质瘤的治疗中扮演重要角色。
1. Weller M, Le Rhun E. How did lomustine become standard of care in recurrent glioblastoma?[J]. Cancer treatment reviews, 2020, 87: 102029.
2. Wick W, Puduvalli V K, Chamberlain M C, et al. Phase III study of enzastaurin compared with lomustine in the treatment of recurrent intracranial glioblastoma[J]. Journal of clinical oncology, 2010, 28(7): 1168-1174.
3. Batchelor T T, Mulholland P, Neyns B, et al. Phase III randomized trial comparing the efficacy of cediranib as monotherapy, and in combination with lomustine, versus lomustine alone in patients with recurrent glioblastoma[J]. Journal of Clinical Oncology, 2013, 31(26): 3212-3218.
4. Taal W, Oosterkamp H M, Walenkamp A M E, et al. Single-agent bevacizumab or lomustine versus a combination of bevacizumab plus lomustine in patients with recurrent glioblastoma (BELOB trial): a randomised controlled phase 2 trial[J]. The lancet oncology, 2014, 15(9): 943-953.
5. Brandes A A, Carpentier A F, Kesari S, et al. A Phase II randomized study of galunisertib monotherapy or galunisertib plus lomustine compared with lomustine monotherapy in patients with recurrent glioblastoma[J]. Neuro-oncology, 2016, 18(8): 1146-1156.
6. Wick W, Gorlia T, Bendszus M, et al. Lomustine and bevacizumab in progressive glioblastoma[J]. New England Journal of Medicine, 2017, 377(20): 1954-1963.
7. Duerinck J, Du Four S, Bouttens F, et al. Randomized phase II trial comparing axitinib with the combination of axitinib and lomustine in patients with recurrent glioblastoma[J]. Journal of neuro-oncology, 2018, 136(1): 115-125.
8. Lombardi G, De Salvo G L, Brandes A A, et al. Regorafenib compared with lomustine in patients with relapsed glioblastoma (REGOMA): a multicentre, open-label, randomised, controlled, phase 2 trial[J]. The Lancet Oncology, 2019, 20(1): 110-119.
9. Van Den Bent M, Eoli M, Sepulveda J M, et al. INTELLANCE 2/EORTC 1410 randomized phase II study of Depatux-M alone and with temozolomide vs temozolomide or lomustine in recurrent EGFR amplified glioblastoma[J]. Neuro-oncology, 2020, 22(5): 684-693.
10. Medical Research Council Brain Tumour Working Party. Randomized trial of procarbazine, lomustine, and vincristine in the adjuvant treatment of high-grade astrocytoma: a Medical Research Council trial[J]. Journal of Clinical Oncology, 2001, 19(2): 509-518.
11. Herrlinger U, Rieger J, Koch D, et al. Phase II trial of lomustine plus temozolomide chemotherapy in addition to radiotherapy in newly diagnosed glioblastoma: UKT-03[J]. Journal of clinical oncology, 2006, 24(27): 4412-4417.
12. Herrlinger U, Tzaridis T, Mack F, et al. Lomustine-temozolomide combination therapy versus standard temozolomide therapy in patients with newly diagnosed glioblastoma with methylated MGMT promoter (CeTeG/NOA–09): a randomised, open-label, phase 3 trial[J]. The lancet, 2019, 393(10172): 678-688.
13. Cairncross G, Wang M, Shaw E, et al. Phase III trial of chemoradiotherapy for anaplastic oligodendroglioma: long-term results of RTOG 9402[J]. Journal of clinical oncology, 2013, 31(3): 337-343.
14. Van den Bent M J, Brandes A A, Taphoorn M J B, et al. Adjuvant procarbazine, lomustine, and vincristine chemotherapy in newly diagnosed anaplastic oligodendroglioma: long-term follow-up of EORTC brain tumor group study 26951[J]. Journal of clinical oncology, 2013, 31(3): 344-350.
15. Buckner J C, Shaw E G, Pugh S L, et al. Radiation plus procarbazine, CCNU, and vincristine in low-grade glioma[J]. New England Journal of Medicine, 2016, 374(14): 1344-1355.
16. Yung W K A, Albright R E, Olson J, et al. A phase II study of temozolomide vs. procarbazine in patients with glioblastoma multiforme at first relapse[J]. British journal of cancer, 2000, 83(5): 588-593.
17. Weller M, Van Den Bent M, Tonn J C, et al. European Association for Neuro-Oncology (EANO) guideline on the diagnosis and treatment of adult astrocytic and oligodendroglial gliomas[J]. The lancet oncology, 2017, 18(6): e315-e329.
排版编辑:肿瘤资讯-丹忱











 苏公网安备32059002004080号
苏公网安备32059002004080号


