头颈部肿瘤是全球范围内第 6 位常见的肿瘤类型,在发展中国家,其发病率正呈迅速上升态势[1]。头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)是头颈部肿瘤的主要类型,且多数 HNSCC 患者存在表皮生长因子受体(epidermal growth factor receptor,EGFR)过表达。EGFR 过表达或扩增可驱动肿瘤增殖、转移及治疗抵抗,因此成为 HNSCC 的重要治疗靶点。值得注意的是,人乳头瘤病毒(HPV)阳性与阴性 HNSCC 在分子特征、治疗反应及预后方面存在显著差异。
为深入探索EGFR抑制剂的疗效是否受HPV状态影响,为临床治疗提供更具针对性的参考,【肿瘤资讯】特邀吉林大学第一医院肿瘤科韩福军教授,系统梳理EGFR抑制剂在HPV阳性HNSCC中的最新研究进展,深入解析单药治疗、联合化疗及免疫治疗的疗效,并探讨其潜在机制与临床启示。
CSCO头颈肿瘤专委会委员
中国医药教育协会头颈肿瘤专委会委员
中国初级卫生保健基金会头颈肿瘤专委会委员
中国抗癌协会中西医整合食管癌专委会常委
吉林省医疗保障协会肿瘤内科专委会副主委
吉林省中西医结合学会肿瘤专委会副主委
中国医药教育协会肿瘤化学治疗专委会委员
中国抗癌协会科普专委会委员
中国民族卫生协会培训部特邀专家
吉林省抗癌协会肺癌专委会常委
吉林省健康科普专家
长春市医学会医疗事故技术鉴定专家
每周三门诊
引言
HNSCC是一组起源于口腔、口咽、喉和下咽的鳞状细胞癌,占头颈部肿瘤的90%以上。HNSCC的主要风险因素为饮酒和吸烟,而HPV也是口咽癌的重要致病因素之一。与由吸烟和饮酒引发的HNSCC相比,HPV阳性的HNSCC患者通常预后更佳。目前,HPV在口咽癌发病机制中的作用已得到明确证实,但其在其他解剖部位(如口腔、喉及下咽)的致癌机制尚未完全阐明。由于临床上HPV阳性的HNSCC主要指口咽癌,因此本文将重点探讨这一特定亚型。
EGFR的激活在恶性细胞增殖、血管生成、转移以及细胞凋亡抑制等方面发挥着重要作用。EGFR过量表达和基因扩增与患者无进展生存期(PFS)和总生存期(OS)缩短密切相关[2]。目前,EGFR抑制剂,包括西妥昔单抗(一种靶向EGFR的单克隆抗体)和阿法替尼(第二代EGFR酪氨酸激酶抑制剂)已被用于HNSCC的治疗。西妥昔单抗与放疗联合应用于局部晚期HNSCC;与化疗联合应用于复发性或转移性HNSCC的一线治疗;此外,也可单药用于二线及后线治疗。对于铂类治疗失败的复发或转移性HNSCC患者,阿法替尼可作为二线及后线治疗的选择。
然而,临床上尚未发现能够准确预测EGFR抑制剂治疗HNSCC疗效的标志物。在现有的临床研究中,HPV阳性口咽癌患者数据占比相对较低。现有治疗指南主要基于HPV阴性人群的数据制定,在推荐治疗方案时未考虑患者的HPV感染状态。但临床试验显示,HPV阳性与阴性患者在接受治疗时的表现存在差异。因此,本文旨在深入探讨EGFR抑制剂在HPV阳性复发或转移性HNSCC中的治疗效果,为临床医生优化HPV阳性患者的治疗方案提供参考依据。
HPV阳性HNSCC的流行病学与分子特征
HPV相关HNSCC的致癌作用具有显著解剖学偏好性,约45%-90%的口咽癌与高危型HPV感染相关,其中高危型HPV16亚型最为常见。HPV主要通过其编码的E6和E7致癌蛋白促进肿瘤发生。E6通过招募E6AP(泛素连接酶)介导肿瘤抑制蛋白p53的泛素化降解,导致基因组稳定性丧失;E7则通过结合并降解视网膜母细胞瘤蛋白(Rb),解除其对E2F转录因子的抑制,驱动细胞周期异常进入S期[3]。这些分子事件使HPV阳性口咽癌在分子特征上区别于HPV阴性肿瘤,表现为p16蛋白的过表达。p16作为细胞周期负调控因子,其高表达与HPV感染高度一致,已成为HPV相关口咽癌的替代生物标志物。目前临床诊断主要依赖荧光原位杂交(FISH)检测HPV DNA或p16免疫组化检测,后者因操作简便、成本低且与HPV状态一致性高被广泛采用。
从治疗角度来看,HPV阳性(p16阳性)HNSCC患者对放化疗敏感性高于HPV阴性患者,生存期也显著高于p16阴性患者。然而,对于不可切除的局部晚期和复发或转移的HNSCC,当前指南尚未将p16状态作为免疫检查点抑制剂(ICI)、EGFR抑制剂及化疗的分层依据。未来需通过分子分型及生物标志物探索,进一步明确HPV阳性患者的精准治疗路径。
EGFR抑制剂单药治疗HPV阳性HNSCC
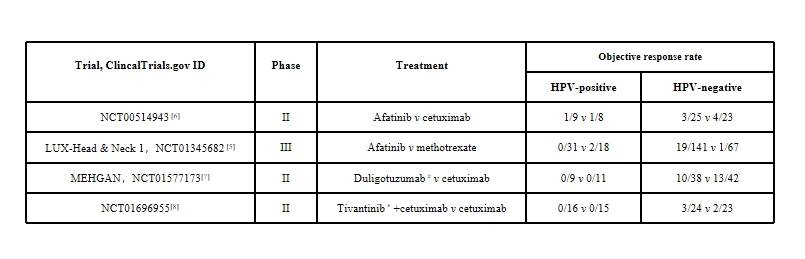
多项随机对照临床试验表明,EGFR抑制剂单药治疗在HPV阳性HNSCC中的疗效显著弱于HPV阴性患者。四项针对二线及以上复发或转移性HNSCC的研究(表1)显示,西妥昔单抗和阿法替尼在p16阳性患者中的客观缓解率(ORR)普遍低于p16阴性人群[4]。例如,Ⅲ期LUX-Head & Neck 1试验对比了阿法替尼与甲氨蝶呤在铂类化疗失败患者中的疗效,尽管整体人群的无进展生存期(PFS)显著改善(HR=0.80,95% CI 0.65-0.98,P=0.030),但亚组分析提示获益仅局限于p16阴性患者(HR=0.70,95% CI 0.50-0.97),而p16阳性亚组PFS无显著差异(HR=0.95,95% CI 0.51-1.75)[5]。尽管这些研究存在局限性(如回顾性分析、样本量不足、p16检测方法标准化缺失及缺乏直接的HPV检测),但数据的一致性表明,p16阳性的复发或转移性HNSCC患者接受EGFR抑制剂治疗的临床获益有限。
表 1 EGFR抑制剂单药治疗HPV阳性与阴性HNSCC的ORR
EGFR抑制剂联合化疗治疗HPV阳性HNSCC
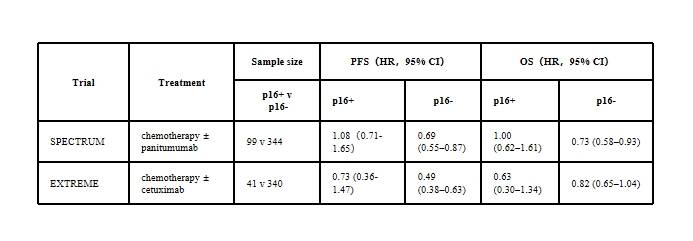
两项Ⅲ期随机对照临床试验(SPECTRUM[9]和EXTREME[10,11])评估了EGFR抑制剂(帕尼单抗、西妥昔单抗)联合化疗治疗复发或转移性HNSCC的疗效。尽管两项试验未预先根据HPV/p16状态进行分层设计,但事后亚组分析显示疗效存在显著异质性。SPECTRUM试验[9]中,帕尼单抗联合化疗显著改善了p16阴性患者的PFS和OS,而在p16阳性亚组中,PFS和OS均未观察到显著获益。EXTREME试验[10,11]中,西妥昔单抗联合化疗使p16阴性患者的PFS显著延长,OS未达到但接近统计学显著性,而p16阳性亚组的PFS和OS仅呈现数值改善趋势。上述结果表明,EGFR抑制剂联合化疗对HPV阴性患者具有明确疗效,但对HPV阳性患者的临床获益仍不明确,这一结论与Meta分析[12]中“抗EGFR治疗的有效性可能取决于p16状态和治疗方式”的汇总结果一致。
表 2 按p16分层显示EGFR 抑制剂联合化疗治疗复发或转移HNSCC的Ⅲ期临床研究的疗效
EGFR 抑制剂联合ICI治疗HPV阳性HNSCC
《复发/转移性头颈部鳞癌免疫检查点抑制剂治疗专家共识(2024年版)》指出,对于无法耐受化疗且不适合接受抗PD-1单抗单药治疗的复发或转移性(R/M)HNSCC患者,帕博利珠单抗或纳武利尤单抗联合西妥昔单抗可作为一线或后线治疗方案(3类,C级)。这一推荐基于两项Ⅱ期临床研究[13,14]。2022年发表的一项meta分析纳入了7项临床研究,共涉及802名患者[15],其中684名患者接受ICI单药治疗,118名患者接受联合治疗。
结果显示,与ICI单药治疗相比,西妥昔单抗联合治疗显著提高了HPV阴性患者的ORR(单药治疗 vs 联合治疗的汇总ORR:15% vs 46%,P<0.001),但在HPV阳性患者中未观察到显著改善(17% vs 18%,P=0.686)。在1年总生存率方面,联合治疗对HPV阴性患者疗效显著(单药治疗与联合治疗的汇总1年总生存率:36% vs 59%,P<0.001),而在HPV阳性患者中未达到统计学显著性差异(40% vs 55%,P=0.252)。因此,西妥昔单抗联合ICI仅在HPV阴性的HNSCC患者中显示出显著疗效。
小结与展望
综合上述研究,EGFR抑制剂单药治疗、联合化疗或ICI在HPV阴性复发或转移性HNSCC中均能显著改善患者生存,但其疗效在HPV阳性患者中存在局限性。鉴于目前西妥昔单抗及阿法替尼等联合方案已在复发或转移性HNSCC全人群中获得适应症,未来针对HPV阳性人群开展大规模Ⅲ期临床试验的可能性较小。因此,未来的指南可能不会根据HPV状态对EGFR抑制剂的适用人群进行分层。本综述通过系统探讨EGFR抑制剂在HPV阳性HNSCC中的疗效,为临床治疗提供了更多参考,有望推动HNSCC精准治疗的发展,从而改善患者的预后。
[1]Shibuya K, Mathers CD, Boschi-Pinto C, et al. Global and regional estimates of cancer mortality and incidence by site: II. Results for the global burden of disease 2000. BMC Cancer. 2002 Dec 26;2:37. doi: 10.1186/1471-2407-2-37. Epub 2002 Dec 26. PMID: 12502432; PMCID: PMC149364.
[2]Chung CH, Ely K, McGavran L, et al. Increased epidermal growth factor receptor gene copy number is associated with poor prognosis in head and neck squamous cell carcinomas. J Clin Oncol. 2006 Sep 1;24(25):4170-6. doi: 10.1200/JCO.2006.07.2587. PMID: 16943533.
[3]Cochicho D, Gil da Costa R, Felix A. Exploring the roles of HPV16 variants in head and neck squamous cell carcinoma: current challenges and opportunities. Virol J. 2021 Nov 8;18(1):217. doi: 10.1186/s12985-021-01688-9. PMID: 34749746; PMCID: PMC8573856.
[4]Szturz P, Seiwert TY, Vermorken JB. How Standard Is Second-Line Cetuximab in Recurrent or Metastatic Head and Neck Cancer in 2017? J Clin Oncol. 2017 Jul 10;35(20):2229-2231. doi: 10.1200/JCO.2016.71.8072. Epub 2017 May 4. PMID: 28471725.
[5]Machiels JP, Haddad RI, Fayette J, et al. Afatinib versus methotrexate as second-line treatment in patients with recurrent or metastatic squamous-cell carcinoma of the head and neck progressing on or after platinum-based therapy (LUX-Head & Neck 1): an open-label, randomised phase 3 trial. Lancet Oncol. 2015 May;16(5):583-94. doi: 10.1016/S1470-2045(15)70124-5. Epub 2015 Apr 16. PMID: 25892145.
[6]Seiwert TY, Fayette J, Cupissol D, et al. A randomized, phase II study of afatinib versus cetuximab in metastatic or recurrent squamous cell carcinoma of the head and neck. Ann Oncol. 2014 Sep;25(9):1813-1820. doi: 10.1093/annonc/mdu216. Epub 2014 Jun 13. PMID: 24928832; PMCID: PMC4143093.
[7]Fayette J, Wirth L, Oprean C, et al. Randomized Phase II Study of Duligotuzumab (MEHD7945A) vs. Cetuximab in Squamous Cell Carcinoma of the Head and Neck (MEHGAN Study). Front Oncol. 2016 Oct 31;6:232. doi: 10.3389/fonc.2016.00232. PMID: 27843803; PMCID: PMC5086582.
[8]Kochanny SE, Worden FP, Adkins DR, et al. A randomized phase 2 network trial of tivantinib plus cetuximab versus cetuximab in patients with recurrent/metastatic head and neck squamous cell carcinoma. Cancer. 2020 May 15;126(10):2146-2152. doi: 10.1002/cncr.32762. Epub 2020 Feb 19. PMID: 32073648; PMCID: PMC8011819.
[9]Vermorken JB, Stöhlmacher-Williams J, Davidenko I, et al. Cisplatin and fluorouracil with or without panitumumab in patients with recurrent or metastatic squamous-cell carcinoma of the head and neck (SPECTRUM): an open-label phase 3 randomised trial. Lancet Oncol. 2013 Jul;14(8):697-710. doi: 10.1016/S1470-2045(13)70181-5. Epub 2013 Jun 6. PMID: 23746666.
[10]Vermorken JB, Mesia R, Rivera F, et al. Platinum-based chemotherapy plus cetuximab in head and neck cancer. N Engl J Med. 2008 Sep 11;359(11):1116-27. doi: 10.1056/NEJMoa0802656. PMID: 18784101.
[11]Vermorken JB, Psyrri A, Mesía R, et al. Impact of tumor HPV status on outcome in patients with recurrent and/or metastatic squamous cell carcinoma of the head and neck receiving chemotherapy with or without cetuximab: retrospective analysis of the phase III EXTREME trial. Ann Oncol. 2014 Apr;25(4):801-807. doi: 10.1093/annonc/mdt574. Epub 2014 Feb 26. PMID: 24577117; PMCID: PMC3969553.
[12]Su Y, Cui J, Xu D, et al. p16(INK4a) status and survival benefit of EGFR inhibitors in head and neck squamous cell cancer: A systematic review and meta-analysis. Crit Rev Oncol Hematol. 2018 Apr;124:11-20. doi: 10.1016/j.critrevonc.2018.02.006. Epub 2018 Feb 7. PMID: 29548481.
[13]Sacco AG, Chen R, Worden FP, et al. Pembrolizumab plus cetuximab in patients with recurrent or metastatic head and neck squamous cell carcinoma: an open-label, multi-arm, non-randomised, multicentre, phase 2 trial. Lancet Oncol. 2021 Jun;22(6):883-892. doi: 10.1016/S1470-2045(21)00136-4. Epub 2021 May 11. PMID: 33989559.
[14] Chung CH, Li J, Steuer CE, et al. Phase II multi-institutional clinical trial result of concurrent cetuximab and nivolumab in recurrent and/or metastatic head and neck squamous cell carcinoma. Clin Cancer Res 2022;28:2329–38. 10.1158/1078-0432.CCR-21-3849
[15]Zhang S, Zheng M, Nie D, et al. Efficacy of cetuximab plus PD-1 inhibitor differs by HPV status in head and neck squamous cell carcinoma: a systematic review and meta-analysis. J Immunother Cancer. 2022 Oct;10(10):e005158. doi: 10.1136/jitc-2022-005158. PMID: 36253001; PMCID: PMC9577924.
排版编辑:肿瘤资讯-Olivia











 苏公网安备32059002004080号
苏公网安备32059002004080号


