晚期恶性肿瘤的治疗是临床面临的重大挑战,尤其是在经历多线治疗后,患者往往面临治疗选择有限、耐药等困境。随着精准医学的不断发展,新药的涌现和治疗理念的更新为改善患者生存带来了希望。曲氟尿苷替匹嘧啶(TAS-102)、奥曲肽等药物在不同瘤种的治疗中显示出重要价值。本文通过分享三例不同类型的晚期肿瘤病例(胃癌、直肠癌、胰腺神经内分泌瘤),并结合专家点评,深入探讨个体化、多学科诊疗(MDT)协作下的全程管理策略,以期为临床实践提供参考。
病例一
病例汇报:
褚丽莎教授 滕州市中心人民医院
病例点评:
杨俊省教授 枣庄市立医院
韩勇教授 山东省肿瘤医院
山东省健康管理协会消化道肿瘤防治分会委员
枣庄医学会肿瘤微创专业委员会委员
患者基本情况
一般资料:男性,79岁。
主诉:胃癌术后1年余,复查发现转移4天。
既往史:脑梗死病史。
现病史:胃癌术后1年余,2024年11月复查发现腹腔转移。
诊疗经过
手术治疗
患者于2023年7月5日行“根治性远端胃大部切除术”,术后病理提示为胃腺癌,低分化,pT3N1M0 IIB期。免疫组化结果提示Her2表达(0)。
辅助治疗
患者术后予以“奥沙利铂+替吉奥”方案辅助化疗8周期。
患者于2024年11月8日复查,肿瘤标志物检查提示CA199 70.56U/ml。
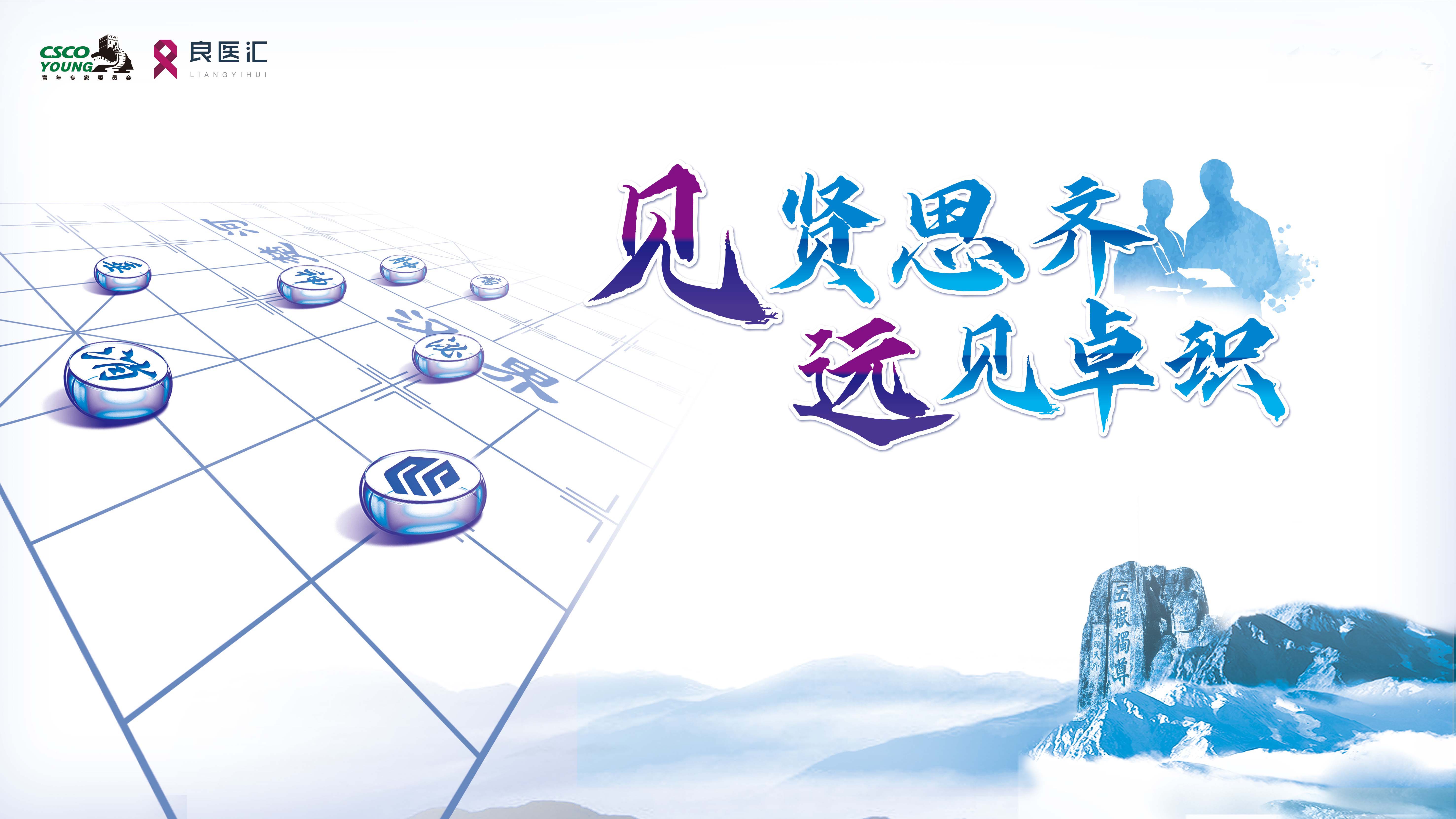
2024年11月7日门诊复查胸部及全腹部强化CT示左侧肾上腺外侧肿块考虑转移。移(图1)。2024年11月12日PET-CT结果示肠系膜上静脉右旁及左侧脾静脉后方转移瘤。
目前诊断:
1.胃癌术后腹腔转移(rT3N1M1 Ⅳ期)
2.陈旧性脑梗死
一线治疗
患者于2024年11月18日予以TAS-102口服化疗,同步联合腹腔转移瘤姑息放疗(46.8Gy)。
治疗2月后复查,病灶明显缩小,肿瘤标志物下降,疗效评价为部分缓解(PR)。后继续口服TAS-102维持治疗。
治疗5月余后,患者于2025年3月30日复查发现肝右叶新发转移灶,疗效评价为疾病进展(PD)。
二线治疗
患者予以阿帕替尼治疗。
应用阿帕替尼2月后,复查提示肝转移灶增大,患者最终放弃治疗。
病例小结
该患者为一名79岁高龄男性,胃癌术后复发转移,合并脑梗死病史。在出现腹腔转移后,一线创新性地采用TAS-102口服化疗联合局部姑息放疗的模式,取得了PR的良好疗效,PFS达5个多月,且患者耐受性良好。
病例二
病例汇报:
崔红霞教授 济宁市第一人民医院
病例点评:
姜书梅教授 山东省肿瘤医院
张国栋教授 山东省肿瘤医院
于哲教授 山东大学第二医院
现任中国老年学和老年医学学会精准医疗分会委员
山东省医学会精准医学分会委员
山东省医学会姑息医学分会委员
山东省医学会放疗分会青年学组委员
山东省抗癌协会生物治疗分会委员
患者基本情况
一般资料:女性,63岁。
现病史:2019年1月因“肛门坠痛、大便次数增多1月”就诊。
辅助检查:肠镜示:进镜10cm见直肠占位阻塞管腔,活检病理:(直肠)腺癌。
诊疗经过
手术治疗
患者于2019年4月13日行“腹腔镜下直肠癌根治+肠粘连松解术”。
术后病理示:溃疡型中-低分化腺癌,癌侵透全层并累及神经,脉管内未查见癌栓;切缘阴性;肠周淋巴结0/18查见转移。
基因检测示:KRAS基因2号外显子突变;NRAS/BRAF/PIK3CA无突变;MSS。
目前诊断:直肠腺癌(pT4bN0M0 IIB期)、高血压病(2级 高危)。
辅助治疗
患者于2019年5月10日至2019年9月30日予以XELOX方案6周期。
2019年6月3至2019年7月31日行局部放疗:46.8Gy/26f。
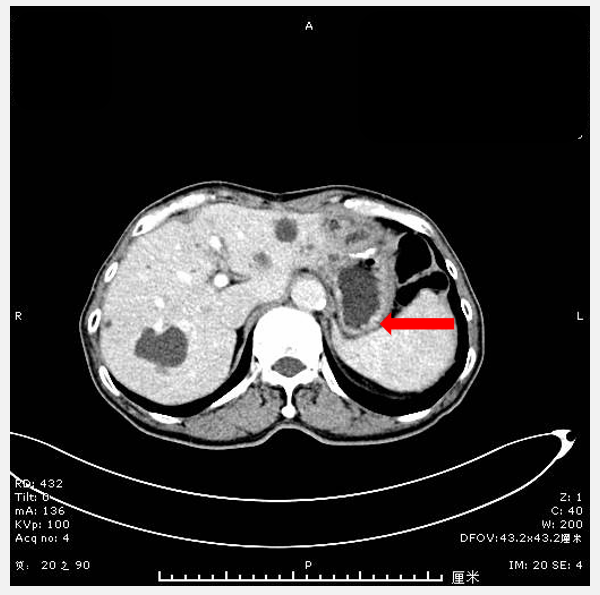
患者于2020年9月17日复查胸腹部CT示双肺可见多发小结节及空洞,部分病灶较前(2020年4月2日)增大,转移不除外(图2);双肺少许炎症;肝内小囊肿可能;左侧肾上腺增粗;直肠术后所见。
一线治疗
患者于2020年9月22日至2020年12月20日予以“奥沙利铂+卡培他滨+贝伐珠单抗”方案治疗5周期,2021年1月11日开始行“贝伐珠单抗+卡培他滨”维持治疗至2024年3月。
期间定期复查,疗效评价为疾病稳定(SD)。
2024年4月复查胸腹部CT提示肺内病灶较前增大,肝内新发病灶。疗效评估为PD。
患者于2024年4月25日行CT引导下左肺转移瘤射频消融术。
二线治疗
患者于2024年5月至2024年9月予以“伊立替康+雷替曲塞”方案治疗。
2024年8月2日行肝转移瘤射频消融术。
治疗期间影像学评价的SD,患者于2024年10月至2025年1月予以“贝伐珠单抗+卡培他滨”维持。
2025年2月5日上腹+颅脑MR提示:左侧额叶异常信号,考虑转移瘤;肝SⅥ异常信号影,较前新发,转移瘤可考虑。
2025年2月18日行颅脑转移瘤射波刀治疗3次。
2025年3月31日腹部MR提示:肝SⅥ异常信号影,较前增大;肝SⅣ异常信号影,较前新发。
疗效评价为PD。
三线治疗
患者于2025年4月至2025年5月予以TAS-102单药口服治疗。
治疗期间血常规、肝肾功能、尿常规正常。
影像学评价为SD。
病例小结
该患者为一名63岁女性,直肠癌术后出现多发转移。整个治疗过程充分体现了MDT指导下的全程管理理念,通过化疗、靶向治疗与射频消融、放疗等局部手段联合,包括应用TAS-102,使患者的总生存期(OS)已超过6年,生活质量良好。
病例三
病例汇报:
李慧教授 济宁医学院附属医院
病例点评:
徐菁教授 山东省肿瘤医院
高宏丽教授 济南市第四人民医院
刘孟瑶教授 山东省肿瘤医院
北京癌症防治学会食管癌专业委员会青年委员会常务委员
山东省抗癌协会癌症康复分会青年委员会常务委员
山东省医师协会肿瘤科医师分会委员
山东省医师协会肿瘤科医师分会临床试验学会委员
山东省抗癌协会靶向治疗分会青年委员
山东省研究型医院协会肿瘤转移分会委员
山东省癌痛与姑息治疗专业委员会委员
济宁市医学会肿瘤放疗分会委员
济宁市医学会肿瘤学分会委员
意大利锡耶纳大学医院访问学者
患者基本情况
一般资料:男性,54岁。
现病史:2024年6月13日因右上腹疼痛就诊。
辅助检查:
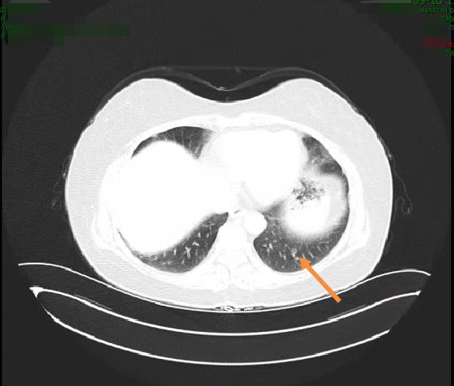
2024年6月20日行腹部强化CT检查提示:肝内多发占位性病变,考虑转移瘤可能大;胰头部占位性病变伴周围淋巴结增大,考虑恶性,胰腺癌或恶性胰腺神经内分泌瘤可能大(图3)。
2024年6月18日行超声引导下肝占位穿刺活检,病理提示:查见呈片状及巢状异型增生的上皮细胞伴坏死,符合神经内分泌瘤(NET:G2)。免疫组化:CD56(+),CgA(+),Syn(+),SSTR2(3+),CD10(-),CD34(-),Hepatocyte(-),GPC-3(-),Beta-catenin细胞核(-),INSM1(+),insulin(-),P53(野生型表达)RB1(+),Ki-67(+,局部约3%)。
初步诊断:胰腺神经内分泌瘤伴肝转移(cT3N1M1a Ⅳ期)。
诊疗经过
一线治疗
患者于2024年6月24日、8月2日行TACE治疗2次,并自2024年7月1日予以奥曲肽微球(30mg,每28天一次)治疗。
复查影像学检查,疗效评估为PR。
2025年4月7日复查,肝脏病灶持续显著缩小,疗效评估为“大PR”。
病例小结
该患者为一名54岁男性,初诊即为晚期胰腺神经内分泌瘤(G2),肝脏负荷大。治疗上采取TACE减瘤与奥曲肽微球控制全身病灶相结合的策略,迅速取得了显著的肿瘤退缩,并维持了长期的疾病控制,最终达到“大PR”的深度缓解。
总结
通过三例不同瘤种(胃癌、直肠癌、胰腺神经内分泌瘤)的晚期病例分享与深入讨论,集中展现了个体化、多学科、全程管理的治疗理念在临床实践中的重要价值。无论是通过TAS-02口服药物为高龄胃癌患者带来获益,还是采用化疗、靶向与局部治疗的联合实现直肠癌患者的超长生存,抑或利用奥曲肽联合TACE为NETs患者带来深度缓解,这些真实世界的病例均体现了基于患者具体情况、肿瘤生物学行为和治疗目标制定动态、精准治疗策略。未来,随着对肿瘤认识的加深和更多创新疗法的出现,晚期肿瘤的治疗将更加精准化和人性化,有望为更多患者带来生存希望和生活质量的改善。
排版编辑:肿瘤资讯-jyy











 苏公网安备32059002004080号
苏公网安备32059002004080号


