备受瞩目的2025年中国临床肿瘤学会(CSCO)年度进展研讨会暨Best of ASCO 2025 China会议,于2025年7月4日~5日在南京隆重举行。届时,肿瘤学领域的顶尖专家将齐聚金陵,共同回顾并深入探讨过去一年中国临床肿瘤学领域的重大研究进展,同时分享刚刚落幕的美国临床肿瘤学会(ASCO)年会的前沿成果。
为便于广大读者迅速掌握多发性骨髓瘤(MM)的学术精髓,【肿瘤资讯】特此对血液肿瘤专场的部分重磅内容进行梳理与呈现,以飨读者。
从给药方式优化到治疗策略思辨——重塑MM治疗格局的关键研究

在本届ASCO年会上,多项关于MM领域的关键研究成果得以公布,来自哈尔滨血液病肿瘤研究所的贡铁军教授对部分重要研究进行了系统性的梳理与深度的学术解读。
Abstract 7506:伊沙妥昔单抗 (Isa)皮下注射(SC)通过贴体给药系统(OBDS)对比静脉注射(IV)联合泊马度胺和地塞米松(Pd)治疗复发/难治性MM(RRMM)的随机、非劣效性川期IRAKLIA研究结果
随着伊沙妥昔单抗(Isatuximab, Isa)在多发性骨髓瘤(MM)治疗中标准地位的确立及其应用周期的延长,开发更为便捷、高效的给药方式以优化患者治疗体验已成为重要的临床需求。为此,一项名为IRAKLIA的III期、国际多中心、随机、开放标签、非劣效性临床试验应运而生,旨在评估创新的伊沙妥昔单抗皮下穿戴式注射剂(Isa SC OBI)联合泊马度胺和地塞米松(Pd)方案,相较于标准静脉输注(IV)联合Pd方案,在复发/难治性MM(RRMM)患者中的疗效与安全性。
该研究采用了创新的OBI给药系统,可实现固定剂量的自动注射,并基于皮下组织压进行个体化流速调节。研究结果显示,该试验成功达到了其共同主要终点:在药代动力学(PK)方面,Isa SC OBI组在稳态下的谷浓度(Ctrough)非劣于IV组,其几何平均比值的90%置信区间下限(1.316)显著高于预设的0.8非劣效界值。
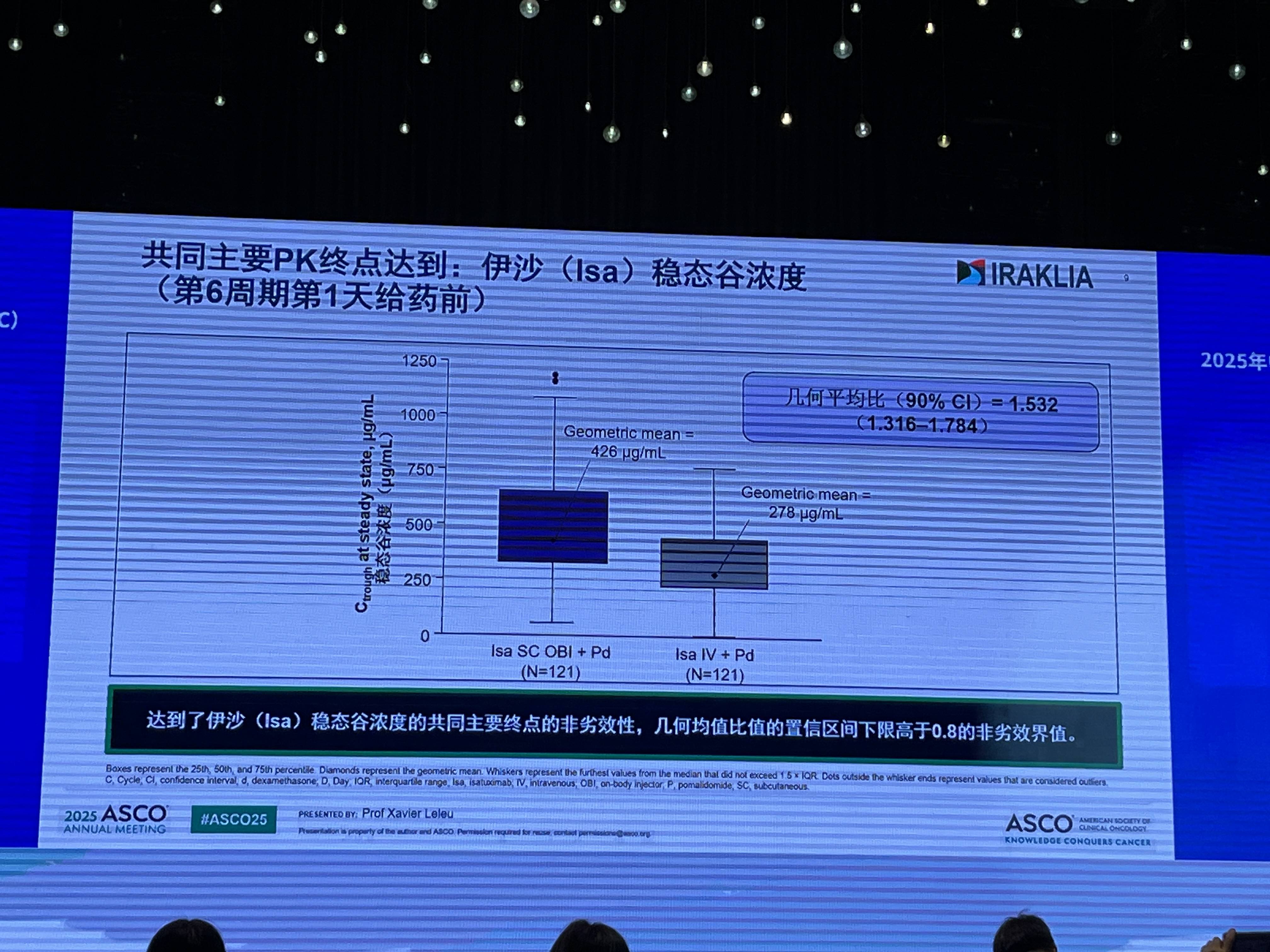
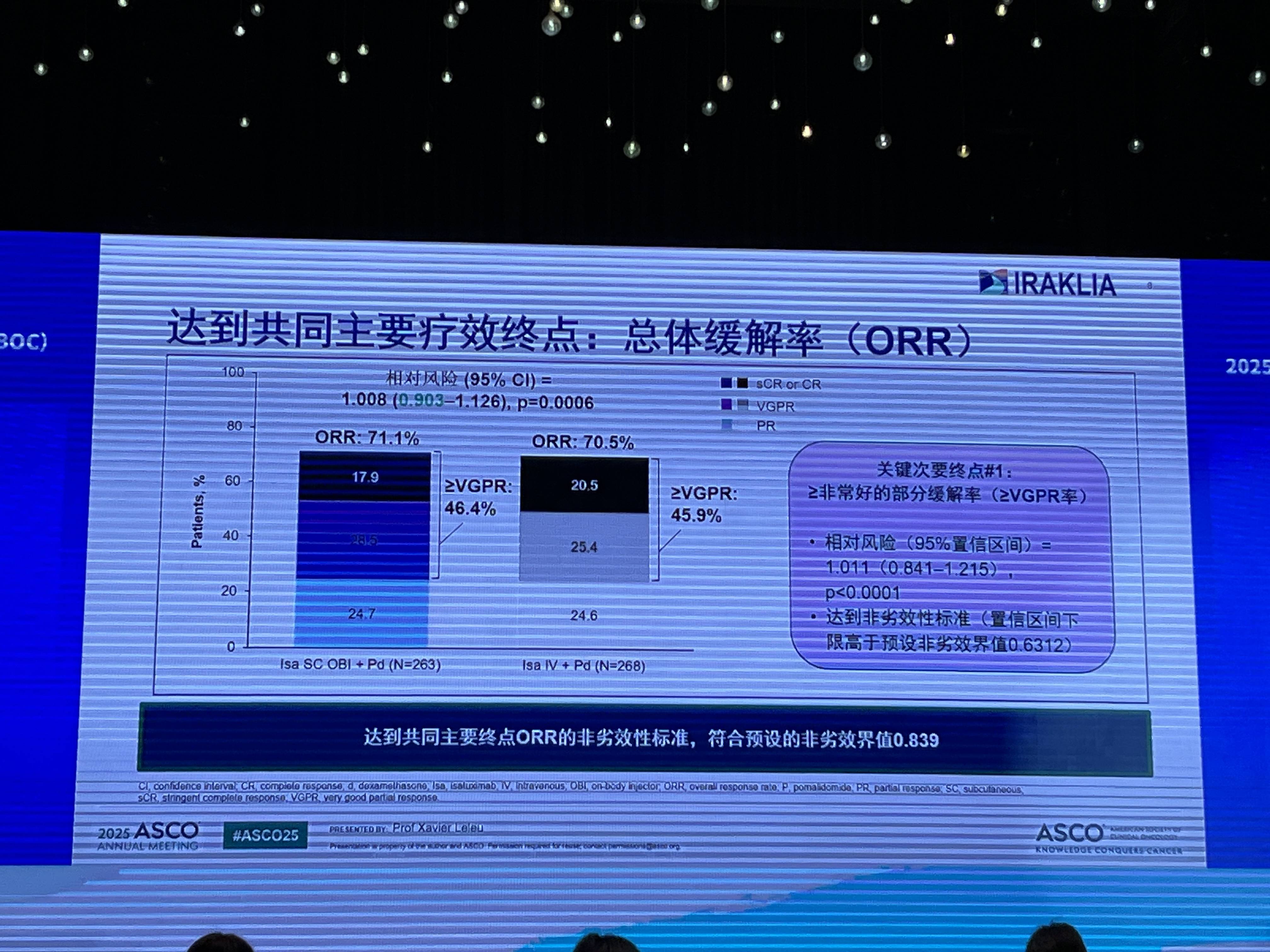
在疗效方面,Isa SC OBI组的总体缓解率(ORR)同样非劣于IV组(分别为71.1% vs 70.5%),且深度缓解(≥VGPR)率相当(46.4% vs 45.9%)。
在主要疗效终点方面,Isa SC OBI组ORR达到71.1%,≥非常好的部分缓解率(VGPR)达到46.4%,而IV组ORR为70.5%(P=0.0006),≥VGPR率为45.9%。研究达到共同主要终点ORR的非劣效性标准,符合预设的非劣效界值0.839。
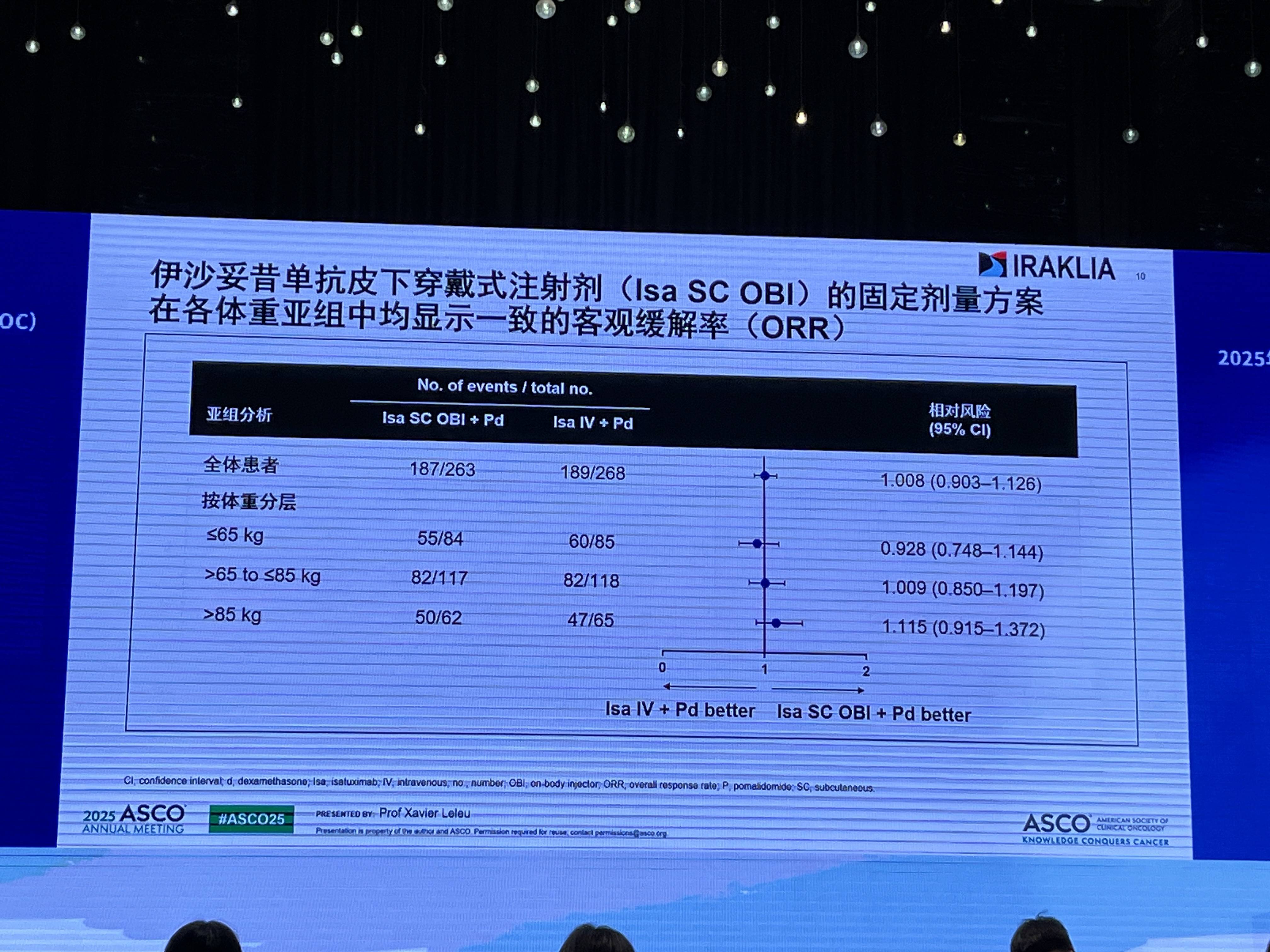
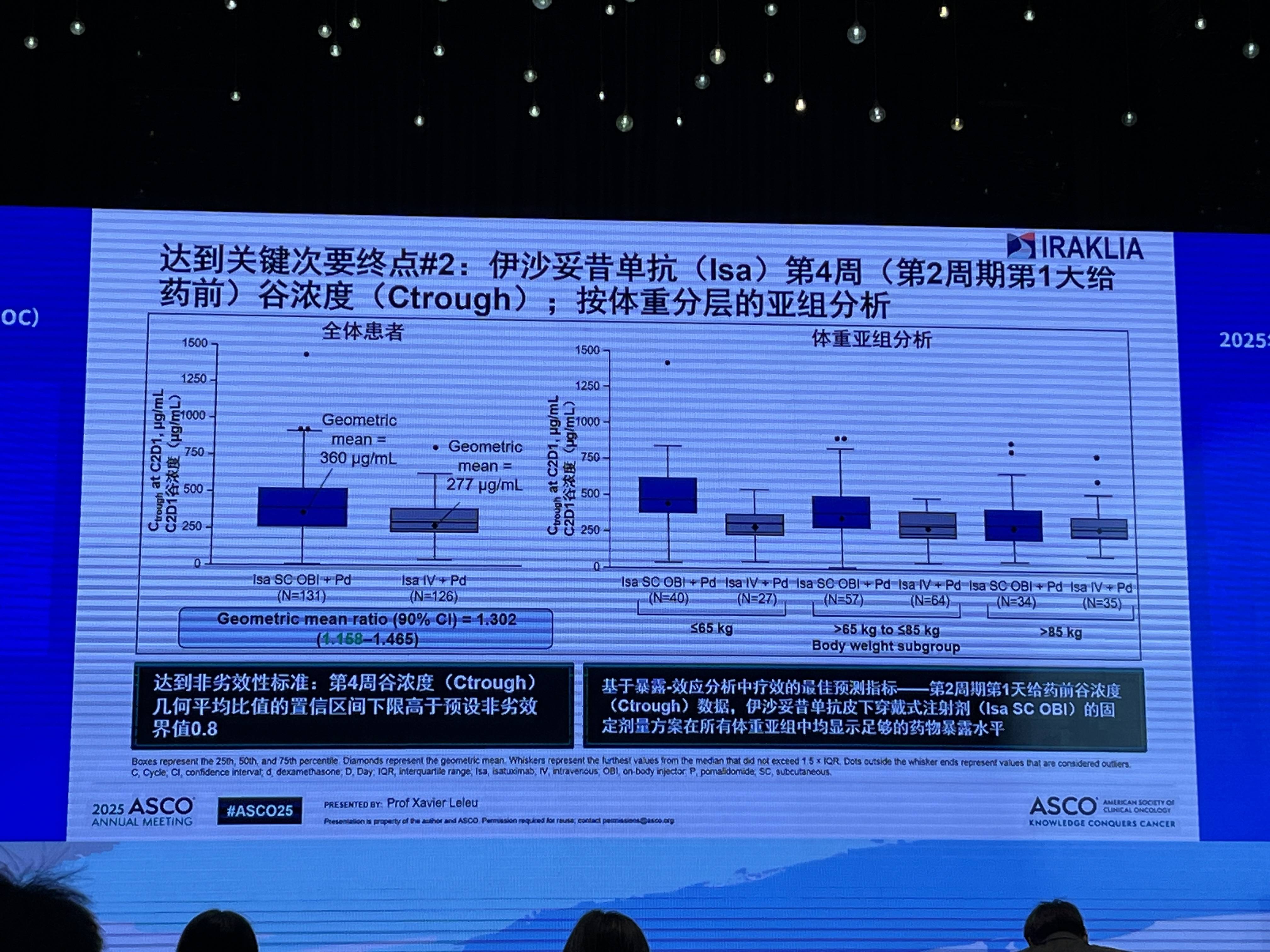
此外,基于暴露-效应分析,Isa SC OBI的固定剂量方案在所有体重亚组中均能提供充足的药物暴露水平和一致的疗效。
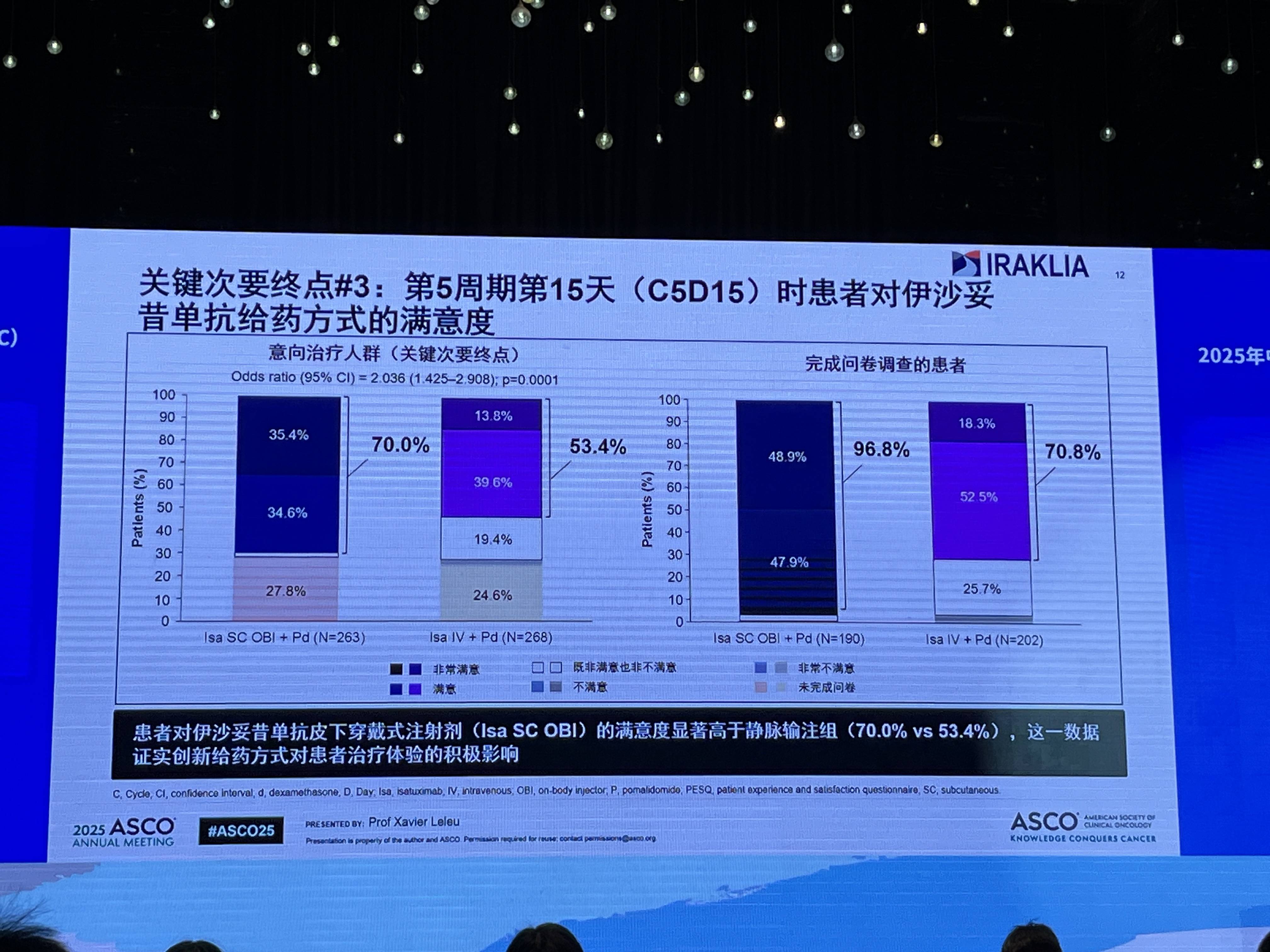
在患者体验方面,Isa SC OBI组在治疗满意度上显著优于IV组(C5D15时满意度分别为70.0% vs 53.4%)。
安全性方面,两组的整体安全性特征相似,未观察到新的非预期安全性信号;值得注意的是,Isa SC OBI组的局部注射部位反应(ISRs)发生率极低(0.4%),且绝大多数反应轻微并于当日缓解。
在给药效率上,超过99.9%的OBI给药得以顺利完成,中位注射时长仅为13分钟。
综上所述,作为首个在MM领域III期临床试验中评估创新型免手-持穿戴式给药装置(OBI)的研究,IRAKLIA的数据证实了Isa SC OBI方案相较于标准IV方案的非劣效性,并展现出更优的患者满意度和临床便利性,有力支持其成为MM患者治疗的新标准选择。
Abstract 7500:适合移植的新诊断多发性骨髓瘤患者(NDMM)接受IsaKRd 诱导治疗后采用MRD驱动的治疗策略——III期MIDAS试验主要终点
对于适合移植的新诊断多发性骨髓瘤(NDMM)患者,以抗CD38单抗为基础的四联方案(如IsaKRd或Dara-KRd)进行诱导治疗,继以自体造血干细胞移植(ASCT),是当前的标准化治疗模式。这类方案能够带来极高的深度缓解率,其中,微小残留病(MRD)阴性状态已被证实是预测患者无进展生存期(PFS)和总生存期(OS)的强效独立预后因素。
尽管多项III期研究证实ASCT相较于非移植方案能显著改善PFS,但其对于诱导治疗后已达MRD阴性的患者能否带来额外获益,仍是领域内的一大争议。此外,国际指南对高危患者推荐的序贯双次ASCT策略,其证据主要来源于既往的三联方案时代。
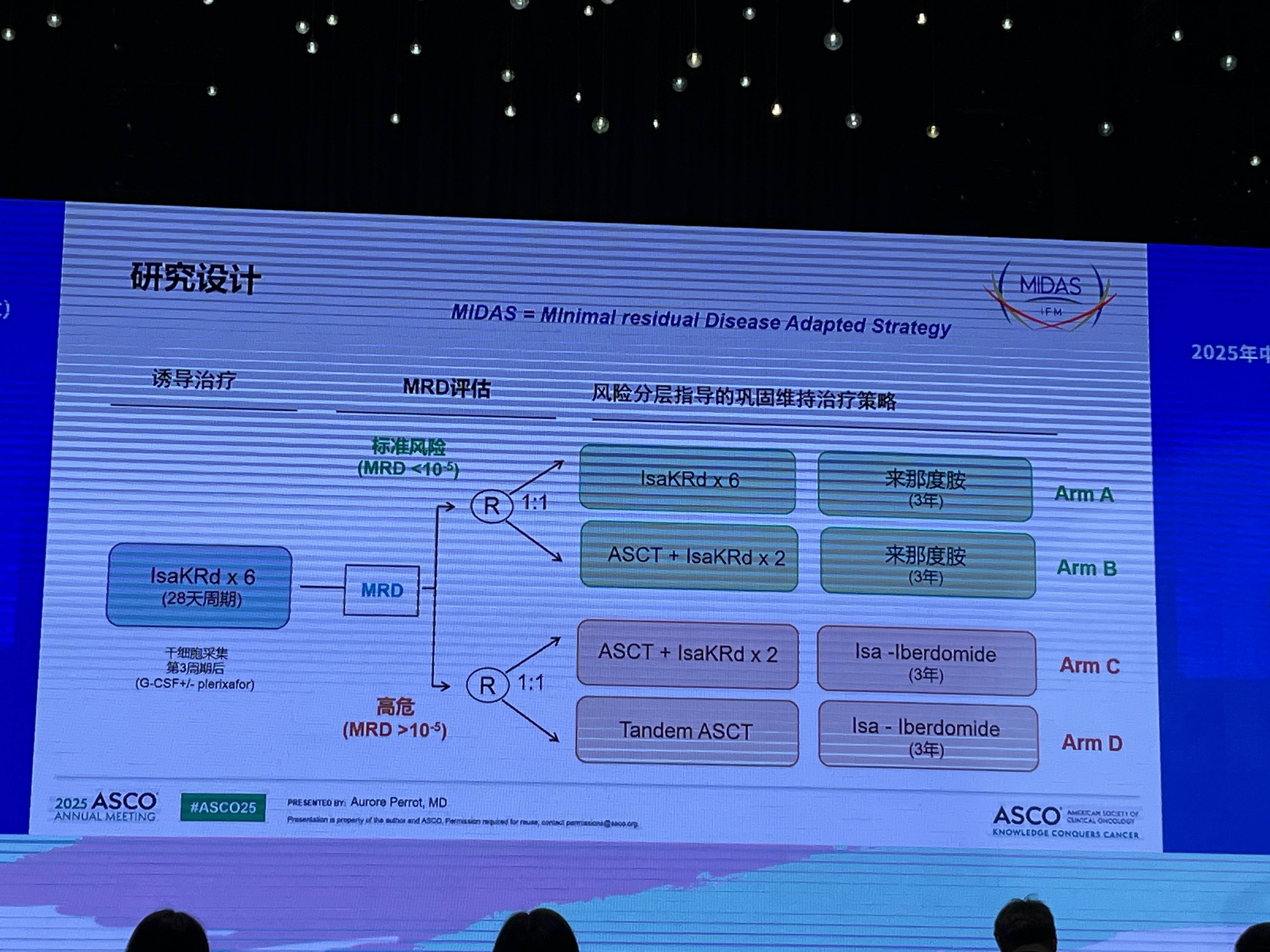
在此背景下,一项前瞻性III期临床试验——MIDAS研究(NCT04934475)正在进行中,旨在评估在高效的IsaKRd方案诱导后,采用MRD指导下的个体化巩固治疗策略的价值。
该研究中,入组的NDMM患者在接受IsaKRd诱导治疗后,依据其MRD状态进行风险分层。标准风险患者按1:1比例随机分配至非移植巩固组(A组:IsaKRd + 来那度胺维持)或单次移植巩固组(B组:ASCT + IsaKRd + 来那度胺维持);高危患者则按1:1比例随机分配至单次移植组(C组:ASCT + IsaKRd + Isa-Iberdomide维持)或双次移植组(D组:Tandem ASCT + Isa-Iberdomide维持)。
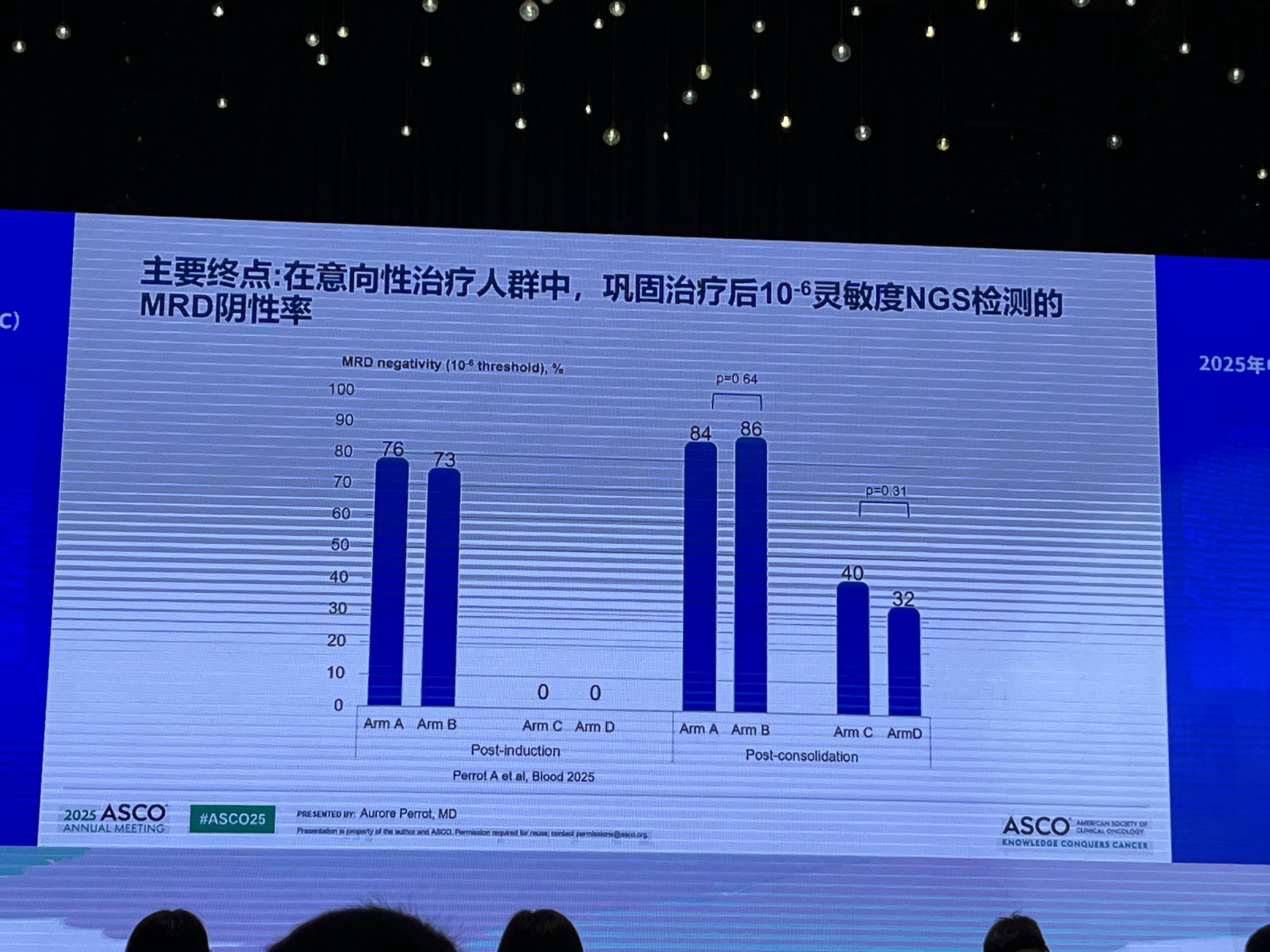
初步结果显示,各治疗组的患者基线特征均衡。在主要终点方面,意向性治疗(ITT)人群分析表明,所有四个治疗组在完成巩固治疗后,以二代测序(NGS)技术在10⁻⁶灵敏度下检测的MRD阴性率均较诱导后显著提高。然而,关键的组间比较显示,标准风险队列中,移植组(B组)与非移植组(A组)的MRD阴性率未见统计学差异;同样,在高危队列中,双次移植组(D组)与单次移植组(C组)的MRD阴性率亦无显著差异。
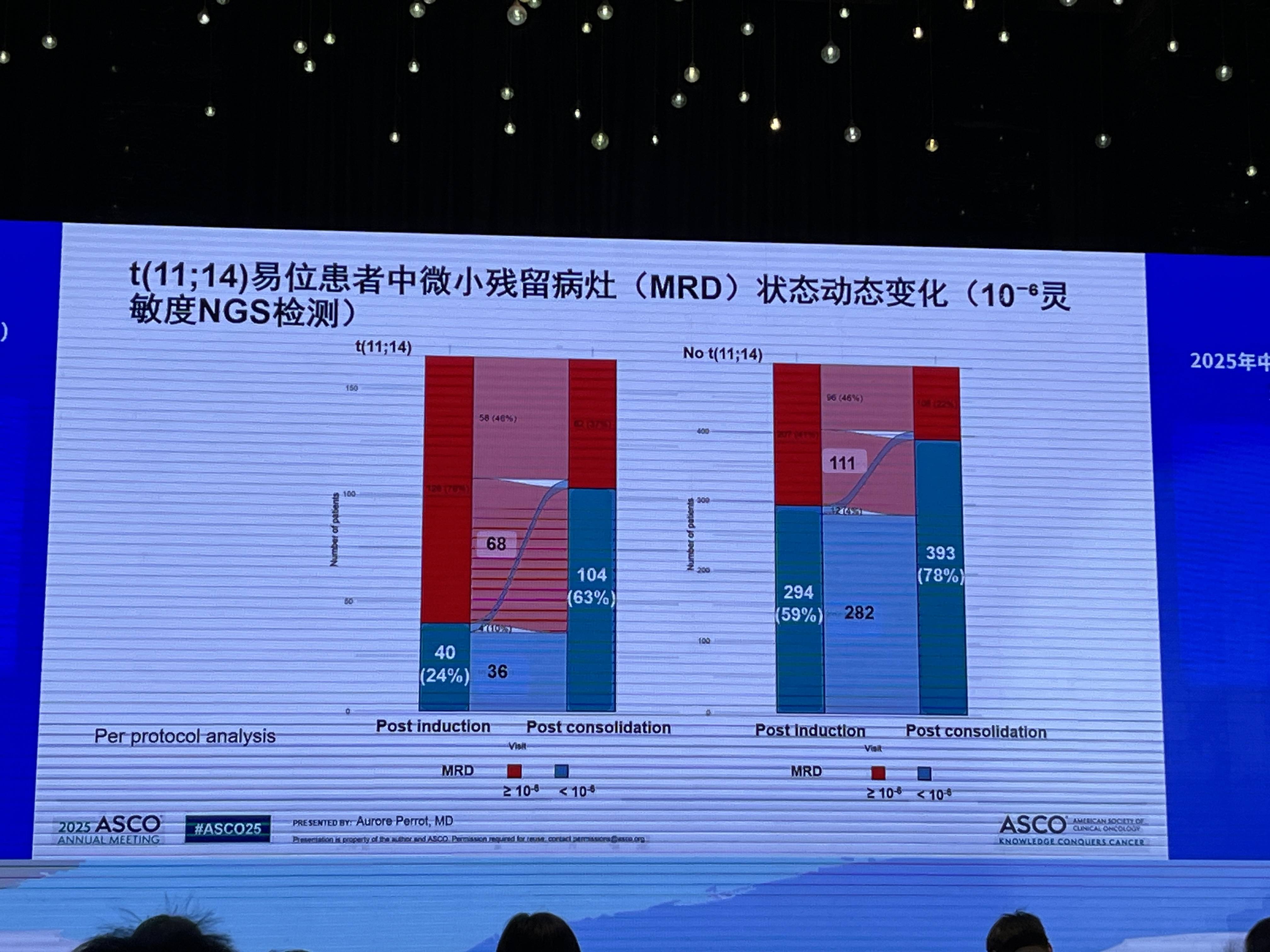
值得关注的是,在t(11;14)易位的亚组患者中,观察到明显的MRD动态变化,其MRD阴性率从诱导后的24%显著提升至巩固后的63%。
该研究的初步结论提示,在接受了高效能四联方案诱导并取得深度缓解后,ASCT(无论是单次或双次)可能无法为MRD阴性患者带来进一步的缓解深化。
这或可归因于IsaKRd诱导方案本身已具备极高的MRD清除能力。然而,该研究亦存在局限性,包括IsaKRd方案的临床应用广泛性与可及性尚有限,且目前随访时间尚短,仍需更长期的观察来评估各策略对PFS及OS等生存终点指标的最终影响。
未来的治疗策略,或需更加精细地整合患者的基因组学特征与动态MRD监测结果,以实现更为精准的风险分层与个体化治疗。
总结
本届ASCO年会公布的以IRAKLIA和MIDAS研究为代表的多项成果,共同揭示了MM治疗未来发展的两大核心趋势:“精益求精的优化”与“精准智慧的简化”。
一方面,IRAKLIA研究的成功,标志着在确保疗效与安全性的前提下,通过创新给药方式(如皮下注射)来极大提升患者便利性与治疗体验,已成为优化标准治疗方案的必然方向。这预示着未来将有更多高效药物转向更为人本化的给药模式。
另一方面,MIDAS研究则对“人人皆需移植”的传统观念发起了深刻挑战,预示着在高効能新药时代,以MRD为核心的精准风险分层,将引领我们进入“治疗降阶梯”的智慧新纪元。未来,我们将有望为部分患者“做减法”,在不牺牲疗效的同时,避免过度治疗带来的毒性与负担。
总体而言,MM的未来治疗蓝图,正朝着一个将“最大化疗效”与“最优化生存质量”并重的方向演进,通过技术创新与策略思辨,为每一位患者量身定制更高效、更便捷、更具个体化的全程管理方案。
排版编辑:Cherry











 苏公网安备32059002004080号
苏公网安备32059002004080号


