目前以第一/共一作者发表SCI论文13篇,中文核心期刊论文4篇,单篇最高影响因子11.5分,个人累计影响因子>60分,参与专著编写3部
参与主持多个项目
ASCO 解读文献
LBA8004:
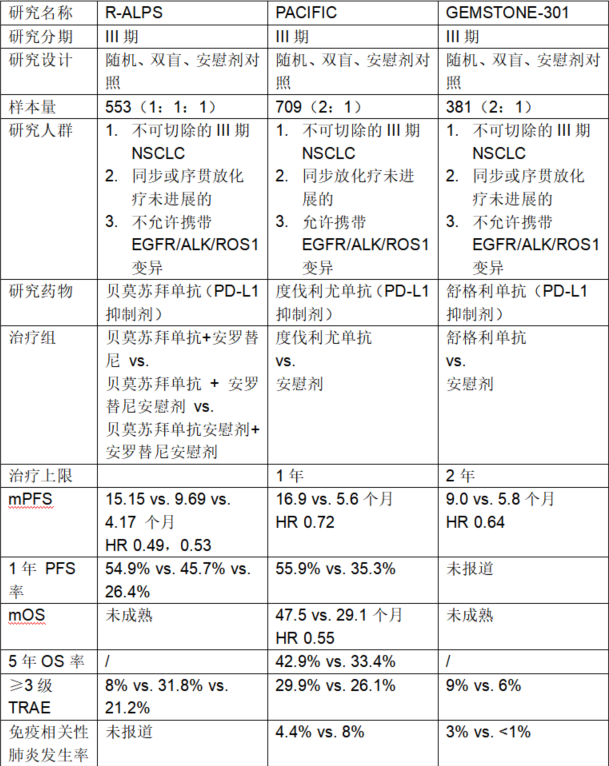
R-ALPS研究:贝莫苏拜联合或不联合安罗替尼巩固治疗经放化疗后的不可切除III期非小细胞肺癌的随机、双盲、多中心III期临床试验
研究背景
1. 贝莫苏拜联合安罗替尼在IV期NSCLC和SCLC中均取得良好疗效
2. PACIFIC研究和GEMSTONE-301研究开创了不可切除III期NSCLC放化疗后免疫检查点抑制剂巩固治疗的新模式。
研究目的
评价贝莫苏拜单药或联合安罗替尼作为不可切除III期NSCLC放化疗后免疫检查点抑制剂巩固治疗的有效性和安全性。
研究设计
该研究是一项随机、双盲、安慰剂对照、全国多中心的III期临床研究,计划纳入553例无EGFR、ALK、ROS1基因改变的经过同步或者序贯放化疗的不可切除III期NSCLC患者,以吸烟有无和同步/序贯放化疗作为分层因素,按1:1:1的比例随机分到贝莫苏拜+安罗替尼组、贝莫苏拜+安慰剂组、双安慰剂组。主要研究终点为独立评审委员会评估的PFS。
研究结果
1. 与安慰剂组相比,贝莫苏拜联合安罗替尼延长患者PFS近11个月(15.15个月 vs 4.17个月,P<0.0001),降低进展风险51%(HR=0.49)。
2. 与安慰剂组相比,贝莫苏拜单药组延长患者PFS 5.5个月(9.69个月 vs 4.17个月,P<0.0001),降低进展风险47%(HR=0.53)。
3. 联合组、单药组及安慰剂组的12个月PFS率分别为54.9% vs. 45.7% vs. 26.4%。
4. 联合组、单药组及安慰剂组的3级及以上治疗相关不良事件(TRAE)发生率分别为8% vs. 31.8% vs. 21.2%。
5. 联合组、单药组及安慰剂组的因TRAE的治疗中断率分别为5% vs. 14.2% vs. 9.1%。
6. 联合组、单药组及安慰剂组的治疗相关致死事件发生率分别为2% vs. 1% vs. 0.8%。
研究结论
贝莫苏拜单抗单药或联合安罗替尼作为同步或者序贯放化疗后的巩固治疗方案均能显著改善EGFR/ALK/ROS1基因阴性的不可切除III期NSCLC患者的PFS,且安全性良好可控。
研究亮点
开创了免疫+抗血管生成治疗用于不可切除III期NSCLC患者放化疗后的巩固治疗的先例。
研究解读
1.通过R-ALPS[1],PACIFIC[2-3],GEMSTONE-301[4]研究对比,从中位PFS的角度可以看到,贝莫苏拜单抗联合安罗替尼的疗效与阿替利珠单抗单药相近,而贝莫苏拜单抗单药与舒格利单抗单药相近。尽管此类横向比较非常粗糙,但也可以从中窥见一二。之前有分析表示阿替利珠单抗和舒格利单抗疗效数据的差异可能与GEMSTONE-301研究纳入了序贯放化疗的患者且入组的IIIB和IIIC期患者比例较高等因素相关,虽然R-ALPS尚未公布入组人群特征,考虑到R-ALPS与GEMSTONE-301研究人群均为中国患者,入组标准也较为相似,可以合理推测二者人群特征接近。因此基于以上三项研究的疗效数据对比,笔者认为贝莫苏拜单抗单药与其他PD-L1抑制剂相比并不具有独特优势,R-ALPS研究验证了PD-L1抑制剂与安罗替尼的协同抗肿瘤效应,但也尚未看到较大的生存获益突破。
2.COMPASS[5]研究同样验证了贝莫苏拜单抗与安罗替尼的协同效应:与帕博利珠单抗单药相比,一线莫苏拜单抗联合安罗替尼可显著延长PD-L1阳性晚期NSCLC患者的中位PFS( 11.0 个月vs. 7.1 个月,P = 0.0057,HR = 0.70)。但是IMpower150[6]和APPLE[7]研究却均未观察到阿替利珠单抗联合贝伐珠单抗相比阿替利珠单抗单药的疗效优势,卡瑞利珠单抗联合阿帕替尼的相关研究[8-9]也未展现出超越PD-(L)1抑制剂单药的疗效。那么同为抗血管生成药物,为什么仅安罗替尼可以有效增强PD-(L)1抑制剂的疗效?安罗替尼具有何特殊性?
3. 与贝伐珠单抗和阿帕替尼特异性抑制VEGFR或VEGFR2不同,安罗替尼作为小分子多靶点血管生成抑制剂,可强效抑制VEGFR1/2/3、c-Kit、PDGFR-α、FGFR1、FGFR2和FGFR3等多靶点,不仅可抑制肿瘤血管生成,促进肿瘤血管正常化,还可直接抑制肿瘤细胞增殖及转移。而且2025 ELCC上一项回顾性研究[10]显示非鳞NSCLC中既往贝伐珠单抗治疗对安罗替尼的疗效影响有限,更加说明安罗替尼具有抗血管生成以外的抗肿瘤机制。有趣的是,2025 ASCO另一项III期临床研究[11]显示:在联合化疗治疗晚期结直肠癌时,安罗替尼的疗效与贝伐珠单抗相当,说明安罗替尼特异性增强PD-(L)1抑制剂抗肿瘤疗效,但其协同机制仍有待深入的探索,至少不能完全由“抑制VEGFR从而抑制肿瘤血管生成,诱导肿瘤血管正常化[12]”来解释。
4. 以上分析提示:(1)安罗替尼与PD-(L)1抑制剂的协同抗肿瘤作用可能并不依赖于VEGFR介导的血管生成通路,未来需要更深入的机制探索,从而开发更针对性的精准治疗药物。(2)其他小分子泛靶点血管生成抑制剂如舒尼替尼与PD-(L)1抑制剂联合在NSCLC中的疗效值得探索。
苏春霞教授点评:
免疫联合抗血管生成治疗一直是近些年肺癌领域研究的热点,该方案让我们看到了chemo-free的希望,但是既往关于抗血管生成药物与免疫治疗联合的研究并没有带来亮眼的数据,R-ALPS研究让我们重新看到了希望,本文通过深入的分析指出,贝莫苏拜单抗联合安罗替尼的成功可能并非由我们通常认为的诱导肿瘤血管正常化增强免疫疗效的机制所致,为我们提供了新的思考方向。
【温馨提示】:如果您觉得周娟医生解读的好,请在下方为她点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
[1] Ming Chen, et al. R-ALPS: A randomized, double-blind, placebo-controlled, multicenter phase III clinical trial of TQB2450 with or without anlotinib as maintenance treatment in patients with locally advanced and unresectable (stage III) NSCLC without progression following concurrent or sequential chemoradiotherapy. 2025 ASCO. Abstract LBA8004.
[2] Antonia SJ, et al. PACIFIC Investigators. Durvalumab after Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer. N Engl J Med. 2017 Nov 16;377(20):1919-1929.
[3] Spigel DR, et al. Five-Year Survival Outcomes From the PACIFIC Trial: Durvalumab After Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer. J Clin Oncol. 2022 Apr 20;40(12):1301-1311.
[4] Zhou Q, et al. Sugemalimab versus placebo after concurrent or sequential chemoradiotherapy in patients with locally advanced, unresectable, stage III non-small-cell lung cancer in China (GEMSTONE-301): interim results of a randomised, double-blind, multicentre, phase 3 trial. Lancet Oncol. 2022 Feb;23(2):209-219.
[5] Baohui Han, et al. CAMPASS: Benmelstobart in combination with anlotinib vs pembrolizumab in the first-line treatment of advanced non-small cell lung cancer (aNSCLC)—A randomized, single-blind, multicenter phase 3 study. 2025 ASCO. Abstract LBA8502.
[6] Socinski MA, et al. IMpower150 Final Overall Survival Analyses for Atezolizumab Plus Bevacizumab and Chemotherapy in First-Line Metastatic Nonsquamous NSCLC. J Thorac Oncol. 2021 Nov;16(11):1909-1924.
[7] Shiraishi Y, et al. Atezolizumab and Platinum Plus Pemetrexed With or Without Bevacizumab for Metastatic Nonsquamous Non-Small Cell Lung Cancer: A Phase 3 Randomized Clinical Trial. JAMA Oncol. 2024 Mar 1;10(3):315-324.
[8] Zhou C, et al. Efficacy and Biomarker Analysis of Camrelizumab in Combination with Apatinib in Patients with Advanced Nonsquamous NSCLC Previously Treated with Chemotherapy. Clin Cancer Res. 2021 Mar 1;27(5):1296-1304.
[9] Xia H, et al. Neoadjuvant camrelizumab (an anti-PD-1 antibody) plus chemotherapy or apatinib (a VEGFR-2 inhibitor) for initially unresectable stage II-III non-small-cell lung cancer: a multicentre, two-arm, phase 2 exploratory study. Signal Transduct Target Ther. 2024 Jun 14;9(1):145.
[10] Dong YC, et al. The impact of prior bevacizumab on the efficacy of anlotinib in advanced non-squamous non-small cell lung cancer.2025 ELCC Abstract 39P.
[11] Ding KF, et al. Updated results of ALTER-C002: Anlotinib combined with CAPEOX as first-line treatment in RAS/BRAF wild-type unresectable metastatic colorectal cancer. J Clin Oncol 41, 2023 (suppl 4; abstr 138). 2023 ASCO GI Abs 138.
[12] Luo J, et al. Anlotinib enhanced CD8+ T cell infiltration via induction of CCL5 improves the efficacy of PD-1/PD-L1 blockade therapy in lung cancer. Cancer Lett. 2024 Jun 1;591:216892.











 苏公网安备32059002004080号
苏公网安备32059002004080号


