北京大学 医学博士
“人民好医生·金山茶花计划”胃癌领域;
以第一作者身份在Lancet oncology、Annals of oncology等期刊上发表SCI 9篇,累计影响因子约180分
主持国自然、省部级以上课题共4项
入选国家博士后创新人才计划、上海市启明星扬帆计划
5次获得ASCO、ESMO MERIT AWARD
Cancer immunology,immunotherapy副主编;BMC Medical genomics 编
ASCO解读文献
LBA4002——Trastuzumab deruxtecan (T-DXd) vs ramucirumab (RAM) + paclitaxel (PTX) in second-line treatment of patients (pts) with human epidermal growth factor receptor 2-positive (HER2+) unresectable/metastatic gastric cancer (GC) or gastroesophageal junction adenocarcinoma (GEJA): Primary analysis of the randomized, phase 3 DESTINY-Gastric04 study.
摘要
研究背景
基于既往Ⅱ期研究,T-DXd 6.4mg/kg已获批用于接受过曲妥珠单抗为基础方案治疗的转移性HER2阳性胃癌/胃食管交界腺癌(GC/GEJA)患者。DESTINY-Gastric04(NCT04704934)是一项全球性、随机、多中心、开放标签的Ⅲ期临床试验,旨在评估T-DXd对比雷莫西尤单抗(RAM)联合紫杉醇(PTX)在HER2阳性不可切除/转移性GC/GEJA患者中的二线治疗中的疗效与安全性。本次分析是该项研究计划中期分析的主要疗效分析结果。
研究方法
经活检确认HER2阳性(IHC3+或IHC2+/ISH+)后,患者按1:1随机分配至T-DXd 6.4mg/kg组或RAM+PTX组。主要终点为总生存期(OS)。采用随机分层因素的对数秩检验对两组OS进行比较。次要终点包括研究者评估的无进展生存期(PFS)、确认的客观缓解率(cORR)、疾病控制率(DCR)及安全性。
研究结果
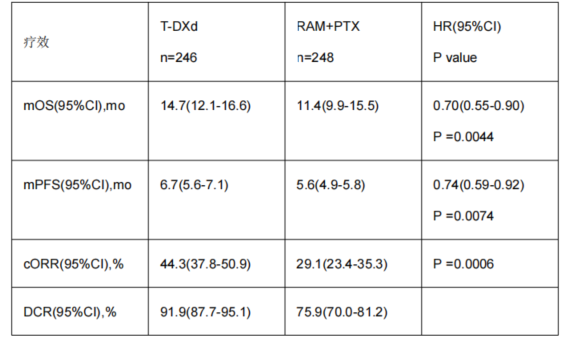
截至数据截止日期(2024年10月24日),共入组494例患者(T-DXd组246例,RAM+PTX组248例)。基于观察到的266例OS事件(信息比例=78.5%),T-DXd组达到了疗效优越性(双侧P<0.0228)。T-DXd组和RAM+PTX组的中位(m)OS随访时间分别为16.8个月(95%CI 14.0~20.0个月)和14.4个月(13.1~19.7个月)。T-DXd组的mOS(95%CI)为14.7个月(12.1~16.6个月),对比RAM+PTX组为11.4个月(9.9~15.5个月)[HR=0.70;P=0.0044]。其他疗效数据见下表。T-DXd组和RAM+PTX组的中位治疗持续时间(范围)分别为5.4个月(0.7~30.3个月)和4.6个月(0.9~34.9个月)。治疗中出现的不良事件(TEAEs)报告率在T-DXd组和RAM+PTX组分别为244/244(100%)和228/233例(97.9%);≥3级TEAEs发生率分别为68.0%和73.8%。严重TEAEs发生率在T-DXd组和RAM+PTX组中分别为41.0%和43.3%;与停药相关的TEAEs发生率分别为14.3%和17.2%。独立判定的药物相关间质性肺病/肺炎在T-DXd组发生34例(13.9%)(1例3级,0例4/5级),RAM+PTX组发生3例(1.3%)(2例3级,1例5级)。
研究结论
在HER2阳性不可切除/转移性GC/GEJA患者中,相较于RAM+PTX组,T-DXd组实现了具有统计学意义和临床意义的双重OS改善,进一步巩固了其作为二线标准治疗的地位。T-DXd 6.4mg/kg的安全性特征与其既往在GC/GEJA中已知的安全性一致,未发现新的安全性信号。
临床试验信息:NCT04704934。
解读
HER2阳性晚期胃癌二线治疗现状
HER2作为胃癌首个治疗靶点,开启了胃癌精准治疗大门。5%~17%的胃癌患者存在HER2过表达或扩增。ToGA研究[1]及KEYNOTE-811[2]研究已确立曲妥珠单抗联合方案在HER2阳性晚期胃癌中的一线标准治疗地位,但仍有60%~70%的HER2阳性胃癌患者在一线治疗后12个月内出现耐药。二线抗HER2治疗的探索披荆斩棘,面临严峻挑战:Ⅲ期T-ACT研究[3]显示,曲妥珠单抗跨线治疗未能延长患者的OS(6.7个月 vs 5.8个月,HR=0.92);TyTAN研究[4]中,拉帕替尼联合紫杉醇ORR仅14.3%,3级以上腹泻发生率达28%,治疗相关停药率为12%;II/III期GATSBY[5]研究显示,T-DM1对比紫杉醇二线治疗未改善OS(6.9个月 vs 6.0个月,HR=0.88);这些研究结果提示传统抗HER2策略在二线治疗中的局限性。基于RAINBOW[6]研究,目前临床上仍以化疗和抗血管生成药物为主二线治疗晚期胃癌,但总体生存期仍不足10个月。以T-DXd(II期研究DG01:ORR 51%,PFS 5.6个月)和OS 12.5个月)[7]、RC48(三线:HER2阳性患者,ORR 26.4%)[8]为代表的抗HER2抗体药物偶联物在HER2阳性胃癌三线治疗的显著疗效,正逐步向二线及更前线推进。
新型HER2靶向ADC药物
T-DXd是由曲妥珠单抗和拓扑异构酶I抑制剂(DXd)共价连接组成。与TDM-1不同,T-Dxd连接子具有可切割性,可以通过旁观者效应杀伤包括HER2低表达肿瘤细胞在内的邻近肿瘤细胞;其药物-抗体比(DAR)也有显著提高(8 vs 3.5倍)。因此,即使在低HER2表达的肿瘤细胞中,T-DXd也保留着较强的抗肿瘤作用(9)。
DS8201-A-J101是一项探索T-DXd治疗晚期实体肿瘤患者的I期研究。该项研究纳入了44例晚期HER2阳性胃癌患者,ORR为43.2%[10]。由此开展了DESTINY系列研究。II期研究DG01及中国人群桥接研究DG06打破了HER2阳性晚期胃癌既往后线治疗OS获益不足1年的临床困境,也推动T-DXd在HER2阳性晚期胃癌中二线治疗的布局[11]。II期DG02研究,倾向性评分匹配比较研究发现,相对于RAM+PTX方案,T-DXd治疗组OS显著延长5.4个月(11.6个月 vs 6.2个月,P<0.0001)[12]。
基于此,本摘要III期研究DG04进一步头对头比较T-DXd单药与目前标准二线治疗方案(RAM+PTX)在HER2阳性晚期胃癌患者的疗效与安全性[13]。考虑到HER2表达丢失可能是抗HER2治疗失败的关键原因之一,与GATSBY(T-DM1)研究不同,本项研究要求患者入组时重新活检确认HER2阳性状态。研究结果提示:相较于RAM+PTX组,T-DXd组实现了具有统计学意义和临床意义的双重OS改善(14.7个月 vs 11.4个月)。
本试验未计划在治疗组之间进行研究交叉。但对照组约25.8%的患者接受后续抗HER2抗体药物偶联物(包括T-DXd、RC48)。竞争风险校正后的安全性分析,调整可能的后续抗HER2 ADC治疗带来生存分析的影响,T-DXd组和对照组的中位OS分别为14.7和11个月(HR=0.67,95%CI 0.52~0.87)与主要分析一致,进一步证实了T-DXd的生存获益。OS和PFS获益在大多数亚组中均得以维持。值得注意的是,在IHC2+/ISH+对比3+亚组风险组更低,提示HER2信号通路的激活在此类患者肿瘤细胞恶性增殖的重要作用。
靶向HER2-ADC药物治疗的安全性管理
本研究的安全性分析显示,T-DXd组的主要不良反应包括乏力、胃肠道反应以及血液学毒性。间质性肺病(ILD)/肺炎是T-DXd治疗中重点关注的警示性不良事件,在本研究中其发生率为13.9%,但绝大多数为1-2级轻度事件。目前关于T-DXd所致ILD/肺炎的发病机制尚未完全阐明,可能涉及肺部巨噬细胞对药物的非靶向摄取、“旁观者”效应、药物直接细胞毒性以及T-DXd在循环中解离所释放的有效载荷(DXd)等因素[14]。一项纳入9项早期临床试验(n=1150例)的回顾性分析显示,ILD/肺炎发生的潜在风险因素包括:年龄<65岁、T-DXd剂量>6.4 mg/kg、基线氧饱和度<95%、中重度肾功能损害以及既往存在肺部疾病(15)。有效管理ILD对于充分发挥T-DXd的治疗获益至关重要。应对T-DXd引发间质性肺炎的5S法则,即“筛查(Screen)”、“扫描(Scan)”、“协作(Synergy)”、“暂停治疗(Suspend treatment)”和“激素治疗(Steroids)”[16],有助于有效减少T-DXd相关ILD的发生与进展,进一步改善患者预后。该策略强调在治疗前筛选高风险人群,治疗中通过影像学监测和多学科协作尽量降低ILD风险,并根据患者症状的严重程度及时调整T-DXd剂量及启用糖皮质激素治疗方案。
“胃”来可期,HER2-ADC治疗HER2阳性胃癌优化方向
① 联合化疗
T-DXd偶联药物为拓扑异构酶I抑制剂,主要作用于S期并产生G2/M期阻滞,可与微管抑制剂协同增强抗肿瘤能力。部分化疗药物可对肿瘤细胞表面抗原进行调节,如吉西他滨可以上调胰腺癌细胞HER2表达[17],这对靶向HER2-ADC药物联合提供可能。在胃癌中,T-DXd联合化疗(FP)在一线中的疗效探索正在开展(DG-03),关于二线及以上联合化疗药物的疗效尚未有报道。此外,ADC类药物本质上是化疗药,因此,联合化疗药物的同时需考虑药物毒性的管理。
② 联合免疫治疗
T-DXd能够促进DC和CD8+T细胞浸润至肿瘤组织内,上调肿瘤细胞PD-L1和MHCI类表达及树突状细胞表达CD86[18]。体内外研究也发现T-DM1和RC48也均能够促进T细胞增殖与浸润、Th1细胞极化、免疫抑制性分子(如PD-L1、TIM-3)表达等[19-21]。这为靶向HER2-ADC类药物联合抗PD-1/PD-L1治疗提供了理论基础。DG03研究同期评估单药或联合方案(化靶、化靶免、以及靶免去化疗模式)一线治疗HER2阳性晚期胃癌患者的疗效与安全性[22],在F组T-DXd 5.4mg/kg联合帕博利珠单抗与减量化疗一线治疗HER2阳性GC患者ORR 75%,mPFS 9.8个月,耐受性较好且暂无ILD发生。III期研究DG05(T-DXd 5.4mg/kg+PD-1+减量化疗)和ARTEMIDE-Gastric01(T-DXd 5.4mg/kg+PD-1/TIGIT双抗+减量化疗)一线治疗HER2阳性晚期胃癌的研究正在进行。此外,我国自主研发的抗 HER2 ADC 类药物RC48联合PD-1单抗的II期临床研究数据显示,该联合治疗方案在二线治疗晚期胃癌患者中展现出显著疗效,中位缓解持续时间(DOR)长达 15.6 个月[23]。
③ 多靶点排兵布阵
ADC和靶向药物的协同使用可导致多个致癌途径同时停滞,或对一个特定途径的双重阻断,从而更有效地抑制下游信号传导。III期HER2CLIMB-02研究显示[24],对于既往抗HER2靶向治疗进展后的HER2阳性转移性乳腺癌患者,T-DM1+图卡替尼较T-DM1单药显著改善mPFS,为9.5个月 vs 7.4个月。在胃癌中,RC48联合曲妥珠单抗和PD-1单抗去化疗模式在小样本队列中(n=17例)ORR高达82.4%[25]。更多证据仍需在大样本人群中探索。新型抗HER2双特异性抗体偶联药物TQB2102[26],可同时结合HER2细胞外结构域II(帕妥珠单抗结合位点)和结构域IV(曲妥珠单抗结合位点),增强对肿瘤组织的亲和力并促进内吞作用,其在末线治疗晚期HER2阳性胃癌患者中单药ORR达到40%。此外,HER2与Claudin18.2共表达率约6.8%,针对这部分人群是选用单靶点治疗还是多靶点联合用药仍需进一步探讨。
总结
DG04研究的成功弥补了HER2阳性晚期胃癌二线抗HER2治疗的空白。T-DXd不断在HER2阳性胃癌中治疗线数前移,期待有更多高价值循证证据改善此类患者的预后。
余一祎副主任医师指导老师点评:
王静远医生对DG04研究的背景、意义及未来方向进行了全面梳理,逻辑清晰地从HER2阳性胃癌治疗现状切入,剖析传统方案局限,再通过T-DXd的机制优势自然过渡到DG04研究设计,最后展望联合治疗策略,层层递进。
对比T-ACT、TyTAN等关键抗HER2二线研究的阴性结果,DG04研究凸显T-DXd的突破性(OS延长3.3个月,HR=0.67),该研究也强调HER2复检对疗效的影响,体现科学严谨性。王静远医生对于该研究深入解读后有引申提出ADC联合化疗/免疫等优化路径,引用DG03、RC48等研究数据,为临床实践提供新思路。
【温馨提示】:如果您觉得王静远医生解读得好,请在下方为她点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
1.Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet (London, England). 2010;376(9742):687-97.
2. Janjigian YY, Kawazoe A, Bai Y, Xu J, Lonardi S, Metges JP, et al. Pembrolizumab plus trastuzumab and chemotherapy for HER2-positive gastric or gastro-oesophageal junction adenocarcinoma: interim analyses from the phase 3 KEYNOTE-811 randomised placebo-controlled trial. Lancet (London, England). 2023;402(10418):2197-208.
3. Makiyama A, Sukawa Y, Kashiwada T, Kawada J, Hosokawa A, Horie Y, et al. Randomized, Phase II Study of Trastuzumab Beyond Progression in Patients With HER2-Positive Advanced Gastric or Gastroesophageal Junction Cancer: WJOG7112G (T-ACT Study). J Clin Oncol. 2020;38(17):1919-27.
4. Satoh T, Xu RH, Chung HC, Sun GP, Doi T, Xu JM, et al. Lapatinib plus paclitaxel versus paclitaxel alone in the second-line treatment of HER2-amplified advanced gastric cancer in Asian populations: TyTAN--a randomized, phase III study. J Clin Oncol. 2014;32(19):2039-49.
5. Thuss-Patience PC, Shah MA, Ohtsu A, Van Cutsem E, Ajani JA, Castro H, et al. Trastuzumab emtansine versus taxane use for previously treated HER2-positive locally advanced or metastatic gastric or gastro-oesophageal junction adenocarcinoma (GATSBY): an international randomised, open-label, adaptive, phase 2/3 study. Lancet Oncol. 2017;18(5):640-53.
6. Wilke H, Muro K, Van Cutsem E, Oh SC, Bodoky G, Shimada Y, et al. Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomised phase 3 trial. Lancet Oncol. 2014;15(11):1224-35.
7. Van Cutsem E, di Bartolomeo M, Smyth E, Chau I, Park H, Siena S, et al. Trastuzumab deruxtecan in patients in the USA and Europe with HER2-positive advanced gastric or gastroesophageal junction cancer with disease progression on or after a trastuzumab-containing regimen (DESTINY-Gastric02): primary and updated analyses from a single-arm, phase 2 study. Lancet Oncol. 2023;24(7):744-56.
8. Peng Z, Liu T, Wei J, Wang A, He Y, Yang L, et al. Efficacy and safety of a novel anti-HER2 therapeutic antibody RC48 in patients with HER2-overexpressing, locally advanced or metastatic gastric or gastroesophageal junction cancer: a single-arm phase II study. Cancer communications (London, England). 2021;41(11):1173-82.
9. Edoardo C, Giuseppe C. Trastuzumab-deruxtecan in solid tumors with HER2 alterations: from early phase development to the first agnostic approval of an antibody-drug conjugate. Expert opinion on investigational drugs. 2024;33(8):851-65.
10. Shitara K, Iwata H, Takahashi S, Tamura K, Park H, Modi S, et al. Trastuzumab deruxtecan (DS-8201a) in patients with advanced HER2-positive gastric cancer: a dose-expansion, phase 1 study. Lancet Oncol. 2019;20(6):827-36.
11. Shitara K, Bang YJ, Iwasa S, Sugimoto N, Ryu MH, Sakai D, et al. Trastuzumab Deruxtecan in Previously Treated HER2-Positive Gastric Cancer. The New England journal of medicine. 2020;382(25):2419-30.
12. Verhoeven RHA, Kuijper S, Lordick F, Slingerland M, Qin A, van Laarhoven HWM. 1574P Trastuzumab deruxtecan versus ramucirumab and paclitaxel as second-line therapy for patients with her2-positive gastric or gastro-esophageal junction adenocarcinoma: A propensity score matched comparison. Annals of Oncology. 2023;34:S878.
13. Shitara K, Van Cutsem E, Gümüş M, Lonardi S, de la Fouchardière C, Coutzac C, et al. Trastuzumab Deruxtecan or Ramucirumab plus Paclitaxel in Gastric Cancer. The New England journal of medicine. 2025.
14. Liao D, Zhang J, Yan T, Chen Y, Fu Y, Xie N, et al. A Systematic Review of Mechanisms, Incidence, and Management of Trastuzumab Deruxtecan Induced ILD/Pneumonitis in Solid Tumors. Drug design, development and therapy. 2025;19:1655-68.
15. Powell CA, Modi S, Iwata H, Takahashi S, Smit EF, Siena S, et al. Pooled analysis of drug-related interstitial lung disease and/or pneumonitis in nine trastuzumab deruxtecan monotherapy studies. ESMO Open. 2022;7(4):100554.
16. Tarantino P, Tolaney SM. Detecting and Managing T-DXd-Related Interstitial Lung Disease: The Five "S" Rules. JCO oncology practice. 2023;19(8):526-7.
17. Kan S, Koido S, Okamoto M, Hayashi K, Ito M, Kamata Y, et al. Up-regulation of HER2 by gemcitabine enhances the antitumor effect of combined gemcitabine and trastuzumab emtansine treatment on pancreatic ductal adenocarcinoma cells. BMC Cancer. 2015;15:726.
18. Iwata TN, Ishii C, Ishida S, Ogitani Y, Wada T, Agatsuma T. A HER2-Targeting Antibody-Drug Conjugate, Trastuzumab Deruxtecan (DS-8201a), Enhances Antitumor Immunity in a Mouse Model. Molecular cancer therapeutics. 2018;17(7):1494-503.
19. Müller P, Kreuzaler M, Khan T, Thommen DS, Martin K, Glatz K, et al. Trastuzumab emtansine (T-DM1) renders HER2+ breast cancer highly susceptible to CTLA-4/PD-1 blockade. Science translational medicine. 2015;7(315):315ra188.
20. Wu X, Xu L, Li X, Zhou Y, Han X, Zhang W, et al. A HER2-targeting antibody-MMAE conjugate RC48 sensitizes immunotherapy in HER2-positive colon cancer by triggering the cGAS-STING pathway. Cell death & disease. 2023;14(8):550.
21. Tan X, Lam M-H, Ragunathan S, Unsal-Kacmaz K, Loganzo F. Abstract 2757: Antibody-drug conjugate payloads induce markers of immunogenic cell death in cancer cells. Cancer Research. 2018;78(13_Supplement):2757-.
22. Janjigian YY, Laarhoven HWMV, Rha SY, Kozlov V, Oh D-Y, Gravina A, et al. Updated results from the trastuzumab deruxtecan (T-DXd) 5.4 mg/kg triplet combination of DESTINY-Gastric03 (DG-03): First-line (1L) T-DXd with fluoropyrimidine (FP) and pembrolizumab in advanced/metastatic HER2-positive (HER2+) esophageal adenocarcinoma, gastric cancer (GC), or gastroesophageal junction adenocarcinoma (GEJA). Journal of Clinical Oncology. 2025;43(4_suppl):448-.
23. Wang Y, Gong J, Wang A, Wei J, Peng Z, Wang X, et al. Disitamab vedotin (RC48) plus toripalimab for HER2-expressing advanced gastric or gastroesophageal junction and other solid tumours: a multicentre, open label, dose escalation and expansion phase 1 trial. EClinicalMedicine. 2024;68:102415.
24. Hurvitz S, Loi S, O'Shaughnessy J, Okines A, Tolaney S, Sohn JH, et al. Abstract GS01-10: HER2CLIMB-02: Randomized, Double-Blind Phase 3 Trial of Tucatinib and Trastuzumab Emtansine for Previously Treated HER2-Positive Metastatic Breast Cancer. Cancer Research. 2024;84(9_Supplement):GS01-10-GS01-10.
25. Shen L, Peng Z, Li C, Lu L, Wang X, Zhang J, et al. Disitamab vedotin (DV) plus toripalimab (Tor) and chemotherapy (C)/trastuzumab (Tra) as first-line (1L) treatment of patients (pts) with HER2-expressing locally advanced or metastatic (la/m) gastric cancer. Journal of Clinical Oncology. 2025;43(17_suppl):LBA4012-LBA.
26. Xu R-H, Wang S, Ruan D-y, Lin S, Liu F-R, Wu H-X, et al. Safety and efficacy of TQB2102, a novel bispecific anti-HER2 antibody–drug conjugate, in patients with advanced solid tumors: Preliminary data from the first-in-human phase 1 trial. Journal of Clinical Oncology. 2025;43(16_suppl):3003-.











 苏公网安备32059002004080号
苏公网安备32059002004080号


