专注于肺癌、鼻咽癌的靶向治疗、免疫治疗、化疗、及抗肿瘤新药临床研究
经团队专业抗肿瘤新药临床研究培训,获TranCelerate认证全球临床试验研究者专业证书
近年来,以第一/共同第一作者在Nature Medicine、Lancet Oncology、Clinical Cancer Research、Journal for Immunotheraoy of Cancer、European Journal of Cancer等杂志发表SCI论文多篇,累积影响因子145分
作为骨干参与国自然重点专项1项,国自然面上项目1项
中国抗癌协会整合肿瘤学分会青委会委员
ASCO 解读文献
Abstract 8507
Sacituzumab tirumotecan (sac-TMT) in patients (pts) with previously treated advanced EGFR-mutated non-small cell lung cancer (NSCLC): Results from the randomized OptiTROP-Lung03 study.
芦康沙妥珠单抗(sac-TMT)用于既往接受过治疗的晚期EGFR突变非小细胞肺癌患者:来自OptiTROP-Lung03随机研究的结果
摘要
研究背景
芦康沙妥珠单抗Sac-TMT(MK-2870/SKB264)是一种新型靶向人滋养细胞表面糖蛋白抗原2(TROP2)的抗体偶联药物(ADC),通过连接belotecan衍生的拓扑异构酶I抑制剂开发而成(图1)。Ⅰ期试验(Fang等,AACR 2024)显示其在EGFR突变非小细胞肺癌(EGFRm NSCLC)患者中具有显著抗肿瘤活性。本研究报告一项多中心随机对照研究(OptiTROP-Lung03)的结果,比较Sac-TMT与多西他赛用于经治EGFRm NSCLC患者的疗效(NCT05631262)。
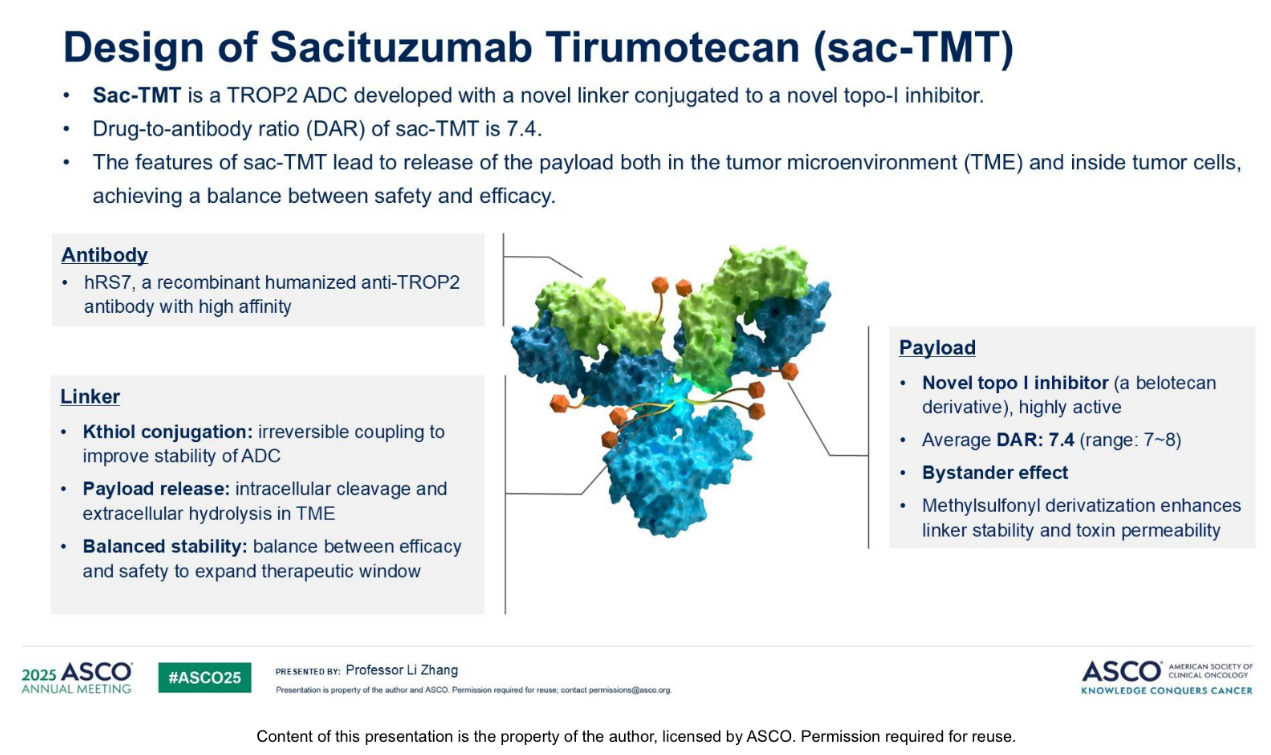
研究方法
研究纳入EGFR靶向治疗及铂类化疗后进展的晚期EGFRm NSCLC患者,按2:1随机分配接受Sac-TMT(5 mg/kg Q2W)或多西他赛(75 mg/m²)治疗。多西他赛组确认进展的患者可交叉接受Sac-TMT治疗。采用分层固定序贯检验评估疗效终点:包括盲态独立评审委员会[BIRC]评估的客观缓解率(ORR,主要终点)和无进展生存期(PFS),总生存期(OS)。预设的OS中期分析与最终PFS分析同步进行,其中单侧α水平为1.23%(按α消耗函数确定)。采用秩保持结构失效时间(RPSFT)模型计算交叉调整后的OS。
研究结果
共137例患者(中位年龄56岁,43.8%为男性,82.5%的患者ECOG PS评分 1分;93.4%患者曾接受第三代EGFR-TKI治疗)随机接受Sac-TMT(n=91)或多西他赛(n=46)治疗。截至2024年12月31日数据 cutoff 时,中位随访时间为12.2个月,Sac-TMT组25.3%患者仍在治疗(多西他赛组4.3%)。
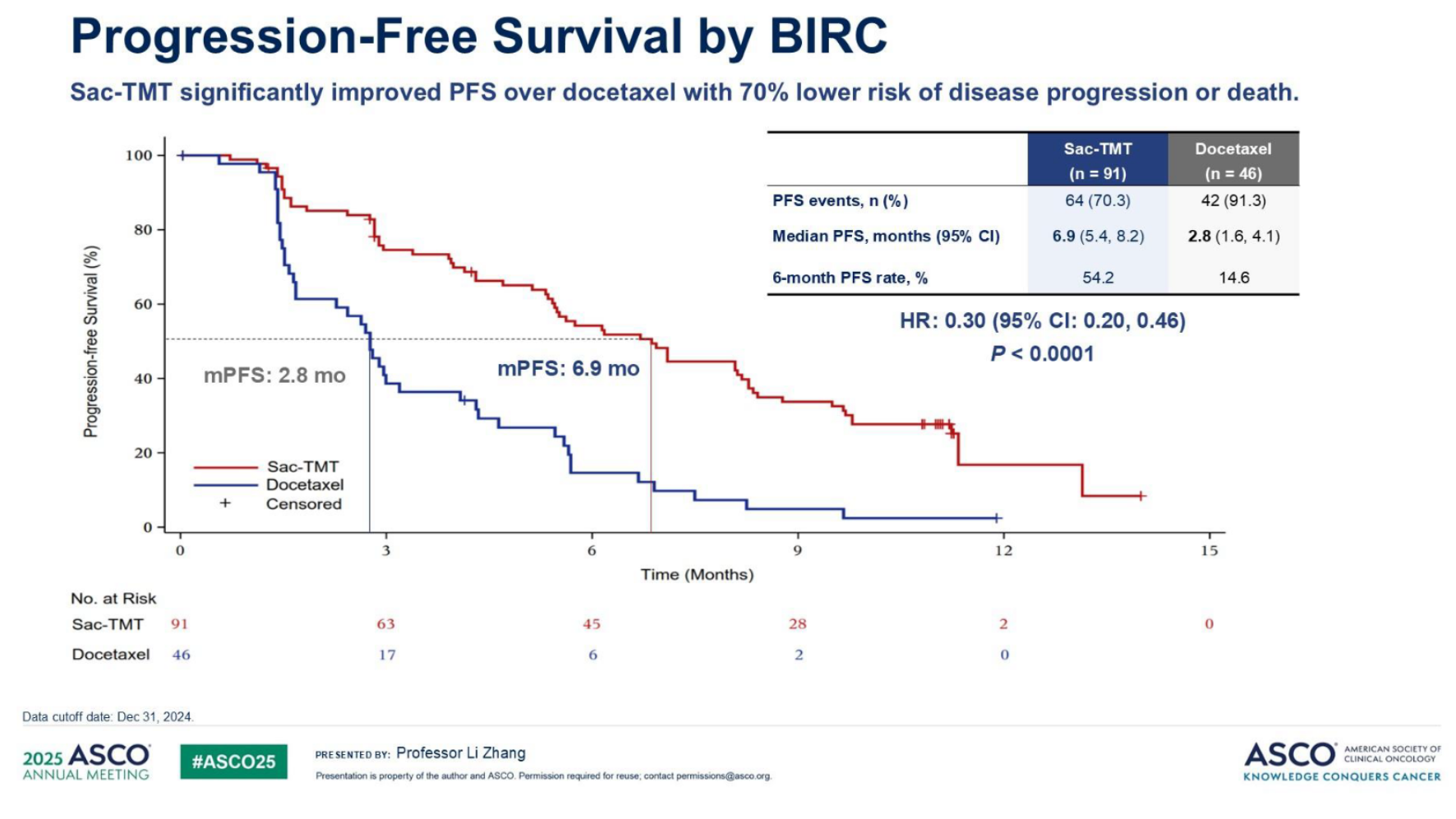
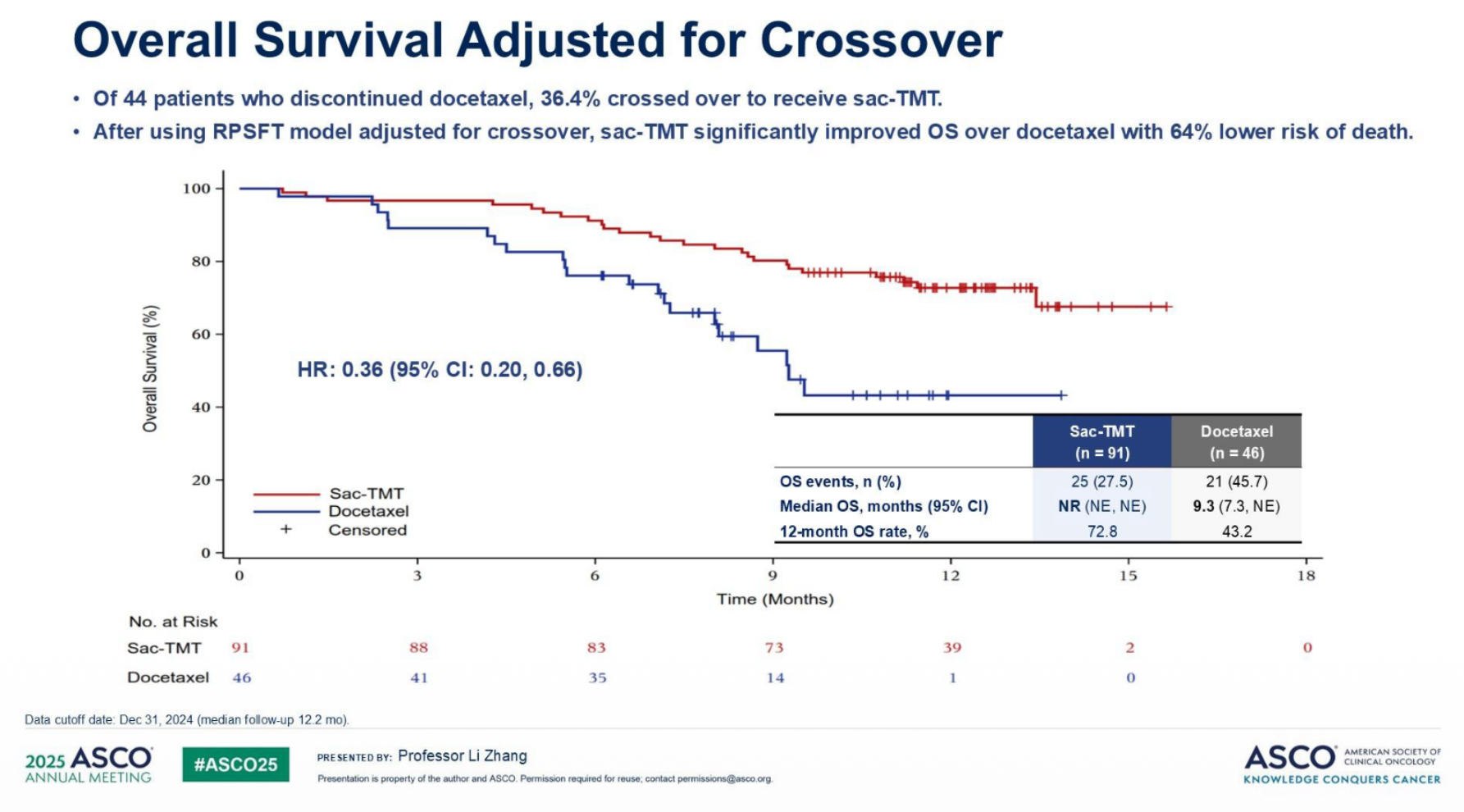
研究达到主要和关键次要终点:Sac-TMT组BIRC评估的确认ORR显著更高(45.1% vs 15.6%,单侧p=0.0004;研究者[INV]评估:34.1% vs 8.7%),中位PFS显著延长(BIRC:6.9 vs 2.8个月,HR 0.30[95% CI: 0.20-0.46],单侧p<0.0001;INV:7.9 vs 2.8个月,HR 0.23[0.15-0.36])(图2),OS显著改善,其中36.4%多西他赛组患者交叉至Sac-TMT组。RPSFT模型调整后,多西他赛组中位OS为9.3个月,Sac-TMT组未达到(OS HR 0.36[0.20-0.66])(图3)。
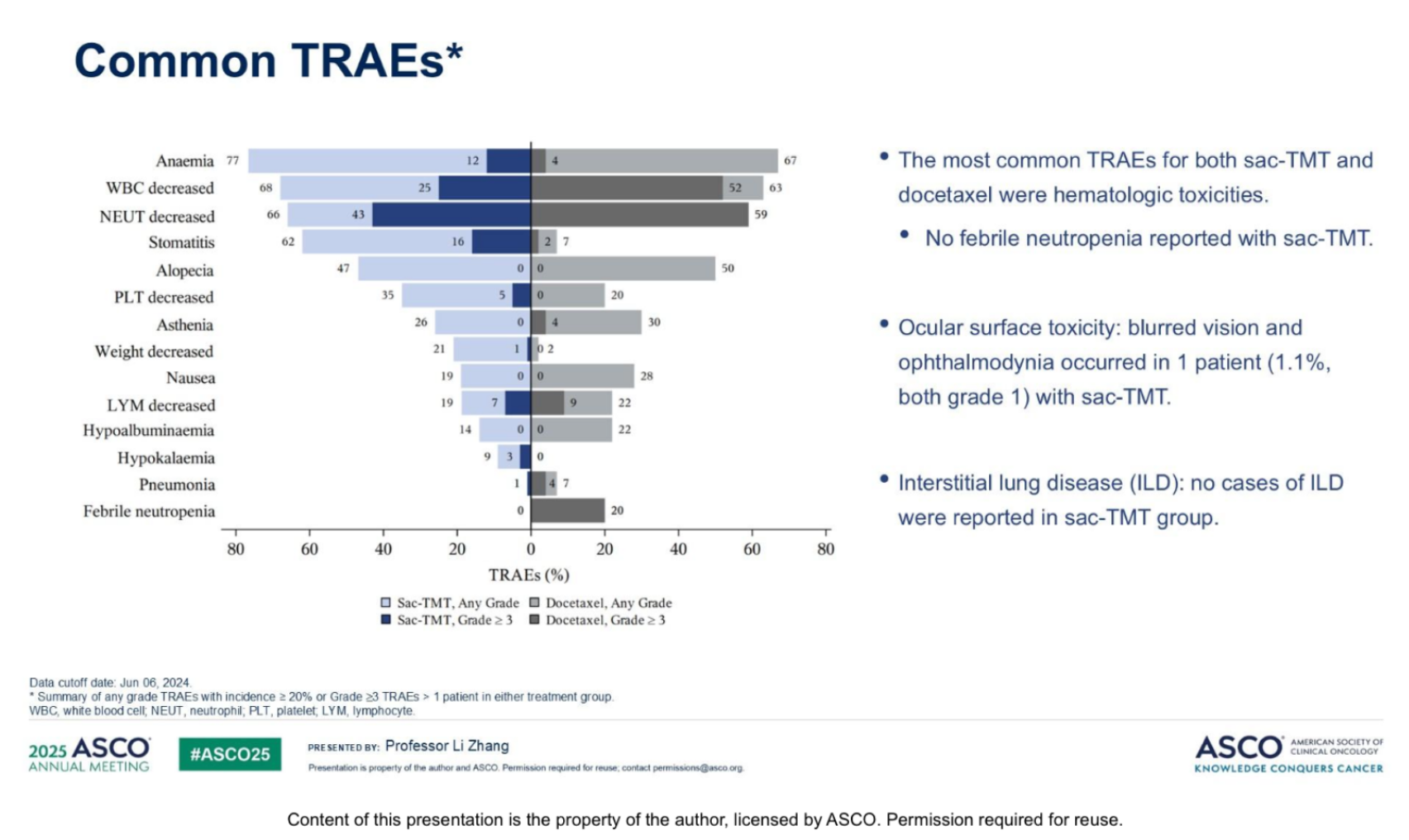
Sac-TMT组≥3级治疗相关不良事件(TRAEs)发生率(Sac-TMT vs 多西他赛)为56.0% vs 71.7%,治疗相关严重不良事件(SAEs)为16.5% vs 41.3%。常见(≥10%)≥3级TRAEs(Sac-TMT vs 多西他赛)包括中性粒细胞减少(42.9% vs 58.7%)、白细胞减少(25.3% vs 52.2%)、口腔炎(16.5% vs 2.2%)、贫血(12.1% vs 4.3%)和发热性中性粒细胞减少(0% vs 19.6%)(图4)。Sac-TMT组未报告间质性肺病(ILD)病例。
研究结论
在经治晚期EGFRm NSCLC患者中,Sac-TMT相比多西他赛显著提升ORR、PFS和OS,且安全性可控,提示Sac-TMT可能成为新的标准治疗选择,研究同步登顶于BMJ杂志[1]。(临床试验信息:NCT05631262)

解读
百花齐放——肺癌领域抗体偶联药物飞速发展
抗体偶联药物(ADC)是一类由靶向抗原的抗体、连接子和小分子细胞毒性药物组成的抗肿瘤药物,理论上利用抗体的特异性识别和结合肿瘤细胞表面的抗原,将高毒性的药物直接输送到肿瘤细胞内部,从而特异性杀死肿瘤细胞。近年来靶向HER2、Trop-2、c-MET、B7H3、EGFR/HER3等靶点的ADC在肺癌中飞速进展,有望改变肺癌患者的治疗格局[2]。
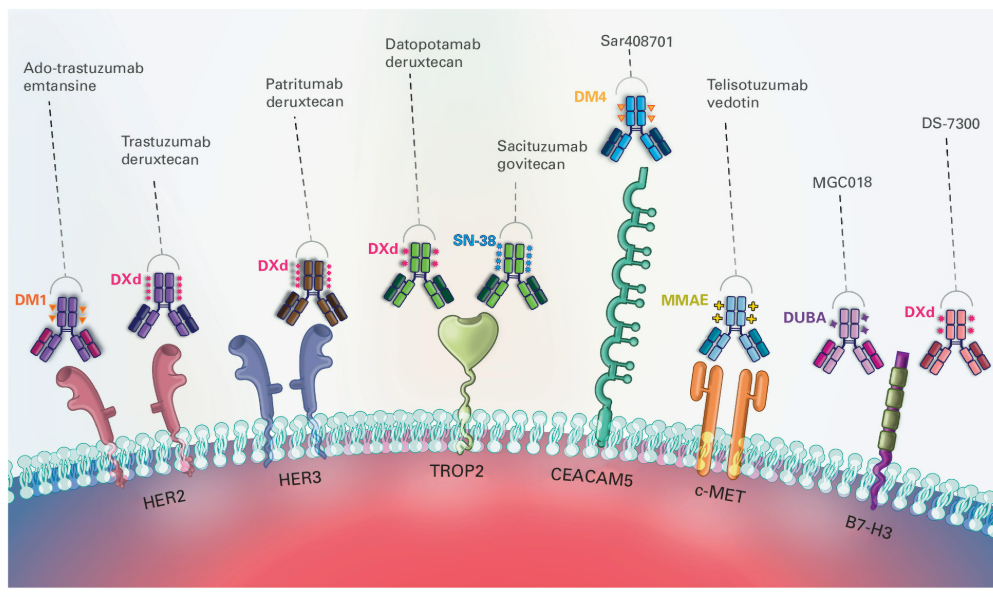
破局TROP2 ADC困境—芦康沙妥珠单抗成为首个获批EGFR突变 NSCLC的TROP2-ADC
TROP-2作为在NSCLC中高表达的潜在治疗靶点,其早期开发却遭遇挫折——戈沙妥珠单抗(SG)和德达博妥单抗(Dato-DXd)两项III期试验均未达主要终点,未对经治患者进行精准分层可能是关键因素。[3, 4]。如在TROPION-Lung01研究中,Dato-DXd仅对非鳞状NSCLC表现出益处,对于鳞状NSCLC患者的表现劣于化疗可能影响了整体研究结果的统计学意义。
在此背景下,芦康沙妥珠单抗通过创新设计实现突破:采用稳定连接子与新型拓扑异构酶Ⅰ抑制剂组合,DAR值达7.4,显著提升抗肿瘤活性。张力教授团队在临床前研究中发现,激活的EGFR突变可显著增强芦康沙妥珠单抗的内吞作用和抗肿瘤活性,由此精准锁定EGFR-TKI耐药人群;在I期临床研究也初步发现其在EGFRmNSCLC的疗效优于EGFR野生型NSCLC[5]。OptiTROP-Lung03研究证实,相较于多西他赛,该药显著改善EGFR突变患者预后且安全性良好,最终获NMPA批准并纳入2025CSCO指南,成为首个获批肺癌适应症的TROP2-ADC,为EGFR-TKI耐药患者确立新标准。
TROP2-ADC肺癌治疗全程覆盖——从后线到一线,从单药到联合
1.EGFR突变NSCLC患者全覆盖,从后线到一线
对于EGFR突变NSCLC,芦沙妥珠单药或联合用药的多项3期临床试验正在进行中。在EGFR-TKI耐药、未经化疗的EGFR突变型NSCLC患者中,已开展芦沙妥珠单抗对比培美曲塞联合化疗的SKB264-III-09临床研究(NCT05870319)。在未经治的EGFR突变NSCLC中,已开展芦沙妥珠单抗联合奥希替尼一线治疗的SKB264-III-15研究(NCT06670196)。这些临床研究全面覆盖了EGFR突变晚期NSCLC患者一线到后线治疗,其成果将为该类患者提供更多的治疗新标准。
2.填补EGFR非经典突变患者治疗空白
针对EGFR非经典突变晚期NSCLC患者面临的治疗困境,今年ASCO年会上还报道了一项评估芦康沙妥珠单抗治疗既往经过治疗的罕见EGFR突变晚期NSCLC的II期临床研究结果,涵盖了G719X/S768I/L861Q(23例)及20外显子插入突变(19例)等亚型。研究显示,芦康沙妥珠单抗该人群中展现出显著临床获益,ORR为35.7%,中位PFS为9.5个月,这一突破性成果有望成为EGFR非经典突变患者的提供新的治疗选择[6]。
3.在驱动基因阴性肺癌患者,联合用药展现潜力
在2025年ASCO年会上,OptiTROP-Lung01 II期研究数据更新披露,评估了sac-TMT联合PD-L1抑制剂塔戈利单抗用于无驱动基因突变晚期非鳞NSCLC一线治疗的疗效。研究纳入81例患者,发现ORR达59.3%,PFS为15.0个月。且这一联合方案在不同PD-L1表达水平患者中均显示出不错的抗肿瘤活性,为肺癌患者提供新的一线治疗选择[7]。
总结
OptiTROP-Lung03研究对于EGFR突变NSCLC的治疗具有里程碑式意义,芦康沙妥珠单抗以其优异的疗效和不错的安全性,为EGFR突变NSCLC带来新的标准治疗选择。当然ADC药物靶向毒性和非靶毒性也值得关注。芦沙妥珠单抗的口腔炎毒性高于多西他赛,类似于其他Trop2靶向ADC[8, 9],可能是由于皮肤和粘膜组织中Trop2高表达[10],需要注意黏膜毒性的全程管理。长期使用ADC药物时化疗相关毒性也值得关注[11]。ADC有望改变肺癌治疗格局,带来一场全新药物治疗革命。
赵洪云教授 中山大学肿瘤防治中心
薛锦慧博士解读了2025年ASCO大会上报道的一项III期随机对照研究:OptiTROP-Lung03研究,在既往接受过治疗的晚期EGFR突变NSCLC患者中对比芦康沙妥珠单抗和多西他赛的疗效和安全性,该点评从肺癌领域ADC进展、TROP2靶向ADC NSCLC的进展、ADC药物毒性等多角度多层面评价了OptiTROP-Lung03研究结果,以及该研究结果带来的启示,体现了其对本研究领域全面的见解和独立的思考。期待未来抗体偶联药物在肺癌领域取得更多突破性进展。
【温馨提示】:如果您觉得薛锦慧医生解读的好,请在下方为她点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
1.Fang W, Li X, Wang Q et al. Sacituzumab tirumotecan versus docetaxel for previously treated EGFR-mutated advanced non-small cell lung cancer: multicentre, open label, randomised controlled trial. Bmj 2025; 389: e085680.
2. Passaro A, Jänne PA, Peters S. Antibody-Drug Conjugates in Lung Cancer: Recent Advances and Implementing Strategies. J Clin Oncol 2023; 41: 3747-3761.
3. Paz-Ares LG, Juan-Vidal O, Mountzios GS et al. Sacituzumab Govitecan Versus Docetaxel for Previously Treated Advanced or Metastatic Non-Small Cell Lung Cancer: The Randomized, Open-Label Phase III EVOKE-01 Study. J Clin Oncol 2024; 42: 2860-2872.
4. Ahn MJ, Tanaka K, Paz-Ares L et al. Datopotamab Deruxtecan Versus Docetaxel for Previously Treated Advanced or Metastatic Non-Small Cell Lung Cancer: The Randomized, Open-Label Phase III TROPION-Lung01 Study. J Clin Oncol 2025; 43: 260-272.
5. Zhao S, Cheng Y, Wang Q et al. Sacituzumab tirumotecan in advanced non-small-cell lung cancer with or without EGFR mutations: phase 1/2 and phase 2 trials. Nat Med 2025; 31: 1976-1986.
6. Zhang L, Fang W, Cheng Y et al. Sacituzumab tirumotecan (sac-TMT) in patients (pts) with previously treated locally advanced or metastatic (LA/M) non-small cell lung cancer (NSCLC) harboring uncommon EGFR mutations: Preliminary results from a phase 2 study. In. American Society of Clinical Oncology 2025.
7. Fang W, Wang Q, Cheng Y et al. Sacituzumab tirumotecan (sac-TMT) in combination with tagitanlimab (anti-PD-L1) in first-line (1L) advanced non-small-cell lung cancer (NSCLC): Non-squamous cohort from the phase II OptiTROP-Lung01 study. In. American Society of Clinical Oncology 2025.
8. Shimizu T, Sands J, Yoh K et al. First-in-Human, Phase I Dose-Escalation and Dose-Expansion Study of Trophoblast Cell-Surface Antigen 2-Directed Antibody-Drug Conjugate Datopotamab Deruxtecan in Non-Small-Cell Lung Cancer: TROPION-PanTumor01. J Clin Oncol 2023; 41: 4678-4687.
9. Spring LM, Tolaney SM, Fell G et al. Response-guided neoadjuvant sacituzumab govitecan for localized triple-negative breast cancer: results from the NeoSTAR trial. Ann Oncol 2024; 35: 293-301.
10. Stepan LP, Trueblood ES, Hale K et al. Expression of Trop2 cell surface glycoprotein in normal and tumor tissues: potential implications as a cancer therapeutic target. J Histochem Cytochem 2011; 59: 701-710.
11. Tarantino P, Ricciuti B, Pradhan SM, Tolaney SM. Optimizing the safety of antibody-drug conjugates for patients with solid tumours. Nat Rev Clin Oncol 2023; 20: 558-576.











 苏公网安备32059002004080号
苏公网安备32059002004080号


