由北京科创医学发展基金会主办的【肿瘤规范化诊疗项目——2025“颈彩纷呈”头颈肿瘤专家学术沙龙】第三期MDT中心交流会,于6月15日成功在上海举办。本次会议汇聚了国内三大知名医院的MDT中心团队:复旦大学附属眼耳鼻喉科医院、中山大学肿瘤防治中心以及中南大学湘雅医院。各团队展示了MDT团队构成及成果,分享头颈肿瘤MDT治疗中的复杂病例。与会专家深入探讨交流MDT模式在临床的应用经验与创新思路。


会议伊始,大会主席陶磊教授、刘学奎教授、闵安杰教授进行开幕致辞。头颈肿瘤诊疗因涉及多器官系统、病种繁多且需综合考量诸多因素,故单一学科难以全面应对,需外科、放疗科、内科、病理,影像等科室紧密协作,MDT团队协作至关重要。本次会议采用线上线下相结合的形式,三个团队对病例进行深入探讨,旨在促进不同中心MDT团队互相学习、交流经验,共同提高。各MDT中心通过分享临床诊疗经验、研究成果和数据,深入交流与讨论,从而拓宽视野、更新知识体系,使临床实践更加完善。感谢各位专家、同仁拨冗出席会议,期待本次会议取得圆满成功。
复旦大学附属眼耳鼻喉科医院MDT团队

病例分享:一例局晚期喉癌病例的诊疗经验 龚洪立教授

患者,男,62岁,因“声嘶2年,呼吸不畅1周”入院。2022-1-14喉镜示:双室带肥厚,双声带全程及前联合新生物,活动可,声门裂小,双梨状窝光滑、无积液。2022-1-14颈部CT示:喉部及喉外颈部弥漫软组织增厚,喉腔气道变窄。于2022-1-14急诊行“喉镜下喉肿物切除活检术+气管切开术”。术后病理:左右声带鳞癌Ⅱ级。IHC: CKpan(+), EGFR(+),P40(+),Ki67(80%+),P53(-)。2022-1-24颈部增强CT:双声门区、声门下及喉外颈部弥漫性软组织肿块,侵及喉软骨及喉外、左侧甲状腺,左侧著。诊断:声门恶性肿瘤(cT4bN0M0,IVB期)。吸烟史:30年,5支/日,未戒烟。饮酒史:30年,5两/日,未戒酒。
2022-1-27至2022-3-29行诱导化疗:抗EGFR单抗(800mg d1 q2w,5疗程;1-27、2-10、2-24、3-10、3-29)+TPF方案(多西他赛120mg d1,顺铂40mg d1-3,卡培他滨2粒 bid,d1-14,q3w,3疗程;1-28、2-21、3-29)。
2022-2-9颈部增强MRI:喉癌活检术后病例,目前双侧真假声带、会厌前间隙、喉旁、喉外弥漫软组织肿块(左侧著),肿块范围约4.2*6.2*5.0cm,涉及会厌舌面、前联合区及左侧甲状腺上缘,考虑肿瘤残留。
2022-3-12颈部增强MRI:喉癌化疗后病例,双侧真假声带、会厌前间隙、喉旁、喉外弥漫软组织肿块(左侧著),肿块范围约3.9*2.5*4.0cm。
2022-4-14纤维喉镜示:舌根光滑,会厌光滑,左披裂光滑,右披裂内侧组织增生(NBI模式下见少许斑点状IPCL),双室带肥厚,双声带术后疤痕样改变、活动好,右声带下缘稍厚,双梨状窝光滑、无积液。
2022-4-14颈部增强CT示:喉癌化疗后病例,双侧真假声带、会厌前间隙、喉旁、喉外弥漫软组织肿块(左侧著),较2022-3-12MRI略缩小,双侧颈部多发小淋巴结,双上颈Ⅱa区淋巴结稍大,短径约0.6cm。气管切开术后改变,造口尚光整。
诱导化疗后,肿瘤大小由4.2*6.2*5.0cm退缩至3.9*2.5*4.0cm,体积退缩35.5%。遂行“全喉+左侧甲状腺切除+双侧侧颈清扫+中央区淋巴结清扫+气管再造口术”。术中见肿瘤位于声门区前联合,侵犯声门下,并向会厌前间隙及喉外突出生长。
术后病理提示:原发灶仅剩散在退变巢团状癌细胞,甲状腺及送检切缘均阴性。病变破坏部分甲状软骨板浸润至喉前方(左侧甲状腺上方),前上方向喉前间隙膨出,局部小区表面未见正常组织伴烧灼痕(提示局部阳性切缘可能)。IHC(I22-1062):CKpan(+),P63(+),Ki67(局部50%+),CD34(-),EGFR(+),P40(+),HHF35(-),P53(-),P16(部分+),TTF-1(甲状腺+),Tg(甲状腺+),TPO(甲状腺+),HBME-1(-)。由此可见,病理检查中淋巴结及送检切缘均阴性与术前影像学检查肿瘤广泛侵犯的特征不相符合。
2022-5-5颈部增强MRI:全喉术后改变,与2022-3-12MRI比较,原喉部肿块已切除,术区周壁轻度软组织增厚。
2022-5-16至2022-6-30行术后辅助治疗:同步放化疗,放疗(66Gy)+顺铂(50mg,2d,q3w)。术后定期随访,截至2025-4-16未见肿瘤复发征象。



大咖论道-病例讨论:
中南大学湘雅医院:
该病例采用西妥昔单抗联合TPF的靶向联合化疗诱导方案,成功将不可切除肿瘤转变为可切除,实现了R0切除,且长期随访情况稳定。该方案经济实用,无需复杂检测,且多数头颈鳞癌患者EGFR阳性,疗效显著。但在治疗中存在两点困惑:其一,临床疗效评估按RECIST 1.1标准,因头颈部解剖复杂,肿瘤形态不规则,测量长径困难,未来需推出适应头颈部肿瘤的新标准,如体积测量、功能评估等更适宜的方法;其二,术后病理与影像学存在差异,影像学可见强化灶但病理未见肿瘤细胞,仅为化疗反应,说明现有评估手段有局限性。患者p16部分阳性,可考虑放疗保留喉功能,即便放疗后复发,在规范随访下也可后续手术。术后放疗是否需同步化疗存疑,当时选择全喉切除并后续同步放化疗虽激进,但术后随访情况良好,此为一成功案例。
中山大学肿瘤防治中心:
不可切除局部晚期喉癌患者的新辅助治疗,可选择同步放化疗、TPF方案诱导化疗、免疫联合化疗或者TPF方案联合抗EGFR单抗等方案,但需注意其毒性问题。疗效评价需结合影像学手段观察肿瘤内部结构变化。如果采用新辅助放疗,一般进行约25次后进行影像学评估,若放疗效果不佳,则可能暂停放疗,交由外科处理。该患者诱导后采用外科手术,术前需评估椎前肌侵犯情况,术中应关注椎前组织标本获取。该患者的整体治疗流程遵循现有指南,并取得较好疗效。未来可基于现有治疗经验开展临床研究,如通过PET-CT、穿刺活检等手段更精准评估肿瘤状态,进行分层治疗,进一步优化头颈部肿瘤治疗方案,为患者提供更精准、个体化的治疗选择。
复旦大学附属眼耳鼻喉科医院:
对于不可手术的头颈部鳞癌患者,身体状况良好且初次治疗时,可选择靶向或免疫联合TPF方案作为诱导治疗,以实现更深的肿瘤缓解。但要注意,肿瘤囊变、坏死等可能导致部分患者影像学检查未显示显著缓解,术后却可能为完全缓解。此时,为避免全喉切除,需常规进行多点活检,重点关注强化区域。治疗后病理改变可能存在肿瘤未被完全杀死,对于切缘烧灼的情况应如实报告,供临床医生参考。对于肿瘤较大的病例,术后宜选择辅助治疗。若存在切缘可疑情形,依据指南应采用同期放化疗,同时期待大型Ⅲ期临床试验结果来指导后续治疗决策。目前,p16在喉及下咽癌中与HPV的关系尚不明确,建议收集更多样本进行深入研究,以便更好地了解其对治疗和预后的影响。
中山大学肿瘤防治中心MDT团队

病例分享:复发性舌癌患者的治疗 吴迪教授

患者,男,52岁,因“舌癌综合治疗后1年,舌肿物半个月”于2024-10收入院。2023-11患者于外院诊断为舌左侧高分化鳞癌。2023-11-17行“左侧舌扩大+左侧根治性颈淋巴结清扫+左侧股前外侧游离皮瓣移植术”。术后分期:pT2N0M0Ⅱ期。2024-1-12至2024-2-29行术后辅助同步放化疗:放疗(原发灶DT 60 Gy,区域淋巴结 DT 54 Gy,30次)+化疗(3周期,洛铂55 mg+尼妥珠单抗200 mg;1-16、2-5、2-18)。2024-10-16胸部CT:未见明显异常。2024-10-28舌肿物病理:鳞状上皮增生,局灶见溃疡坏死,可见散在小巢状增生的异形细胞,结合免疫组化,符合鳞状细胞癌(中分化)。2024-10-20颌面部及颈部MRI:左舌癌术后放化疗后复查,舌左份术后部分缺失,术区不规则软组织肿块,考虑肿瘤复发可能。诊断:舌癌综合治疗后复发(c rT4aN0M0)。
2024-11-11、2024-12-2分别行白蛋白紫杉醇260 mg/m2+洛铂30 mg/m2+普特利单抗200 mg。2024-12-17,疗效评价SD。2024-12-17、2024-12-24分别行西妥昔单抗400 mg。2025-1-7、2025-2-5分别行白蛋白紫杉醇260 mg/m2+洛铂30 mg/m2+特瑞普利单抗200 mg+西妥昔单抗420 mg。2025-2-21疗效评估为PR。2025-3-6行特瑞普利单抗200 mg+西妥昔单抗405 mg。
2025-2-17胸部CT:双下肺少许炎症。2025-2-18MRI:舌左份部分缺失,复发肿瘤较前缩小、坏死周围结构欠清,不排除合并肿瘤浸润。舌右侧份结节,可疑转移,较前缩小。颈部右侧Ⅰb区小淋巴结,较前缩小。
2025-3-17全麻下行“舌癌根治+右下颌骨截断切除+钛板内固定+左侧胸大肌皮瓣转移修复+右颈淋巴结清扫+左颈椎区淋巴结清扫+气管切开术”。术后诊断:舌癌综合治疗后复发(p rT4aN3bM0,IVa期)。
2025-4-25、2025-5-16分别行术后辅助治疗:白蛋白紫杉醇260 mg/m2+洛铂30 mg/m2+普特利单抗200 mg,目前仍然在维持治疗中。

大咖论道-病例讨论:
中南大学湘雅医院:
该病例在新辅助治疗后,肿瘤出现坏死并穿透口腔黏膜,形成巨大坏死性空洞,导致难以判断肿瘤是进展还是缓解。恶性肿瘤在接受免疫治疗后可能出现坏死空洞,其原因主要包括:免疫细胞激活后杀伤肿瘤细胞引发炎症,导致组织坏死;免疫治疗破坏肿瘤血管,使肿瘤缺血缺氧而坏死;或肿瘤快速增长致血液供应失衡,使坏死区域扩大。一般情况下,新辅助治疗后溃疡会退缩、黏膜修复,但此病例中的坏死性空洞增加了手术难度。此外,患者前期治疗的诸多情况需关注,包括普特利单抗、洛铂的使用考量,以及联合化疗后疗效判断的准确性等。同时,手术方式和后续治疗周期的选择也是待解问题。反复更换治疗方案可能并不可取,且对于维持治疗时长在临床上尚存争议。目前,这些问题尚难回答,需进一步开展临床研究。
复旦大学附属眼耳鼻喉科医院:
该患者初始治疗中,2023-11-17手术,2024-1-12开始放疗,同期使用尼妥珠单抗及洛铂。放疗延迟(超出推荐6周时间)可能影响疗效;顺铂是标准药物,洛铂可能需换用顺铂。复发转移免疫治疗中,帕博利珠单抗联合化疗是标准方案,建议进行PD-L1表达检测以指导治疗;其他PD-1抑制剂在头颈鳞癌中疗效也不错,值得临床关注。患者初始治疗中,术后8个月出现严重进展,可能随访不足,需加强宣教和定期随访,以早期挽救性手术。当免疫联合化疗后肿瘤退缩不佳,可考虑西妥昔单抗。后续治疗需综合考虑疗效、耐受性等因素。病理显示p16阴性,建议做HPV分子检测。
中山大学肿瘤防治中心:
患者复发后采用白蛋白紫杉醇、洛铂联合普特利单抗治疗,两周期后疗效欠佳,处SD与PD临界,后改用西妥昔单抗,达PR。维持治疗阶段,可考虑免疫维持或口服卡培他滨等化疗药,以减轻治疗负担。化疗联合免疫维持或有益,但患者未做PD-L1检测,前期PD-1抑制剂联合化疗效果仅SD,需进一步检测。同时,要明确肿瘤是超进展还是坏死脱落,若证实PD-1抑制剂有效,可考虑西妥昔单抗联合免疫维持治疗。整体治疗方案要遵循指南,化疗疗程不超6周期,后续免疫或口服药维持。
中南大学湘雅医院MDT团队

病例分享:一例晚期颊癌伴颅底、颈椎转移病例的诊疗 朱刚才教授、伍海军教授

患者,男,55岁,因“右颈部肿物伴右颊黏膜溃烂1月余,确诊右颊鳞癌1周”于2024-12-26收入院。2024-12-19于外院行右颊肿物病理活检,结果回报:(右颊)鳞状上皮重度非典型增生、癌变。2024-12-31 MRI:右颊部可见片状等-长T1等-长T2信号灶向磨牙后三角区延伸,大小约34mm×12mm×13mm,明显强化;右颈ⅠB、ⅡA、Ⅲ区多发淋巴结肿大,大者大小约26mm×22mm,内见无强化区;右侧后颅窝近颈静脉孔区和C4左侧横突异常信号灶。2025-1-2 PET-CT:右侧颊部条片状糖代谢异常增高灶,累及右侧上磨牙后三角区;右侧颈部Ⅰ-Ⅲ区数枚淋巴结,糖代谢不同程度增高;右侧枕骨基底部、C3右侧横突及C4左侧横突局灶性糖代谢增高灶,部分见成骨性改变:符合右颊部恶性肿瘤表现并淋巴结转移、骨转移表现。2025-1-6本院病理:(右颊)高-中分化鳞癌。免疫组化:CK-Pan(+),EGFR(+),Ki67(70%),P53(+,突变型),P16(-),NUT(-),EBER(原位杂交)(-)。患者吸烟史20年,5-6支/周;咀嚼槟榔史20年,1颗/天,戒除2个月。查体:张口度1指半,右颊黏膜后份至软腭区可见一5*3cm大小溃疡型肿物,肿物表面溃烂,边缘隆起,质硬,有按压痛;右颈部颌下及胸锁乳突肌前上份可见2个肿物,直径为3cm、5cm,质硬,活动度差。诊断:1、右颊鳞癌(累及磨牙后区及口咽,颅底、颈椎转移可能,cT3N3bM1,IVc期);2、口腔白斑(左颊);3、高尿酸血症;4、高脂血症。
2025-1-7至1-9予以:西妥昔单抗0.8g d1+白蛋白紫杉醇390mg d1+顺铂45mg d1-3。此后在当地医院完成第2周期化疗+靶向治疗(西妥昔单抗周方案)。
MRI:颊癌新辅助治疗后,右颊部异常信号灶较前稍缩小,右颈部ⅠB、ⅡA、Ⅲ区淋巴结较前缩小;右侧后颅窝近颈静脉孔区异常信号灶。
PET:颊癌新辅助治疗后,右侧颊部条片状糖代谢异常增高灶范围较前明显缩小、代谢较前明显减低;右侧颈部Ⅰ-Ⅲ区数枚淋巴结较前缩小,糖代谢不同程度增高较前减低,部分病灶(右侧Ⅰb区淋巴结)活性较高;右侧枕骨基底部、C3右侧横突及C4左侧横突糖代谢增高灶已消失。
2025-03-06行“(右)颊颌颈联合根治术+(右)颈淋巴结根治性清扫术+股前外皮瓣移植术+气管切开术”。术后病理:(右颊、右颊扩大切除)高-中分化鳞癌,大小1.0×0.6×0.5cm,浸润深度0.5cm,未见明确脉管及神经侵犯;(前、后、内、外、底、肌肉及骨切缘)未见癌;送检颈清淋巴结可见癌转移(Ⅰ区1/10、Ⅱ区1/2),余淋巴结未见癌(Ⅲ区0/6、Ⅳ区0/9、Ⅴ区0/11、颈清剩余组织0/12)。TNM分期:TxN2bMx。
MRI:术后改变,术区条片状强化灶,右侧咬肌、颞肌、翼外肌水肿并渗出;右侧后颅窝近颈静脉孔区异常信号灶同前。
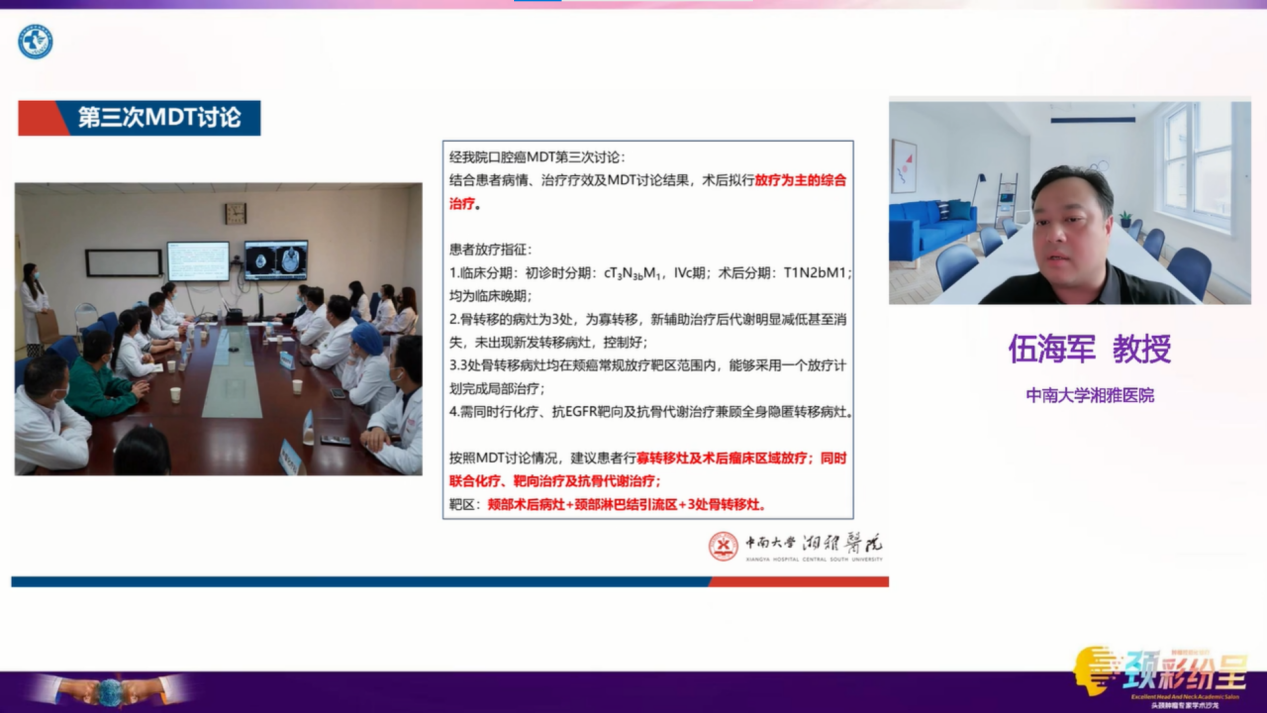
经MDT讨论后,建议患者行寡转移灶及术后瘤床区域放疗;同时联合化疗、靶向治疗及抗骨代谢治疗。靶区:颊部术后病灶+颈部淋巴结引流区+3处骨转移灶。放疗期间治疗:唑来膦酸4mg 静滴 d1,q4w,同步顺铂100mg/m2,d1-2(两天完成),q3w 共两次,尼妥珠单抗200mg 静滴 q1w 共六次。患者治疗期间出现3级口腔黏膜反应,1级皮肤反应,2级骨髓抑制,经积极漱口、抗炎、升血象等治疗,并加强口腔护理、行放疗区皮肤保护处理等,患者症状改善,顺利完成治疗。

大咖论道-病例讨论:
复旦大学附属眼耳鼻喉科医院:
局部复发是局晚头颈鳞癌患者的关键问题,对于寡转移患者,药物治疗有效时局部治疗意义重大。该病例采用TPExtreme方案诱导达PR后手术+放化疗方式,效果较好,但维持治疗仍存疑。具转移迹象患者维持治疗是必要的。影像评估需细致全面,避免遗漏病灶。较晚期的患者建议多做分子相关检测,临床医生参与淋巴结分区送检有助于提高检测准确性。类似病例可考虑脊柱外科手术,但目前内科或放射治疗更受青睐。该病例突出综合治疗、精准评估及个性化治疗方案对局晚期鳞癌临床治疗的重要性。
中山大学肿瘤防治中心:
该患者的细致诊疗具有参考价值,强调治疗前PET-CT检查对全面评估病情的重要性。鉴于颈椎转移灶稳定,可能暂无需骨科手术干预。针对局部晚期原发肿瘤,建议采用新辅助化疗(4-6疗程)联合后续局部治疗(如放疗)的策略,此方案在缩小照射野、提升局部剂量(尤其对寡转移灶)方面具有优势。后续维持治疗需补充PD-L1及EGFR等检测以提供依据。该病例治疗效果良好,引发三点关键思考:一、颈椎转移灶性质、风险及优先级需骨科、肿瘤科会诊明确;二、新辅助治疗后,在确保R0切除及术中冰冻病理阴性的前提下,可依据肿瘤退缩范围实施降阶手术(缩小切除范围,减少下颌骨切除与皮瓣修复),对保留功能意义重大;三、放疗科需阐明多部位放疗时,是否依据初始病灶范围评估照射野与剂量。
中南大学湘雅医院:
该病例颈椎转移病灶经放疗后可能出现骨坏死等并发症,影响稳定性,需骨科、脊柱外科协助处理。TPExtreme方案用于术前治疗,缩瘤效果良好,尤其舌癌原发灶,但淋巴结效果稍差,若达pCR,患者总生存和无复发生存较好。部分患者不能完成预计治疗致病情反复,需进一步探索合适周期和药物组合。病灶缩小后手术能否降级,尚需扩大样本量验证。同步放化疗效果较好,应将指南推荐方案和个体化治疗相结合。
大会总结

会议尾声,陶磊教授、刘学奎教授、闵安杰教授对本次交流会进行总结陈词。头颈部肿瘤MDT能够跨越学科界限,为患者量身打造全面且规范的治疗方案,进而提升治疗效果。未来应将此模式贯穿患者治疗全程,并且各医疗单位及科研团队要强化合作,共同为患者提供优质的服务。本次会议中,三家单位MDT团队深入交流,成功剖析病例,成效显著。希望今后继续开展此类研讨会,助力大家共同学习成长,进而推动头颈部肿瘤诊疗领域的不断进步与发展。


排版编辑:肿瘤资讯-TJ











 苏公网安备32059002004080号
苏公网安备32059002004080号


