在Cell Reports、PNAS 、 Cell Death Dis 等1区杂志发表多篇文章
ASCO 解读文献
LBA7000:BrECADD和BEACOPP在晚期经典型霍奇金淋巴瘤中的耐受性和疗效对比:GHSG HD21随机研究
摘要
研究背景
研究假设,采用基于正电子发射断层扫描(PET2)引导的BrECADD新方案(包括维布妥昔单抗、依托泊苷、环磷酰胺、多柔比星、达卡巴嗪和地塞米松)治疗进展期经典型霍奇金淋巴瘤(cHL),可能改善患者治疗效果。HD21试验旨在研究该方案在治疗相关并发症(TRMB)方面是否低于BEACOPP方案(博来霉素、依托泊苷、多柔比星、环磷酰胺、长春新碱、丙卡巴肼和泼尼松),并且无进展生存期(PFS)是否具有非劣效性(NI)。本文为HD21试验最终确证性分析的首次报告。
研究方法
HD21是一项国际多中心、开放标签、随机对照的III期临床试验,纳入诊断年龄在18至60岁之间的进展期cHL患者。患者根据PET2结果被随机分配接受个体化的4或6个周期的BEACOPP或BrECADD治疗。本研究设有两个主要联合终点:TRMB和PFS,目前均已确立。优效性验证的统计分析预设在完成4年随访后进行;疗效优越性的判断标准为达到调整后的显著性水平α=0.047。本试验遵循ICH-GCP(注册号:NCT02661503),并获得武田肿瘤公司的科研资助。
研究结果
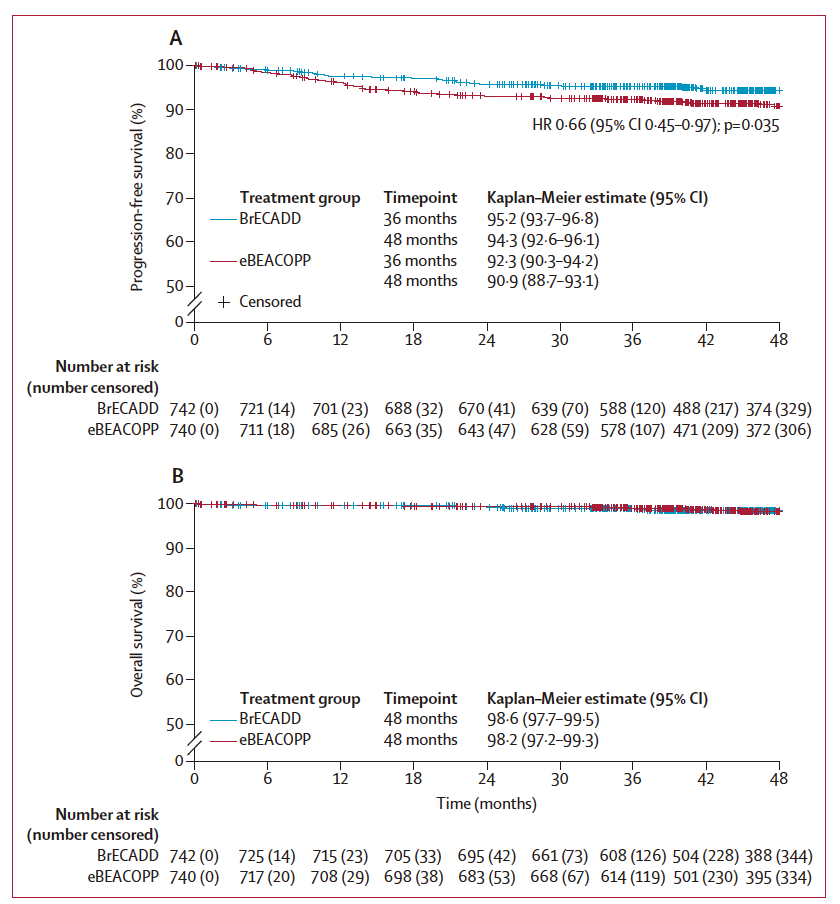
本研究的意向性治疗(ITT)人群共纳入1482例用于疗效分析的患者,其中742例被随机分配至BrECADD组,740例分配至BEACOPP组。患者的中位年龄为31.1岁(范围18–60岁),其中女性占44%。在BrECADD组和BEACOPP组中,PET2评估结果为阴性的患者分别为424例(57.5%)和426例(58.2%),这部分患者接受4个周期的治疗。在中位随访48个月后,BrECADD组的4年PFS为94.3%(95%-CI:92.6–96.1),而BEACOPP组为90.9%(95%-CI:88.7–93.1),两组间的风险比(HR)为0.66(95% CI:0.45–0.97,p=0.035)。BrECADD组PFS获益的主要来源是早期治疗失败的减少,包括3个月内的原发进展(5例 vs.15例)及3至12个月内的早期复发(11例 vs.23例),且这一趋势在所有研究亚组中均有体现。BrECADD组PET2阴性的患者,其4年PFS达到96.5%。4年总生存率(OS)方面,BrECADD组为98.5%,BEACOPP组为98.2%。生殖功能分析显示,治疗一年后,BrECADD组患者的促卵泡激素(FSH)恢复率显著更高,男性为67% vs. 24%,女性为89% vs. 68%;BrECADD组的生育率也更高(出生人数:60例 vs. 43例)。
研究结论
BrECADD方案在疗效上优于BEACOPP,并实现了良好的4年PFS,使疾病进展、复发或死亡的风险降低约三分之一。结合多数患者仅需3个月的短期治疗以及良好的耐受性,基于PET2引导的个体化的BrECADD治疗策略为成年进展期cHL患者树立了新的治疗标杆。
临床试验信息: NCT02661503
研究资助方: 武田肿瘤公司(Takeda Oncology)。
解读
利剑出鞘,双刃难控——BEACOPP方案:临床关注焦点转向风险控制
进展期cHL主要发生于年轻成人,发病中位年龄约为30岁。随着上世纪70年代ABVD方案的问世,该病的生存结局较前明显改善[1]。此后,基于化疗方案的风险–收益比成为持续争论的科学议题——尽管增强化疗强度可能提高疗效,但同时也可能带来更严重的毒性[2]。德国霍奇金研究小组开发了高强度的BEACOPP方案,旨在一开始即最大程度清除恶性克隆,从而获得优异的无进展生存率,然而,该方案带来的治疗负担极重,器官功能长期受损显著影响患者的健康相关生活质量[3, 4]。如何增强患者疗效的同时进一步改善患者耐受性和减低治疗相关长期毒性,一直是临床关注的焦点。
CD30是经典型霍奇金淋巴瘤中持续高表达的细胞表面蛋白,因此成为理想的靶向治疗目标。维布妥昔单抗作为一种抗体-药物偶联物在复发或难治性cHL中已显示出良好的风险–收益比[5]。一项Ⅱ期研究结果显示,BrECADD方案在临床上可行,具有良好的肿瘤控制率和治疗耐受性[6]。然而,该方案目前缺乏随机对照研究数据,且尚无其在PET-2指导策略中应用的研究结果。因此,这项随机、多中心、平行、开放标签的Ⅲ期临床试验HD21研究评估了PET引导下BrECADD与BEACOPP方案在进展期cHL患者中耐受性和疗效上的比较。
毒性要轻,疗效要佳——BrECADD方案:不是“平替”,而是全方位升级
BrECADD方案设计之初,旨在解决BEACOPP的耐受性问题,重点关注了严重的血液学及非血液学急性不良事件。结果显示BrECADD显著优于BEACOPP,其主要是由于血液毒性的减少。然而,两组中均有相当比例的患者发生了中性粒细胞减少伴发热,且以第1周期为主,这提示治疗管理需特别关注第1周期的感染风险。尽管与ABVD相比,BrECADD可能在治疗后12个月内导致了更高的急性不良事件,但随访发现大多数器官功能在BrECADD组中已完全恢复或仅残留1级毒性。此外,研究观察到女性和男性患者的性腺功能均有良好恢复,生育情况也较理想,生育功能恢复与ABVD治疗后报告的数据相当。同时,该项研究发现使用达卡巴嗪代替丙卡巴肼,也可能与BrECADD组中更低的继发性骨髓增生异常综合征或急性髓性白血病相关。这些发现提示BrECADD总体致突变潜力有限,类似于ABVD或BV-AVD。此外,研究显示BrECADD治疗的患者多柔比星累积剂量均低于ABVD方案300mg/m²,提示相对更低剂量的蒽环暴露有望降低心肌病及充血性心力衰竭等长期毒性风险。总体而言,相对BEACOPP方案,甚至是对比既往ABVD或BV-AVD方案,BrECADD在进展期cHL患者中具有良好的耐受性和安全性。
在疗效方面,这项研究优效性检验显示BrECADD在PFS显著优于BEACOPP。BrECADD方案的4年PFS为94.3%,比以往在进展期cHL的大型随机试验都相对更高。进一步分析显示相对于BEACOPP组,BrECADD组患者PFS获益的主要来源是早期治疗失败的减少,主要为3个月内的原发进展及3至12个月内的早期复发。这些数据表明最终疗效的提高主要归因于难治性病例和早期复发的减少,进一步强调了在进展期cHL中早期实现疾病控制对于获得良好长期结局的重要性。
精准引导,因应而动——PET2引导下的BrECADD或将重塑晚期cHL治疗范式
本研究的另一个重要优势在于采用个体化的PET-2指导策略,大多数患者仅接受了4个周期(即12周)的BrECADD治疗。亚组分析表明,与BEACOPP相比,PET-2阴性的患者从BrECADD中获益最大,4年PFS高达96.8%。这些患者良好的PFS表明,进展期经典型霍奇金淋巴瘤涵盖了具有不同个体风险谱的患者,这也进一步支持在高效治疗的背景下采用个体化治疗策略。同时,通过缩短治疗周期对癌因的疲乏恢复及社会功能重建的积极影响亦印证了这一观点。

将本研究结果与当前其他治疗策略进行比较也很重要。可惜的是,由于入组标准和终点定义的差异,间接比较存在局限,需谨慎解读。不过,不同方案报道的PFS仍能提供一定的参考。RATHL研究评估了ABVD在PET-2阴性患者中减量为AVD策略,试图降低肺毒性,对于PET-2阳性者则升级为BEACOPP,所有患者的3年PFS为82.6%[8]。另一策略是A-AVD方案,通过用维布妥昔单抗替代博来霉素,在ECHELON-1试验中对比ABVD进行优效性检验,所有患者均接受了6个周期治疗,在A-AVD组中18–60岁患者的6年PFS为84.4%[9]。总的来说,与已发表的ABVD相关方案相比,BrECADD在3年PFS大约能提高10%。值得注意的是,一项非个体化策略的研究目前正在以PD-1抑制剂纳武利尤单抗替代维布妥昔单抗,构建N-AVD的方案(NCT03907488),2年无进展生存率为92%[10]。尽管早期数据令人鼓舞,但目前尚无成熟数据以评估其主要治愈率及风险-获益比,仍需等待进一步研究结果。
这项研究亦存在一定的局限性。首先,由于BEACOPP不适用于60岁以上患者,因此试验未纳入此年龄段,BrECADD在老年患者中的安全性和疗效尚不明确。其次,试验结果仅适用于具备良好医疗资源的机构,这是由于治疗过程中可能出现发热及感染等需要严密管理。总体而言,PET-2指导下的BrECADD治疗显示出良好的疗效和耐受性,采用个体化、短周期的BrECADD治疗策略,为大多数患者提供了有利的风险–获益比。因此,BrECADD方案在一线治愈率方面树立了新的临床标杆,有望成为新诊断进展期cHL成年患者的标准治疗选择。
吴辉菁教授——湖北省肿瘤医院
黄英丹医师聚焦于GHSG HD21研究,整体解读结构清晰、重点突出,充分展现了其对BrECADD方案在晚期经典型霍奇金淋巴瘤治疗中疗效与安全性优势的深入理解。能够准确把握BrECADD与BEACOPP在耐受性及疗效等方面的关键差异,并通过对比既往研究数据,勾勒出当前晚期经典型霍奇金淋巴瘤一线治疗的格局,同时对未来研究方向作出初步展望,体现出较强的数据解读能力与临床转化思维。此外,黄英丹医师在标题设计与语言表达方面兼顾学术性与传播力,整体表现令人印象深刻。
【温馨提示】:如果您觉得黄英丹医生解读的好,请在下方为她点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
1.Santoro A, Bonadonna G, Valagussa P, Zucali R, Viviani S, Villani F, et al. Long-term results of combined chemotherapy-radiotherapy approach in Hodgkin's disease: superiority of ABVD plus radiotherapy versus MOPP plus radiotherapy. J Clin Oncol 1987, 5(1): 27-37.
2. Connors JM. Hodgkin's lymphoma--the great teacher. N Engl J Med 2011, 365(3): 264-265.
3. Loeffler M, Hasenclever D, Diehl V. Model based development of the BEACOPP regimen for advanced stage Hodgkin's disease. German Hodgkin's Lymphoma Study Group. Ann Oncol 1998, 9 Suppl 5: S73-78.
4. Kreissl S, Muller H, Goergen H, Meissner J, Topp M, Sokler M, et al. Health-Related Quality of Life in Patients With Hodgkin Lymphoma: A Longitudinal Analysis of the German Hodgkin Study Group. J Clin Oncol 2020, 38(25): 2839-2848.
5. Younes A, Gopal AK, Smith SE, Ansell SM, Rosenblatt JD, Savage KJ, et al. Results of a pivotal phase II study of brentuximab vedotin for patients with relapsed or refractory Hodgkin's lymphoma. J Clin Oncol 2012, 30(18): 2183-2189.
6. Eichenauer DA, Plutschow A, Kreissl S, Sokler M, Hellmuth JC, Meissner J, et al. Incorporation of brentuximab vedotin into first-line treatment of advanced classical Hodgkin's lymphoma: final analysis of a phase 2 randomised trial by the German Hodgkin Study Group. Lancet Oncol 2017, 18(12): 1680-1687.
7. Borchmann P, Ferdinandus J, Schneider G, Moccia A, Greil R, Hertzberg M, et al. Assessing the efficacy and tolerability of PET-guided BrECADD versus BEACOPP in advanced-stage, classical Hodgkin lymphoma (HD21): a randomised, multicentre, parallel, open-label, phase 3 trial. Lancet 2024, 404(10450): 341-352.
8. Johnson P, Federico M, Kirkwood A, Fossa A, Berkahn L, Carella A, et al. Adapted Treatment Guided by Interim PET-CT Scan in Advanced Hodgkin's Lymphoma. N Engl J Med 2016, 374(25): 2419-2429.
9. Ansell SM, Radford J, Connors JM, Dlugosz-Danecka M, Kim WS, Gallamini A, et al. Overall Survival with Brentuximab Vedotin in Stage III or IV Hodgkin's Lymphoma. N Engl J Med 2022, 387(4): 310-320.
10. Herrera AF, LeBlanc M, Castellino SM, Li H, Rutherford SC, Evens AM, et al. Nivolumab+AVD in Advanced-Stage Classic Hodgkin's Lymphoma. N Engl J Med 2024, 391(15): 1379-1389.











 苏公网安备32059002004080号
苏公网安备32059002004080号


