香港中文大学博士,中山一院胃肠外科临床博士后
入选广东省海外博士后人才支持项目
欧洲医学教育联盟(AMEE)Specialist
欧洲医学肿瘤学会(ESMO)会员
主持博士后基金1项,广东省自然基金2项,广州市科研基金1项,参与国自然基金3项
广东省临床医学会结直肠外科专委会 青年委员
广东省器官医学与技术学会肿瘤精准医学专业委员会兼胃肠肿瘤学组 委员
广东省基层医药学会胃肠疾病专业委员会 委员
广东省研究型医院学会胃肠肛门外科专业委员会 委员
ASCO 解读文献
LBA4012
维迪西妥单抗(DV)联合特瑞普利单抗(Tor)和化疗(C)/曲妥珠单抗(Tra)一线(1L)治疗HER2表达局部晚期或转移性(la/m)胃癌患者的研究结果
摘要
研究背景
在既往的I期临床研究中,维迪西妥单抗联合特瑞普利单抗(DV+T)在二线及后线治疗HER2表达的胃或胃食管结合部(G/GEJ)癌中取得令人鼓舞的有效性及可控的安全性(Wang et al,eClinicalMedicine,2024)。本次研究报告了一项评估一线使用DV+T联合化疗或曲妥珠单抗在HER2阳性或HER2低表达的局部晚期或转移性G/GEJ癌患者中有效性和安全性的II/III期试验的随机II期部分结果。
研究方法
入组患者为既往为接受过治疗的HER2阳性(IHC 3+,或IHC 2+且FISH+)的局部晚期或转移性G/GEJ患者,1:1:1随机分为3组,试验组1 (EG1)予以维迪西妥单抗(DV,2.5mg/kg,Q2W)+ 特瑞普利单抗(Tor,3.0mg/kg,Q2W)+ CAPOX(奥沙利铂[OX]:130mg/m2,第1天;卡培他滨[CAP]:1000mg/m2,第1-14天;Q3W);试验组2(EG2)予以DV + Tor +曲妥珠单抗(Tra,起始剂量8mg/kg,维持剂量6mg/kg,Q3W);对照组(CG1)予以Tor + Tra + CAPOX。另外入组HER2低表达(IHC 1+,或ICH 2+但FISH-)的局部晚期或转移性G/GEJ患者,第一阶段将1:1随机分为2组。试验组1(EG1)接受DV + Tor + CAPOX或对照组1(CG1)Tor + CAPOX;根据第一阶段的安全性数据,第二阶段这部分患者将1:1:1随机分为3组,分别予以EG2:DV(2.5mg/kg)+ Tor +CAPOX(减量:OX 100mg/m2,CAP 750mg/m2);EG3:DV(2.0mg/kg)+ Tor +CAPOX(减量)以及CG2:Tor + CAPOX。主要研究终点是客观缓解率(ORR)。
研究结果
截止到2025年2月7日,共有51例HER2阳性患者(大部分为HER2 IHC 3+)和93例HER2低表达患者(大部分为HER2 IHC 1+)纳入研究。在HER2阳性的患者中,EG2组显示出较高的ORR(82.4%)。HER2低表达患者第一阶段EG1组ORR为70.8%,且与CG1组比无进展生存期(PFS)的风险比(HR)为0.67,提示试验组有明显获益;而在第二阶段,EG2组的最高ORR为76.9%。主要的研究结果如下表所示。
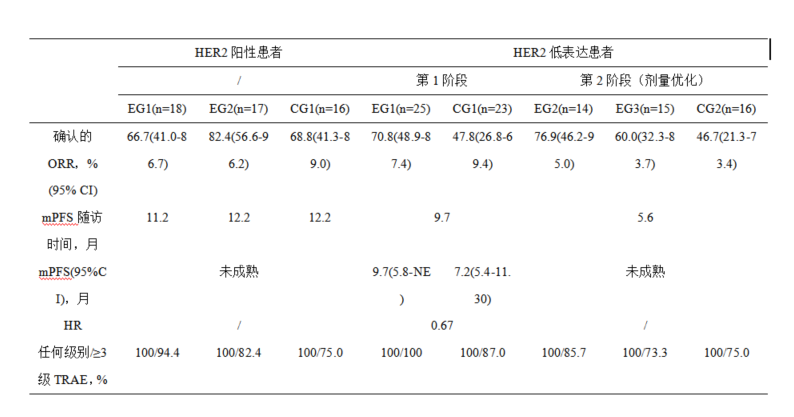
研究结论
在HER2阳性的局部晚期或转移性G/GEJ癌患者中,维迪西妥单抗+特瑞普利单抗+曲妥珠单抗组合表现出更高的ORR,提示对于这部分患者这一“去化疗”组合可能是一种可选的治疗方案。而对于HER2低表达的局部晚期或转移性G/GEJ癌患者,维迪西妥单抗+特瑞普利单抗+CAPOX组合表现出较高的ORR和PFS,且安全性可控;另外减量的CAPOX方案能够在维持较高的有效性的同时提高治疗耐受性。
临床研究信息:NCT05980481。
解读
靶向HER2—老路生花
HER2是ERBB2基因编码的跨膜酪氨酸激酶受体蛋白,属于表皮生长因子受体(EGFR)家族中的一员。HER2基因变异包括突变、扩增、过表达等,与多种肿瘤的发生发展密切相关,而其在胃癌治疗中的地位早在2010年就已经奠定。2010年横空出世的ToGA研究打响了胃癌靶向治疗的第一枪,与单纯化疗组相比,靶向HER2的曲妥珠单抗联合化疗能够有效延长HER2(3+)或HER2 (2+)且FISH阳性的晚期胃癌患者的OS和PFS,将晚期HER2阳性胃癌患者的总生存时间提高到1年以上,从此奠定了抗HER2治疗在HER2阳性胃癌治疗中的基石[1]。此后10年,虽然抗HER2靶向药物层出不穷,如帕妥珠单抗(Pertuzumab)在内的单克隆抗体、拉帕替尼(Lapatinib)为代表的酪氨酸激酶抑制剂(Tyrosine kinase inhibitor,TKI)以及恩美曲妥珠单抗(Trastuzumab Emtansine,T-DM1)为代表抗体偶联药物(Antibody-drug conjugate,ADC),但这些药物在HER2阳性胃癌的治疗中表现平平,相关临床研究无一取得阳性结果,均以失败告终[2-4]。直到2020年,新一代抗HER2的ADC类药物,德曲妥珠单抗(Trastuzumab deruxteca,DS-8201/T-Dxd)的出现,掀起了新一轮抗HER2治疗胃癌的热潮。从DESTINY-Gastric01、06三线治疗到DESTINY-Gastric02、04二线治疗的成功,再到DESTINY-Gastric03、05开始在一线治疗的探索,都在以令人欣喜的速度推进治疗HER2阳性胃癌的前进步伐[5, 6]。
维迪西妥单抗(Disitamab vedotin,DV/RC48)是我国药企自主研发的靶向HER2 ADC类药物,其通过偶联微管蛋白抑制剂MMAE,特异性结合HER2阳性肿瘤细胞,内化后释放细胞度毒药物破坏肿瘤细胞[7]。前期研究发现DV的旁观者效应能够使得其穿透细胞膜,杀伤临近HER2低表达或异质性表达的肿瘤细胞,从而使得其对HER2低表达的肿瘤细胞亦有杀伤作用[8]。早在2020年,C008研究就奠定了RC48在HER2阳性胃癌患者后线治疗中的地位,将晚期HER2阳性胃癌患者三线治疗的mPFS达到了4.1个月,mOS延长到了7.9个月[9]。该研究也对HER2表达进行了重新定义,将HER2 IHC2+但FISH-定义为HER2低表达人群,研究结果显示这一类HER2低表达人群也能从RC48治疗中获益;传统HER2阳性(IHC 3+或IHC 2+/FISH+)的胃癌患者仅仅占总体人群的15%左右[10],这一人群拓展将获益人群提高了30%左右,使得治疗人群数量得到倍增。2024年发表C013研究则将RC48的适应证从后线推进到了二线治疗,并将HER2低表达人群进一步扩展到了IHC 1+的人群[11]。2024年ASCO会议上由山东大学齐鲁医院刘联教授牵头的RCTS研究将RC48推进到了HER2过表达晚期胃癌一线治疗的舞台[12]。
在靶向HER2的胃癌精准靶向治疗道路上,虽然曾经有过沉寂和消沉,但这条路重新生花后,前路漫漫,未来可期。
靶向联合免疫——1+1≥2
随着免疫治疗时代的到来,免疫治疗在晚期胃癌治疗中的地位逐渐加重。而对于HER2阳性的晚期胃癌患者而言,在已有的HER2靶向治疗中加入免疫治疗是否能够获得更好的生存获益?KEYNOTE-811作为首个双盲、III期临床研究探讨帕博利珠单抗联合曲妥珠单抗和化疗对HER2阳性不可切除或转移性G/GEJ癌的疗效与安全性帮助我们回答了这个问题。2024年ESMO大会公布的最终OS结果,化靶免联合治疗在总体人群中都有明显获益,mPFS从8.1个月提高10.0个月(HR 0.73,95%CI 0.61~0.87),mOS从16.8个月延长到了20.0个月(HR 0.80,95%CI 0.67~0.94)。值得一提的是,亚组分析显示PD-L1 CPS≥1的人群中生存改善更为显著,mOS延长至20.1个月(对照组15.7个月,HR 0.79,95%CI 0.66~0.95)[13]。由此奠定了化疗+靶向+免疫治疗在HER2阳性晚期胃癌患者一线治疗中的地位。近年来有多项研究都以此为模版,将不同药物进行排列组合。刘联教授的RCTS研究就是将RC48与替雷利珠单抗和S-1组合,一线治疗HER2过表达的晚期胃癌患者的ORR高达94.3%,1年PFS率为71.8%,1年OS率为97.6%,表现出了超高的疾病控制率和治疗有效率,同时亚组分析中对HER2低表达或PD-L1低表达的患者亦同样有效,安全性也可控[12]。DESTINY-Gastric 03研究则评估了DS-8201联合帕博利珠单抗和化疗(顺铂+卡培他滨)在晚期胃癌一线治疗中的疗效,联合用药的ORR可达到58%,但全剂量组合的耐受性较差,安全性令人稍有担忧[14]。由此,我们认为对于晚期HER2阳性胃癌患者,靶向HER2治疗联合免疫治疗能一定程度上得到1+1≥2的治疗效果,但在药物的选择上还需慎重和谨慎评估。
加法还是减法?
正如DESTINY-Gastric 03研究提示的那样,对于HER2阳性晚期胃癌,靶向HER2联合免疫和化疗的三联方案在一线治疗中取得了可观的疗效,但安全性和耐受性是令人担忧的问题。既往的基础研究提示RC48可以重塑HER2阳性人群的免疫微环境,与PD-1抗体联合用药可以提高ORR[15];此外,还可以和曲妥珠单抗联用通过表位互补增强肿瘤药物的渗透,提高疗效[16]。由北京大学肿瘤医院沈琳教授团队开展的这项研究设计了两项平行试验,针对不同HER2表达水平的患者进行不同一线治疗方案的探索。对于传统HER2阳性的晚期胃癌人群,评估RC48联合特瑞普利单抗和CAPOX(EG1)这一标准化靶免三联方案的疗效;此外,结合曲妥珠单抗与RC48的互补效应,设计了RC48联合曲妥珠单抗和特瑞普利单抗,这一“去化疗”化的靶靶免三联方案(EG2),初步结果显示靶靶免三联方案(EG2)展现出了优异的ORR,达到82.4%,显著高于传统化靶免三联方案(EG1 66.7%,CG1 68.6%),且PFS也有显著延长。这一结果对传统的化靶免三联方案提出了挑战,对于HER2阳性的晚期胃癌患者,“去化疗”化的“靶靶免”三联方案不仅可以提高疗效,还在一定程度上提高治疗耐受性和安全可控性,可能是未来治疗的新选择,为今后这类患者治疗过程中药物选择的排兵布阵提供了新的思路。
而对于HER2低表达的人群队列,第一阶段证实了RC48+特瑞普利单抗+CAPOX 这一化靶免三联四药方案的疗效,ORR达到72.%,显著高于对照组化疗联合免疫的47.8%,mPFS也从7.2个月提高到9.9个月(HR 0.69)。再次基础上。在第二阶段进行了化疗药物及靶向药物剂量的优化探索以期提高安全性和耐受性,结果显示在DV剂量不变的情况下,对CAPOX方案进行减量后,其ORR仍能达到71.4.%,中位PFS尚不成熟,而安全性基本可控。这一结果给既往认为不适合接受HER2靶向治疗的人群开辟了新的治疗方向,化靶免联合用药方案亦可改善这些HER2低表达的胃癌患者生存预后,为他们的治疗选择提供了新的思路。
这项研究在RC48对HER2阳性和低表达患者均有疗效的基础上,根据不同HER2表达水平进行不同治疗的组合排列、优化减量,从而使得不同人群均得到生存获益。对HER2阳性晚期胃癌患者在“去化疗”化治疗模式的探索中提供了坚实的基础和新的思路;对HER2低表达晚期胃癌患者的精准联合治疗提供了新的方向,拓展了HER2靶向治疗的潜在收益人群。
蔡世荣教授——中山大学附属第一医院
钱焱医生所解读的这篇摘要主要针对维迪西妥单抗联合特瑞普利单抗和化疗/曲妥珠单抗一线治疗HER2表达局部进展或转移性胃癌的研究。本研究根据HER2不同表达水平设计不同队列进行,结果显示了维迪西妥单抗联合特瑞普利单抗和化疗/曲妥珠单抗对HER2阳性及中低表达的晚期胃癌患者均有一定效果,拓展了HER2靶向治疗的潜在收益人群,并在安全性方面进行了剂量的探索优化。钱医生的解读从HER2靶向治疗到靶向联合免疫治疗,再到靶向、免疫、化疗之间排兵布阵探索娓娓道来,逻辑清晰,观点明确,知识点全面,充分掌握了目前对于靶向HER2在胃癌治疗中的临床热点与难点。
【温馨提示】:如果您觉得钱焱医生解读得好,请在下方为她点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
1.Bang YJ, Van Cutsem E, Feyereislova A, Chung HC, Shen L, Sawaki A, Lordick F, Ohtsu A, Omuro Y, Satoh T, et al: Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet 2010, 376:687-697.
2. Tabernero J, Hoff PM, Shen L, Ohtsu A, Shah MA, Cheng K, Song C, Wu H, Eng-Wong J, Kim K, Kang YK: Pertuzumab plus trastuzumab and chemotherapy for HER2-positive metastatic gastric or gastro-oesophageal junction cancer (JACOB): final analysis of a double-blind, randomised, placebo-controlled phase 3 study. Lancet Oncol 2018, 19:1372-1384.
3. Iqbal S, Goldman B, Fenoglio-Preiser CM, Lenz HJ, Zhang W, Danenberg KD, Shibata SI, Blanke CD: Southwest Oncology Group study S0413: a phase II trial of lapatinib (GW572016) as first-line therapy in patients with advanced or metastatic gastric cancer. Ann Oncol 2011, 22:2610-2615.
4. Jhaveri KL, Wang XV, Makker V, Luoh SW, Mitchell EP, Zwiebel JA, Sharon E, Gray RJ, Li S, McShane LM, et al: Ado-trastuzumab emtansine (T-DM1) in patients with HER2-amplified tumors excluding breast and gastric/gastroesophageal junction (GEJ) adenocarcinomas: results from the NCI-MATCH trial (EAY131) subprotocol Q. Ann Oncol 2019, 30:1821-1830.
5. Shitara K, Bang YJ, Iwasa S, Sugimoto N, Ryu MH, Sakai D, Chung HC, Kawakami H, Yabusaki H, Sakamoto Y, et al: Trastuzumab deruxtecan in HER2-positive advanced gastric cancer: exploratory biomarker analysis of the randomized, phase 2 DESTINY-Gastric01 trial. Nat Med 2024, 30:1933-1942.
6. Van Cutsem E, di Bartolomeo M, Smyth E, Chau I, Park H, Siena S, Lonardi S, Wainberg ZA, Ajani J, Chao J, et al: Trastuzumab deruxtecan in patients in the USA and Europe with HER2-positive advanced gastric or gastroesophageal junction cancer with disease progression on or after a trastuzumab-containing regimen (DESTINY-Gastric02): primary and updated analyses from a single-arm, phase 2 study. Lancet Oncol 2023, 24:744-756.
7. Deeks ED: Disitamab Vedotin: First Approval. Drugs 2021, 81:1929-1935.
8. Shi F, Liu Y, Zhou X, Shen P, Xue R, Zhang M: Disitamab vedotin: a novel antibody-drug conjugates for cancer therapy. Drug Deliv 2022, 29:1335-1344.
9. Peng Z, Liu T, Wei J, Wang A, He Y, Yang L, Zhang X, Fan N, Luo S, Li Z, et al: Efficacy and safety of a novel anti-HER2 therapeutic antibody RC48 in patients with HER2-overexpressing, locally advanced or metastatic gastric or gastroesophageal junction cancer: a single-arm phase II study. Cancer Commun (Lond) 2021, 41:1173-1182.
10. Meric-Bernstam F, Johnson AM, Dumbrava EEI, Raghav K, Balaji K, Bhatt M, Murthy RK, Rodon J, Piha-Paul SA: Advances in HER2-Targeted Therapy: Novel Agents and Opportunities Beyond Breast and Gastric Cancer. Clin Cancer Res 2019, 25:2033-2041.
11. Wang Y, Gong J, Wang A, Wei J, Peng Z, Wang X, Zhou J, Qi C, Liu D, Li J, et al: Disitamab vedotin (RC48) plus toripalimab for HER2-expressing advanced gastric or gastroesophageal junction and other solid tumours: a multicentre, open label, dose escalation and expansion phase 1 trial. EClinicalMedicine 2024, 68:102415.
12. Sun JCLWLLBLD: Efficacy and safety of disitamab vedotin (RC48) combined with camrelizumab and S-1 for neoadjuvant therapy of locally advanced gastric cancer with HER2 overexpression: Preliminary results of a prospective, single-arm, phase II study. Journal of Clinical Oncology 2024, 42:e16100
13. Janjigian YY, Kawazoe A, Bai Y, Xu J, Lonardi S, Metges JP, Yanez P, Wyrwicz LS, Shen L, Ostapenko Y, et al: Pembrolizumab plus trastuzumab and chemotherapy for HER2-positive gastric or gastro-oesophageal junction adenocarcinoma: interim analyses from the phase 3 KEYNOTE-811 randomised placebo-controlled trial. Lancet 2023, 402:2197-2208.
14. Janjigian YY: Trastuzumab deruxtecan (T-DXd) monotherapy and combinations in patients (pts) with advanced/metastatic HER2-positive (HER2+) esophageal, gastric or gastroesophageal junction adenocarcinoma (GEJA): DESTINY-Gastric03 (DG-03). 2024 ESMO 2024, 1400O.
15. Huang L, Wang R, Xie K, Zhang J, Tao F, Pi C, Feng Y, Gu H, Fang J: A HER2 target antibody drug conjugate combined with anti-PD-(L)1 treatment eliminates hHER2+ tumors in hPD-1 transgenic mouse model and contributes immune memory formation. Breast Cancer Res Treat 2022, 191:51-61.
16. Chen Z, Yuan J, Xu Y, Zhang C, Li Z, Gong J, Li Y, Shen L, Gao J: From AVATAR Mice to Patients: RC48-ADC Exerted Promising Efficacy in Advanced Gastric Cancer With HER2 Expression. Front Pharmacol 2021, 12:757994.











 苏公网安备32059002004080号
苏公网安备32059002004080号


