北京协和医学院优秀毕业生
主持中国博士后科学基金面上项目,浙江省博士后科研项目择优资助,浙江省医药卫生科技计划项目
以一作或通讯作者发表SCI多篇
Cancer Drug Resistance、Artificial Intelligence Surgery等杂志青年编委
International Journal of Surgery、British journal of Surgery等杂志审稿人
ASCO2025 解读文献
S1900E: A phase II study examining impact of co-mutations on sotorasib for previously treated stage IV/recurrent KRAS G12C mutated (MUT) non-squamous (Non-sq) non-small cell lung cancer (NSCLC) (ECOG-ACRIN led Lung-MAP Substudy).
S1900E:一项评估共突变对索托拉西布治疗既往接受治疗的IV期/复发性KRAS G12C突变非鳞非小细胞肺癌(NSCLC)患者疗效影响的II期研究(由ECOG-ACRIN主导的Lung-MAP子研究)
摘要
研究背景
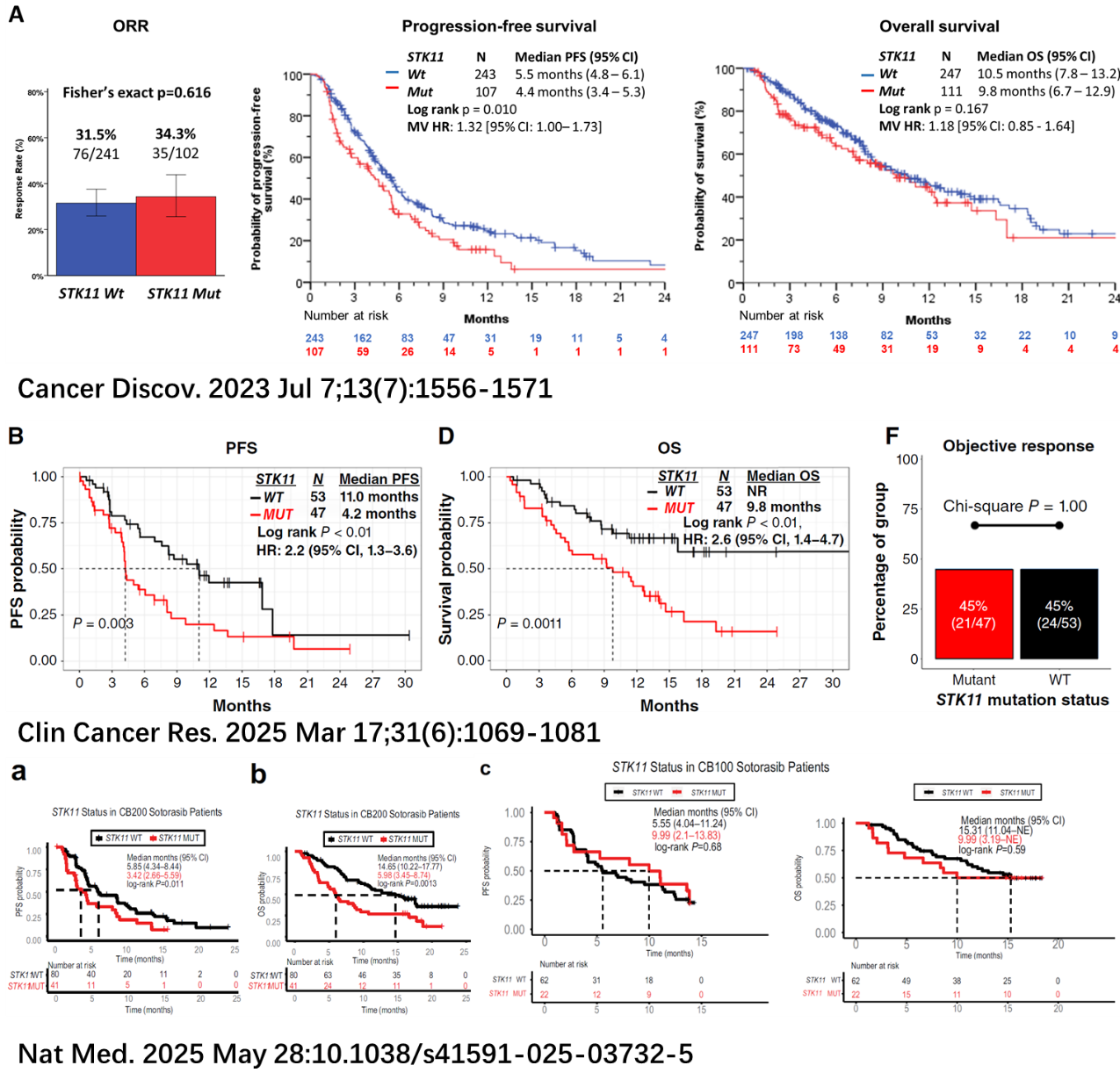
在既往治疗过的KRAS G12C突变非小细胞肺癌(NSCLC)中,异构性KRAS G12C抑制剂索托拉西布(sotorasib)相较于多西他赛(docetaxel)具有更优的疗效(客观缓解率[ORR]为28%,对比13%)。S1900E研究首次按抑癌基因(如TP53、STK11和KEAP1)共突变情况,前瞻性评估了索托拉西布在KRAS G12C突变NSCLC中的疗效。我们在此报告S1900E中TP53和STK11共突变队列的研究结果,并提出假设:共突变不会影响索托拉西布的疗效。
研究方法
在LUNGMAP筛查主协议中,经FoundationOne CDx组织检测确认KRAS G12C突变的患者被纳入S1900E研究。符合条件的患者需为IV期或复发的非鳞状NSCLC,且在接受过≥1线的全身治疗后出现疾病进展,ECOG体能状态评分为0-1。研究设置了3个生物标志物队列:
1)TP53共突变,STK11、KEAP1/NFE2L2/CUL3野生型;
2)STK11共突变,TP53、KEAP1/NFE2L2/CUL3野生型;
3)其他所有类型。
研究的主要目标是评估每个队列中按照RECIST 1.1标准确认的客观缓解率(ORR)。队列1和2的目标入组人数分别为40和25名可评估患者,基于单阶段二项设计,在单侧5%显著性水平下,具有90%的效能以排除14%的ORR(历史二线多西他赛的ORR)。
研究结果
S1900E研究已完成入组,2021年4月至2024年12月间共纳入118名患者,其中103名为可评估患者;59人(57%)为女性,86人(84%)为非西班牙裔白人。在TP53共突变队列(N=48,可评估40人)和STK11共突变队列(N=28,可评估25人)中,分别有48%和68%的患者仅接受过一线治疗,70%和76%接受过铂类化疗联合PD-(L)1免疫治疗,女性比例为68%和24%,PD-L1表达情况(≥1% / ≥50%)分别为95%/45%和43%/0%,几乎所有患者均有吸烟史。
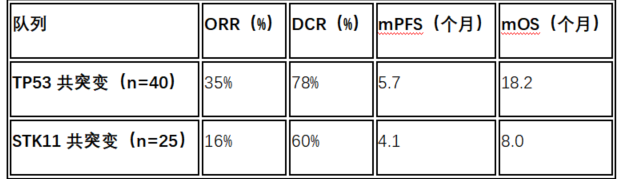
TP53共突变队列的ORR为35%(置信区间23%–47%);STK11共突变队列的ORR为16%(置信区间4%–28%)。疾病控制率(DCR)、缓解持续时间(DOR)、研究者评估的无进展生存期(PFS)和总生存期(OS)在TP53共突变队列中均数值较高(图1-3)。≥3级不良事件发生率与既往索托拉西布单药研究相似。
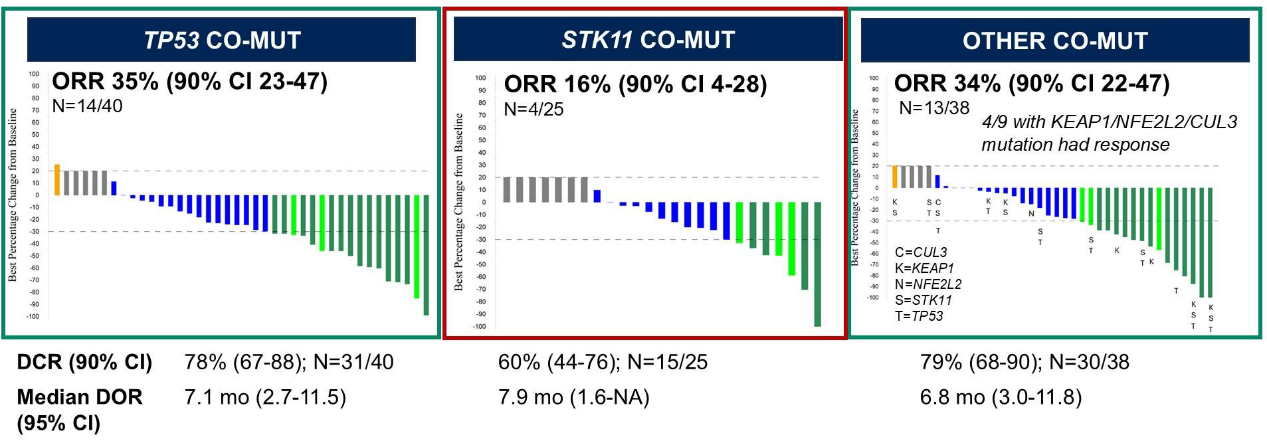
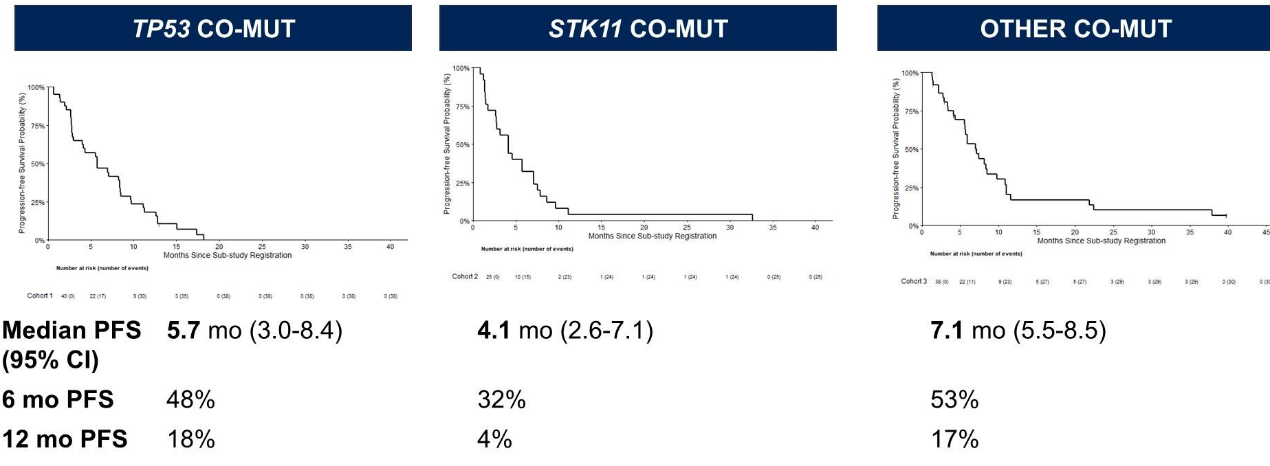
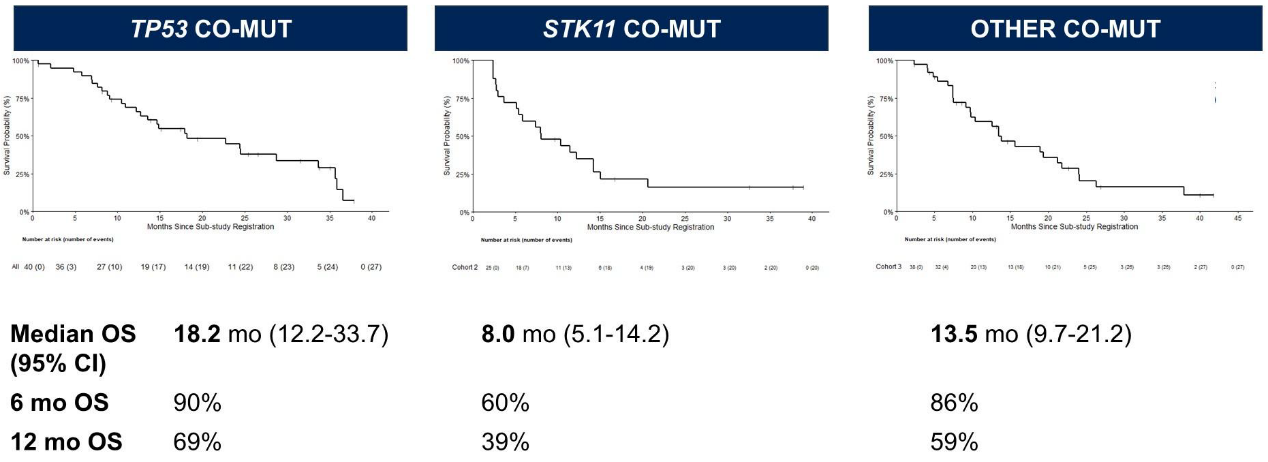
研究结论
TP53共突变队列达到了主要研究终点,而STK11共突变队列未能达到,提示在KRAS G12C突变NSCLC中,STK11共突变可能对索托拉西布疗效产生不利影响。S1900E的第3队列(可能包括KEAP1/NFE2L2及其他共突变)和通过ctDNA分析识别的耐药机制将在后续报告中公布。
解读境
KRAS G12C 突变是非鳞(Non-sq)非小细胞肺癌(NSCLC)中最常见的致癌驱动事件之一,针对该突变开发的共价抑制剂如 sotorasib 与 adagrasib 已获得FDA批准并广泛应用于既往治疗失败的患者中 [1, 2]。然而,尽管总体客观缓解率(ORR)约为28%-40%,不同患者间的疗效差异显著,共突变状态、转录组特征与肿瘤微环境异质性被认为是影响KRAS G12C疗效的重要因素 [3-5]。
S1900E作为ECOG-ACRIN主导的Lung-MAP子研究,是首项前瞻性按共突变进行分层的KRAS G12C抑制剂临床研究,探索STK11与TP53两类关键共突变是否会影响sotorasib的疗效,并为精准人群识别提供证据基础 [6]。
本研究纳入既往接受≥1线治疗的IV期或复发性KRAS G12C突变非鳞NSCLC患者,采用FoundationOne CDx进行基因分型,按共突变状态分为三组:①Cohort 1(TP53共突变):TP53突变,STK11/KEAP1/NFE2L2/CUL3野生型;②Cohort 2(STK11共突变):STK11突变,TP53/KEAP1/NFE2L2/CUL3野生型;③Cohort 3(其他共突变):含KEAP1或NFE2L2突变(数据待公布)。主要终点为RECIST v1.1下的客观缓解率(ORR),次要终点包括疾病控制率(DCR)、缓解持续时间(DOR)、无进展生存期(PFS)和总生存期(OS)。
截至2024年12月,共纳入103例可评估患者:
其中,TP53共突变组达到了主要终点,显示sotorasib在该人群中具有明确疗效;STK11共突变组未达终点,ORR仅为16%,显示该突变可能与不良疗效相关;不良事件谱与既往sotorasib研究一致,安全性可控。
在多项发表于Nature Medicine [5]、Cancer Discovery [3]和Clinical Cancer Research [4]的研究明确了共突变对KRAS G12C抑制剂疗效影响的背景下,S1900E研究的结果为进一步认识共突变的临床意义提供了前瞻性证据,现做如下解读:
STK11共突变作用的再思考:预后还是预测?
(1)发表于Nature Medicine、Cancer Discovery、Clinical Cancer Research的三项研究均未显示STK11共突变显著影响KRAS G12C的ORR,但一致认为其与PFS/OS缩短相关,提示其作用可能更偏向预后标志物而非疗效预测因子(图4);
(2)S1900E中,STK11组ORR下降明显(16%),或提示该突变在某些临床亚群中亦可表现出预测负效应,但仍需进一步前瞻性验证(如联合KEAP1或TTF-1状态分层分析);
转录组亚型较基因突变更能揭示疗效异质性
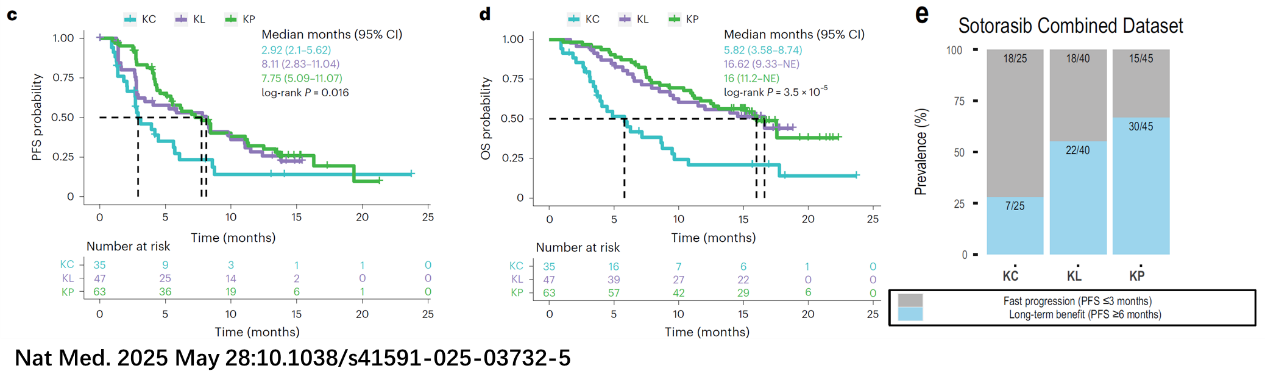
(1)Nature Medicine上的研究强调KRAS G12C突变的NSCLC存在KC、KL、KP三种转录亚型,其中KP亚型(TP53共突变)的疗效最佳;KC亚型(TTF-1低、CDKN2A/B缺失)的疗效最差(图5);
(2)S1900E中TP53共突变组疗效优于STK11共突变组,与KP亚型疗效最好的结论一致,提示转录亚型可能较单一突变状态更准确反映KRAS突变NSCLC的分子分层与治疗响应特征,这与既往研究报道一致 [7, 8]。
KEAP1/NRF2信号活化是稳定的不良预测因子
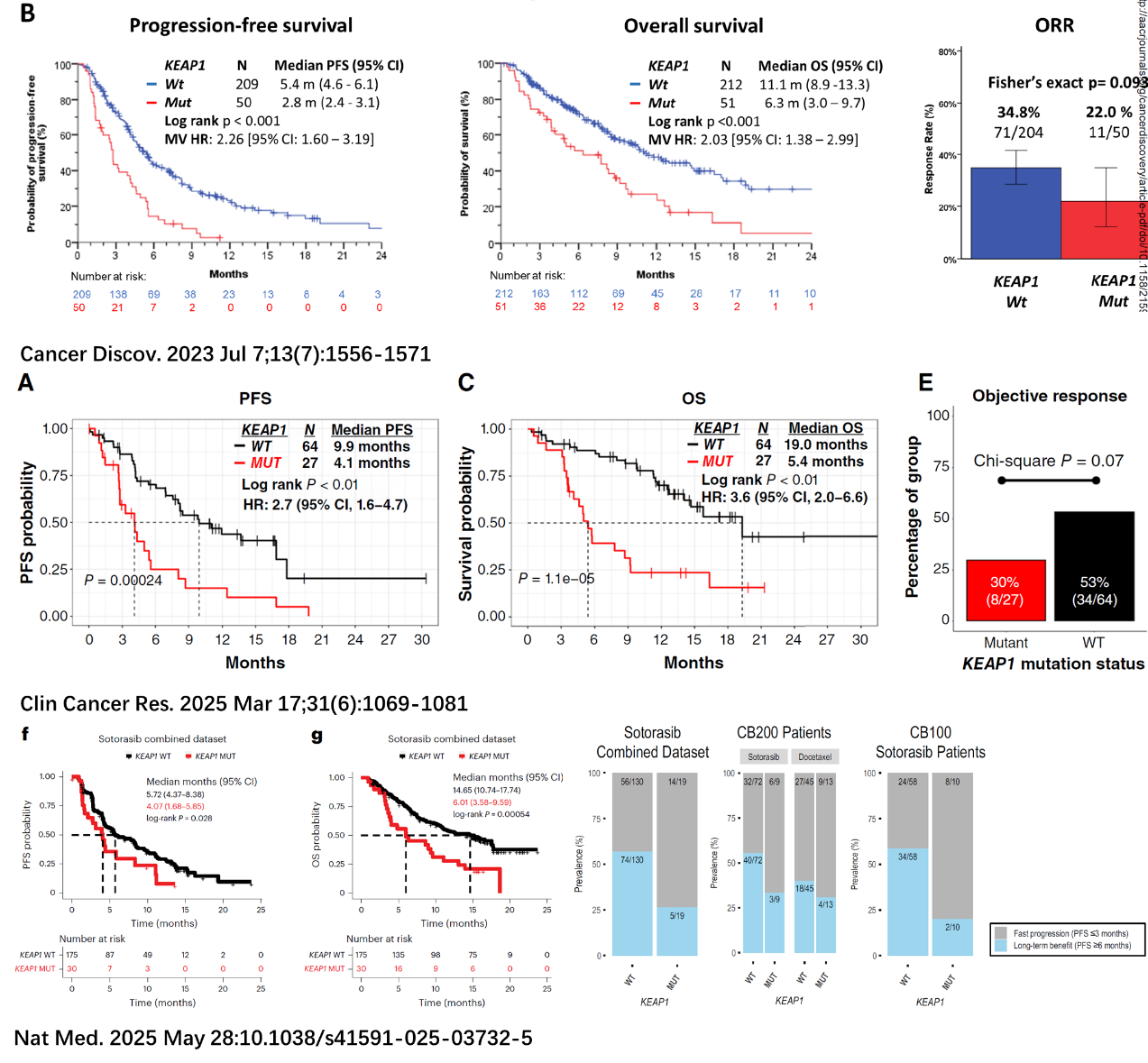
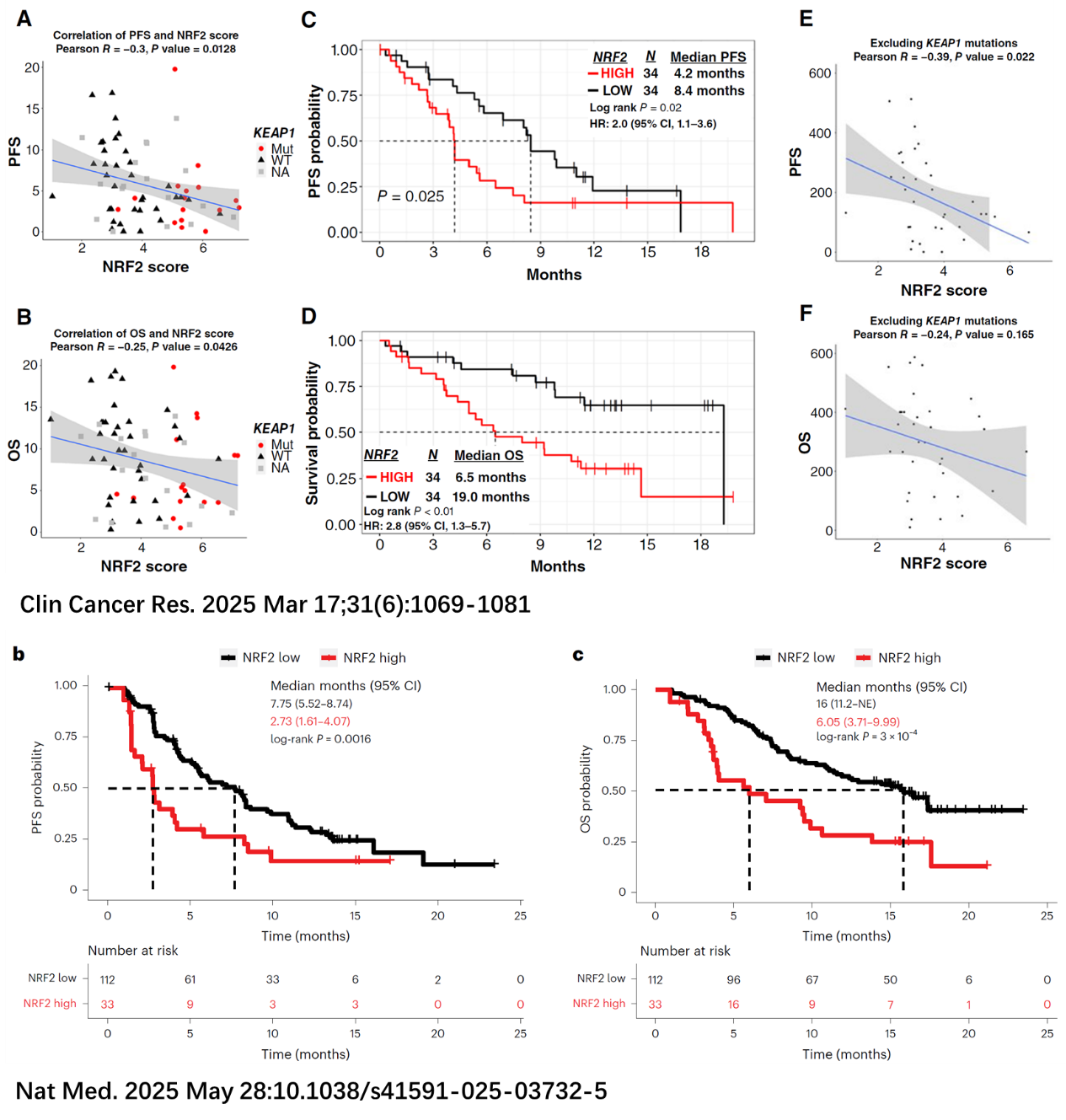
1) 三篇研究均明确指出:KEAP1突变(图6)或NRF2高表达(图7)与KRAS G12C抑制剂疗效差高度相关;
2) 即使KEAP1为野生型,NRF2高表达也能独立预测疗效差;
3) S1900E的Cohort 3(KEAP1/NFE2L2突变)数据尚未公布,预期将进一步验证其不良预后作用。
总而言之,S1900E研究作为首个基于共突变状态进行患者分层的前瞻性KRAS G12C抑制剂临床试验,为实现更精准的分子靶向治疗提供了重要依据,推动KRAS G12C抑制剂在NSCLC中的精准治疗迈入“分子亚组分治”的新阶段。结合发表在Nature Medicine、Cancer Discovery和Clinical Cancer Research上的三项关键研究成果,S1900E进一步验证并拓展了以下认识:①TP53突变患者对sotorasib具有良好反应,提示其可作为潜在的优选治疗人群;②STK11突变的预后或预测价值可能依赖于更复杂的分子背景,需结合其他特征进一步解析;③KEAP1/NRF2状态与疗效不良密切相关,支持其纳入KRAS G12C抑制剂疗效预测模型;④转录组亚型分类(如KP、KL、KC)更能反映KRAS突变NSCLC的生物学异质性,在患者分层中的潜力日益凸显;⑤研究结果也进一步推动探索以“RAS抑制剂为基础”的联合治疗策略,尤其是在STK11/KEAP1共突变患者中,联合mTOR抑制剂、免疫检查点抑制剂和化疗等方案值得重点关注。
曾剑教授——浙江省肿瘤医院
本次解读内容系统全面,紧扣S1900E研究设计及主要临床数据,条理清晰,逻辑严密。作者准确指出KRAS G12C突变非鳞NSCLC患者中,sotorasib在不同共突变状态下的疗效差异,尤其强调了TP53共突变患者群体疗效显著,STK11共突变患者反应相对较差,体现了精准分子分型对临床用药指导的重要意义。
在机制探讨部分,结合发表于Nature Medicine、Cancer Discovery及Clinical Cancer Research等杂志的多篇高水平文献,作者清晰区分了STK11作为预后标志物与预测因子的潜在角色,强调转录组亚型分类(KP、KC、KL)比单一基因突变更能反映治疗响应的异质性,进一步支持了KRAS G12C NSCLC的分子异质性视角。此外,对KEAP1/NRF2信号活化作为稳定不良预测因子的论述,既有数据支持也符合当前免疫肿瘤学研究热点,体现出解读的前瞻性与深度。
本解读不仅总结了S1900E研究的临床意义,还对未来联合用药策略(如mTOR抑制剂、免疫检查点抑制剂与化疗等)提出了建设性思考,具有较强的临床指导价值和研究启发意义。整体而言,本文观点明确、论据充分、行文流畅,是一篇兼具理论与实践价值的高质量解读报告。
【温馨提示】:如果您觉得李锋医生解读的好,请在下方为他点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
1.Jänne, P.A., et al., Adagrasib in Non-Small-Cell Lung Cancer Harboring a KRAS(G12C) Mutation. N Engl J Med, 2022. 387(2): p. 120-131.
2. Skoulidis, F., et al., Sotorasib for Lung Cancers with KRAS p.G12C Mutation. N Engl J Med, 2021. 384(25): p. 2371-2381.
3. Negrao, M.V., et al., Comutations and KRASG12C Inhibitor Efficacy in Advanced NSCLC. Cancer Discov, 2023. 13(7): p. 1556-1571.
4. Negrao, M.V., et al., Impact of Co-mutations and Transcriptional Signatures in Non-Small Cell Lung Cancer Patients Treated with Adagrasib in the KRYSTAL-1 Trial. Clin Cancer Res, 2025. 31(6): p. 1069-1081.
5. Skoulidis, F., et al., Molecular determinants of sotorasib clinical efficacy in KRAS(G12C)-mutated non-small-cell lung cancer. Nat Med, 2025.
6. Padda, S.K., et al., S1900E: A phase II study examining impact of co-mutations on sotorasib for previously treated stage IV/recurrent KRAS G12C mutated (MUT) non-squamous (Non-sq) non-small cell lung cancer (NSCLC)(ECOG-ACRIN led Lung-MAP Sub-study). 2025, American Society of Clinical Oncology.
7. Li, A., et al., STK11/LKB1-Deficient Phenotype Rather Than Mutation Diminishes Immunotherapy Efficacy and Represents STING/Type I Interferon/CD8(+) T-Cell Dysfunction in NSCLC. J Thorac Oncol, 2023. 18(12): p. 1714-1730.
8. Arolt, C., et al., KEAP1/NFE2L2 Pathway Signature Outperforms KEAP1/NFE2L2 Mutation Status and Reveals Alternative Pathway-Activating Mutations in NSCLC. J Thorac Oncol, 2023. 18(11): p. 1550-1567.











 苏公网安备32059002004080号
苏公网安备32059002004080号


