美国密歇根大学访问学者
美国密歇根大学The Abraham H. Grant Award获奖者
广东省肿瘤康复学会消化肿瘤内科专委会委员
主持国家自然科学青年基金项目、中国博士后面上项目,参与国家重大研究计划项目
ASCO2025 解读文献
LBA1解读:标准治疗联合或不联合阿替利珠单抗用于III期dMMR结肠癌患者的辅助治疗的随机试验(ATOMIC研究)
摘要
研究背景
III期结肠癌的标准辅助治疗化疗方案为氟尿嘧啶联合奥沙利铂。但对于III期dMMR结肠癌患者而言,免疫治疗联合化疗的辅助治疗的获益尚不可知。III期ATOMIC研究的开展旨在确定抗PD-L1单抗阿替利珠单抗联合标准mFOLFOX6(氟尿嘧啶+奥沙利铂)方案是否能进一步提高错配修复缺陷(dMMR)肠癌患者的生存。
研究方法
这是一项由美国国家癌症研究所(NCI)资助的多中心、随机III期临床试验,主要纳入术后III期结肠腺癌患者(任何T,N1或N2,M0)。当地免疫组化确定肿瘤MMR状态后会由中心再次确认。患者按 1∶1的比例随机分配至试验组mFOLFOX6 联合阿替利珠单抗(840mg 静脉注射,每2周一次)方案治疗 12 个周期(6个月),之后再接受阿替利珠单抗单药治疗13个周期(治疗时长共12个月),或对照组仅接受 mFOLFOX6 治疗12个周期组。随机分层因素包括N分期(N1/N1c vs N2)、T 分期(T1 ~ T3 vs T4)以及肿瘤部位(近端 vs 远端)。主要终点为无病生存期(DFS),次要终点为总生存期(OS)以及不良事件(AE)(CTCAE, PRO-CTCAE)。主要疗效分析在意向治疗人群中进行;通过分层log-rank检验比较各组DFS。风险比(HR)及 95% 置信区间(CI)由分层Cox模型计算;通过 Kaplan-Meier 法确定 3 年 DFS。在 700 例患者中,出现165 例 DFS 事件,在两次中期分析(分别达50%、75%的事件数)后,有90%的把握度检测到HR 0.6(3年DFS分别为75%、84.2%),假设生存情况呈指数分布,单侧显著性水平α为0.025。
研究结果
2017年9月至2023年1月,共712 例患者被随机分配至阿替利珠单抗联合 mFOLFOX6 组(n=355,阿替利珠单抗组)或mFOLFOX6 组(n=357)。患者中位年龄为 64 岁,55.1%为女性。肿瘤特征方面,83.8% 的肿瘤位于近端,46.1% 为临床低风险(T1~3N1),53.9% 属于高风险(T4 和/或 N2)。截至第二次中期分析,患者中位随访时间为37.2个月(四分位距 24.2~55.5月),DFS事件共计124例。阿替利珠单抗组的3年DFS为86.4%(95% CI,81.8%~89.9%),而mFOLFOX6组为76.6%(95% CI,71.3%~81.0%)(HR=0.50;95% CI 0.35~0.72)。分层log-rank检验P值小于0.0001,超过预定的 0.009有效性界限。阿替利珠单抗组在各亚组中的疗效具有一致性,包括年龄大于70岁的患者以及低风险和高风险组患者。安全性方面,阿替利珠单抗组中71.7%的患者出现治疗相关≥3级不良事件,而mFOLFOX6 组为62.1%。
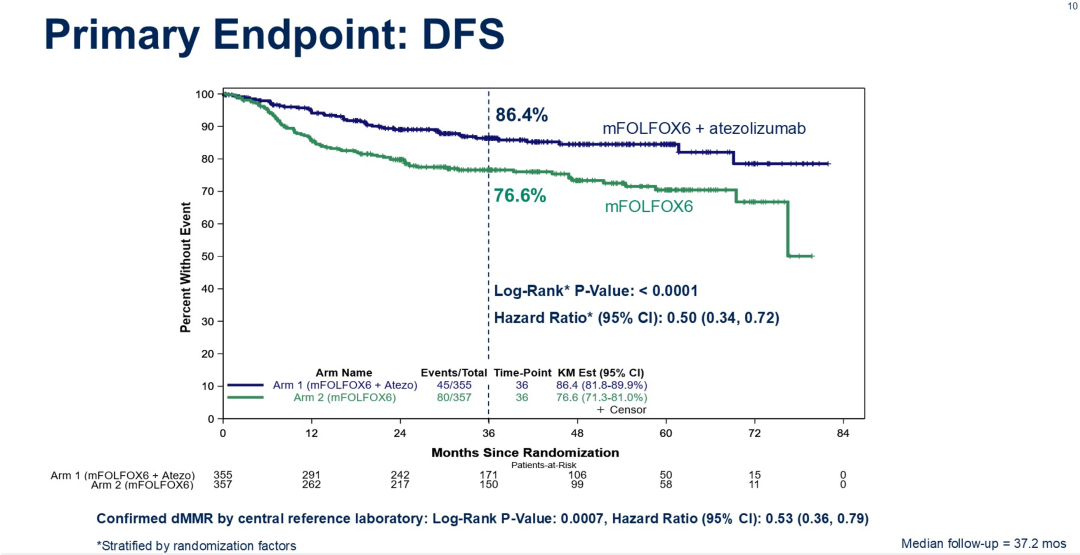
研究结论
阿替利珠单抗联合mFOLFOX6可显著改善DFS,这一免疫联合化疗方案有望成为III期dMMR结肠癌患者新的标准辅助治疗方案。
解读
术后免疫治疗:局部晚期dMMR肠癌的未问之境
错配修复缺陷(dMMR)的结肠癌是一类具有特殊分子特征的肿瘤类型,占局部晚期结肠癌的10%~15%左右。错配修复缺陷使得肿瘤细胞更容易产生高的突变负荷和免疫原性,从而导致免疫细胞浸润,对免疫治疗较为敏感[1]。然而,目前的临床指南对于III期dMMR结肠癌患者,术后标准治疗仍是传统化疗(XELOX或氟尿嘧啶类单药)。考虑到其独特的生物学特征,局部晚期dMMR结肠癌的免疫治疗探索是该领域的研究热点,对于术后免疫治疗能否为这类患者带来获益,仍是一个尚需探索的未问之境。
III期dMMR结肠癌辅助免疫治疗的重大突破
ATOMIC研究聚焦于评估术后辅助免疫治疗在III期dMMR结肠癌患者中的临床价值。研究结果显示,阿替利珠单抗联合mFOLFOX6的术后辅助治疗对比mFOLFOX6治疗,患者3年DFS率显著提升了10%,HR达到0.5,证实了免疫治疗的加入确实使更多患者获益。对比术后化疗的历史数据,ATOMIC研究在DFS的绝对获益值和HR值上均实现了显著的生存突破。因此,对于已接受手术切除的III期dMMR结肠癌患者,可以考虑阿替利珠联合标准化疗作为辅助治疗方案。
ATOMIC研究作为2025年ASCO大会的LBA重磅发布,备受瞩目,引发了学界的广泛关注和深入讨论。其研究结果不仅为III期dMMR结肠癌的辅助免疫治疗模式提供了高级别循证医学证据,更对临床实践有重要的指导意义,有望推动治疗的更新和优化。
ATOMIC研究与时代背景的碰撞
ATOMIC研究初次注册在2016年,在当时的研究环境下,其设计极具前瞻性,是术后免疫治疗的一次革新探索。然而,随着研究推进,结肠癌治疗领域取得了诸多进展,这些新成果与ATOMIC研究设计之间产生了一些“时代碰撞”。
IDEA研究结果于2017年首次公布,提示3个月的辅助化疗方案在低危患者中非劣效于传统的6个月方案[2]。这也让大家对ATOMIC研究中低危患者免疫联合6个月化疗是否有些过度产生了些许疑问。近来,晚期免疫治疗领域取得了显著进展,KEYNOTE-177、CheckMate 142、CheckMate 8HW研究逐步确立了免疫治疗在晚期dMMR结直肠中的核心地位[3-5]。此外,欧洲NICHE系列研究也初步成功地探索了免疫新辅助治疗在局部晚期dMMR结肠癌中的应用潜力[6]。笔者团队徐瑞华教授正在开展的III期NeoShot研究(NCT05890742)则进一步聚焦免疫单药对比免疫双药的新辅助治疗,旨在优化免疫新辅助方案。这些新数据的出炉都为局部晚期dMMR结肠癌的治疗带来了新的思考和挑战,凸显出更多的亟待解决的问题。
辅助免疫联合化疗是否为局部晚期dMMR肠癌患者治疗策略的最优解?
随着近年新辅助免疫治疗的不断探索,究竟是新辅助免疫治疗还是辅助免疫治疗会为局部晚期dMMR结肠癌患者带来更多临床获益,成为临床实践中亟需明确的问题。
NICHE-2研究结果显示,纳武利尤单抗联合伊匹木单抗的新辅助治疗方案在局部晚期dMMR结肠癌患者中取得了令人鼓舞的结果,病理完全缓解(pCR)率达67%,3年DFS率达到100%[6]。此外,NADINA研究[7]针对可切除III期黑色素瘤患者,对比了新辅助伊匹木单抗联合纳武利尤单抗治疗与辅助纳武利尤单抗治疗的疗效。结果显示,新辅助治疗组的12个月无事件生存(EFS)率为 83.7%,显著高于辅助治疗组的 57.2%,开启了黑色素瘤的免疫新辅助治疗的纪元。
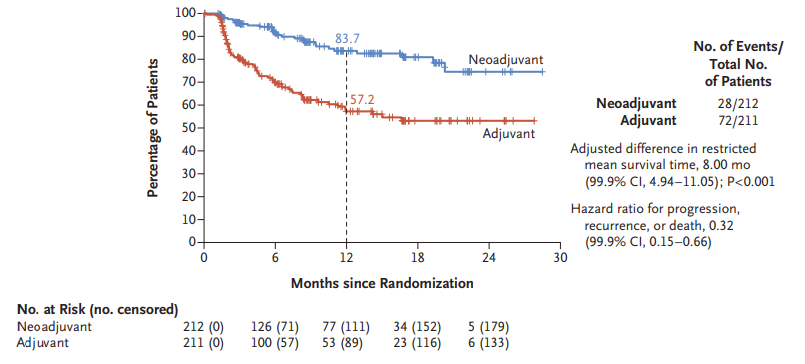
这些研究结果为III期dMMR结肠癌的治疗策略提供了重要启示,提示新辅助免疫治疗在该类肠癌患者中可能具有更显著的疗效优势。然而,需要注意的是,不同肿瘤类型之间存在生物学差异,黑色素瘤的研究结果不能直接外推至dMMR结肠癌,NICHE-2研究结果也无法直接与ATOMIC研究结果直接对比。目前尚缺乏比较新辅助免疫治疗与辅助免疫治疗在局部晚期dMMR结肠癌患者中的头对头研究,无法明确两个治疗时机在局部晚期dMMR结肠癌患者中究竟孰优孰劣。
在晚期dMMR肠癌中,免疫单药或双药已取得令人瞩目的疗效。那么,在局部晚期dMMR肠癌中最佳的用药方案究竟该如何?能否去化疗、双免是否优于单免等问题仍需通过更多的临床研究来回答。目前,一项国外的III期临床试验AZUR-2和中山大学肿瘤防治中心丁培荣教授正在开展的PACE研究(NCT05236972)针对III期dMMR结肠癌患者,探索信迪利单抗对比CAPOX(氟尿嘧啶+奥沙利铂)的疗效,未来或许可以为临床实践提供一些提示。最后,免疫治疗的最佳疗程也是未来研究的方向。需要确定最佳的疗程数以达到最佳疗效,同时避免过度治疗。这不仅有助于提高治疗效果,还可以降低治疗成本和减少治疗相关毒性。
总之,免疫治疗在局部晚期dMMR肠癌中展现出巨大潜力,但治疗策略优化仍需更多研究。未来通过进一步的临床试验探索,有望为局部晚期肠癌患者制定更个性化、精准化的治疗方案,提高治愈率和长期生存率,改善生活质量。
中山大学肿瘤防治中心-王峰教授
该解读剖析了ATOMIC 研究,肯定了免疫治疗联合化疗在术后辅助治疗中的价值和意义。同时,充分结合了局部晚期dMMR肠癌治疗现状与最新进展,客观指出研究设计的历史局限性,并围绕治疗时机、联合治疗方案等关键问题展开深入探讨,在dMMR肠癌治疗策略优化方面提出了一些深入的、有价值的临床思考。
【温馨提示】:如果您觉得何叶医生解读的好,请在下方为点她赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
1.Diaz LA, Jr., Le DT. PD-1 Blockade in Tumors with Mismatch-Repair Deficiency. N Engl J Med. 2015;373(20):1979.
2. Grothey A, Sobrero AF, Shields AF, et al. Duration of Adjuvant Chemotherapy for Stage III Colon Cancer. N Engl J Med. 2018;378(13):1177-1188.
3. Diaz LA, Jr., Shiu KK, Kim TW, et al. Pembrolizumab versus chemotherapy for microsatellite instability-high or mismatch repair-deficient metastatic colorectal cancer (KEYNOTE-177): final analysis of a randomised, open-label, phase 3 study. Lancet Oncol. 2022;23(5):659-670.
4. Andre T, Elez E, Van Cutsem E, et al. Nivolumab plus Ipilimumab in Microsatellite-Instability-High Metastatic Colorectal Cancer. N Engl J Med. 2024;391(21):2014-2026.
5. Lenz HJ, Van Cutsem E, Luisa Limon M, et al. First-Line Nivolumab Plus Low-Dose Ipilimumab for Microsatellite Instability-High/Mismatch Repair-Deficient Metastatic Colorectal Cancer: The Phase II CheckMate 142 Study. J Clin Oncol. 2022;40(2):161-170.
6. Chalabi M, Verschoor YL, Tan PB, et al. Neoadjuvant Immunotherapy in Locally Advanced Mismatch Repair-Deficient Colon Cancer. N Engl J Med. 2024;390(21):1949-1958.
7. Blank CU, Lucas MW, Scolyer RA, et al. Neoadjuvant Nivolumab and Ipilimumab in Resectable Stage III Melanoma. N Engl J Med. 2024;391(18):1696-1708.











 苏公网安备32059002004080号
苏公网安备32059002004080号


