德国杜伊斯堡-埃森大学附属医院 访问学者
主持国自然青年基金等科研、教学课题10项
以第一作者或通讯作者发表SCI论文12篇,教学论文2篇
以第一发明人或专利权人获批专利4项(转化1项)及软著1项
以第一作者在2025年ASCO学术年会壁报交流,2024年CSCO学术年会口头汇报
领域贡献:1. 临床:首次提出基于人工智能技术的PSI治疗模式(2024 CSCO),设计并开发一款基于PSI治疗模式的临床决策系统;验证西妥昔单抗联合卡培他滨的新维持治疗方案,第一作者发表在JAMA子刊并改写CSCO指南;2. 科研:首次提出肿瘤微环境IEO时间异质性(第一作者)和MCIB空间异质性(通讯作者)模型;提出“理论肿瘤学”概念(2025 ASCO),为肿瘤学从精准医学向人工智能医学发展提供理论基础;3. 教学:国内首次提出医学教学研究标准化理论模型(第一作者)以及RTCi(临床、教学、科研三位一体)教学模式(通讯作者)。
ASCO2025 解读文献
LBA3502
Anlotinib versus bevacizumab added to standard first-line chemotherapy among patients with RAS/BRAF wild-type, unresectable metastatic colorectal cancer: A multicenter, prospective, randomised, phase 3 clinical trial (ANCHOR trial).
LBA3502:安罗替尼对比贝伐珠单抗联合标准一线化疗用于RAS/BRAF野生型、不可切除转移性结直肠癌患者的多中心、前瞻性、随机Ⅲ期临床试验(ANCHOR研究)

摘要
研究背景
抗VEGF抗体联合化疗仍是不可切除的转移性结直肠癌(mCRC)的一线治疗方案,但目前缺乏针对口服VEGFR-TKI联合化疗在此类患者中应用的Ⅲ期随机对照试验。
研究方法
ANCHOR研究是一项在中国开展的多中心、随机、非劣效性Ⅲ期临床试验。研究纳入了未经治疗的RAS/BRAF野生型、经多学科团队评估为不可切除转移的mCRC患者。患者按1∶1的比例随机分组到安罗替尼组(12mg,po qd,d1~14)或贝伐珠单抗(7.5mg/kg,ivdrip,d1)组,均联合奥沙利铂(130mg/m²,ivdrip,d1)和卡培他滨(安罗替尼组:850mg/m²;贝伐珠单抗组:1000mg/m²,po bid,d1~14),每3周为一个周期。在完成4~8个周期诱导治疗后,继续接受安罗替尼或贝伐珠单抗联合卡培他滨的维持治疗,直至疾病进展或出现不可耐受的毒性。分层因素包括肿瘤位置(右半/左半)等。主要终点是独立审查委员会(IRC)评估的无进展生存期(PFS),次要终点包括研究者评估的PFS、客观缓解率(ORR)、疾病控制率(DCR)、缓解持续时间(DoR)、总生存期(OS)、肝转移切除率和生活质量等。
研究结果
2021年5月25日至2023年8月30日间,共748例患者随机纳入意向治疗(ITT)人群,其中安罗替尼组373例,贝伐珠单抗组375例。患者的中位年龄为59.0岁,227例为女性。中位随访时间为25.10个月。IRC评估的中位PFS在安罗替尼组和贝伐珠单抗组分别为11.04个月(95% CI:9.82~11.17个月)和11.04个月(95% CI:9.69~11.17个月),风险比(HR)为1.00(95% CI:0.84~1.18)。安罗替尼组373例患者中有143例(38.34%)发生严重不良事件,贝伐珠单抗组375例患者中有129例(34.40%)发生严重不良事件。
研究结论
在不可切除的RAS/BRAF野生型mCRC患者中,安罗替尼联合卡培他滨和奥沙利铂(CapeOX)方案与贝伐珠单抗联合CapeOX方案相比,PFS和安全性无统计学差异。该研究为不可切除的RAS/BRAF野生型mCRC患者提供了一种新的一线治疗选择。
临床研究信息: NCT04854668,CTR20210940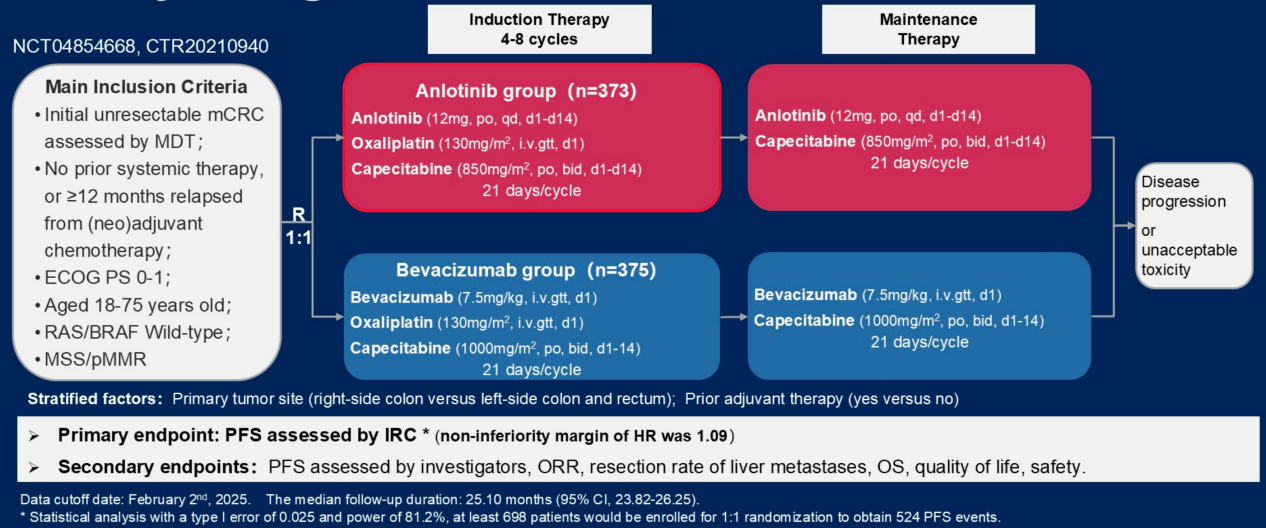
点评
一、ANCHOR研究的临床价值是什么?
ANCHOR研究是一项全球首个在不可切除的RAS/BRAF野生型mCRC患者中,对比安罗替尼联合CapeOX方案与贝伐珠单抗联合CapeOX方案的Ⅲ期非劣效性研究,由浙江大学医学院附属第二医院丁克峰教授团队开展[1]。在纳入的748例患者,结果显示两组中位PFS均为11.04个月,ORR、DCR、肝转移切除率无显著差异,安全性可控:两组TRAE和SAE发生率相似,生活质量(EQ-5D/QLQ-C30评分)无差异。该研究1.在治疗模式上创新:一线安罗替尼联合CapeOX之后采用全口服方案(安罗替尼+卡培他滨)在维持治疗阶段与静脉输注方案(贝伐珠单抗)疗效相当,使得维持治疗阶段由静脉+口服模式转变为全口服模式。2.在保证疗效(PFS、ORR、DCR、肝转移切除率)和安全性(TRAE和SAE)的前提上,由静注的贝伐珠单抗转变为口服安罗替尼,可以避免患者频繁进院,提升患者的依从性。
ANCHOR研究不仅证实了安罗替尼联合CapeOX在mCRC一线治疗中的疗效非劣于标准方案,更通过全口服维持治疗优化了治疗模式,为患者提供兼顾疗效与生活质量的“去静脉输注”新选择,这是mCRC治疗的重要里程碑。该方案的核心优势在于安罗替尼组患者因在维持治疗期间全口服给药减少进院(年均节省15~20次静脉输注),治疗便利性和依从性显著提高,尤其适合需长期维持治疗的患者。药物研发往往从有创到微创,微创到无创,无创到静注,静注到皮下,皮下到口服,口服到食疗预防,口服方案降低医疗资源占用、提升生活自由度,尤其适合需长期管理的晚期患者。提高用药便捷性是将肿瘤转为慢性化的必要基础。
二、 LBA3502研究结果分析
2025年ASCO年会上公布的ANCHOR研究(NCT04868708)是由浙江大学医学院附属第二医院丁克峰教授团队领衔的前瞻性、随机、多中心Ⅲ期临床试验。该研究聚焦于RAS/BRAF野生型不可切除mCRC的一线治疗,首次证明口服多靶点TKI安罗替尼联合CapeOX方案在疗效上非劣于标准治疗贝伐珠单抗联合CapeOX,同时显著提升治疗便捷性。主要终点是IRC评估的PFS,次要终点包括研究者评估的PFS、ORR、DCR、DoR、OS、肝转移切除率和生活质量等。ANCHOR研究纳入了未经治疗的RAS/BRAF野生型、经多学科团队评估为不可切除转移的mCRC患者。患者随机分配至安罗替尼+CapeOX组或贝伐珠单抗+CapeOX组,在完成4~8个诱导治疗周期后,患者继续接受安罗替尼或贝伐珠单抗联合卡培他滨的维持治疗,直至疾病进展或出现不可耐受的毒性(图1)。分层因素包括肿瘤位置(右侧/左侧)和既往辅助化疗(是/否)。研究设计在单侧α=0.025和81.2%的把握度下,需要524例患者出现PFS事件。
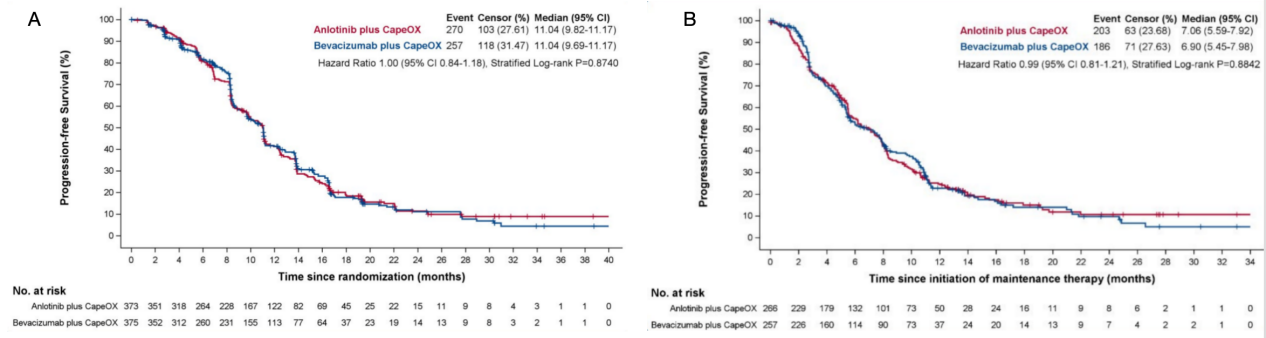
2021年5月25日至2023年8月30日期间纳入安罗替尼组373例,贝伐珠单抗组375例。IRC评估的中位PFS在安罗替尼组和贝伐珠单抗组分别为11.04个月(95% CI:9.82~11.17个月)和11.04个月(95% CI:9.69~11.17个月),风险比(HR)为1.00(95% CI:0.84~1.18)(图2A)。在维持治疗期间,安罗替尼组和贝伐珠单抗组分别为7.06个月(95% CI:5.59~7.92个月)和6.90个月(95% CI:5.45~7.98个月),HR为0.99(95% CI:0.81~1.21)(图2B)。

IRC评估的ORR值在安罗替尼组和贝伐珠单抗组分别为61.93%(95% CI:56.79%~66.88%)和62.13个月(95% CI:57.01~67.06个月),P=0.9487。DCR值在安罗替尼组和贝伐珠单抗组分别为92.76%(95% CI:89.64%~95.185)和93.07%(95% CI:90.01%~95.42%),P=0.8681。mDoR在安罗替尼组和贝伐珠单抗组分别为9.66个月(95% CI:8.31~9.99个月)和9.69个月(95% CI:8.48~11.01个月),HR为1.04(95% CI:0.84~1.27)。肝切除率在安罗替尼组和贝伐珠单抗组分别为3.75%和2.93%,P=0.5327。四个指标在安罗替尼组和贝伐珠单抗组间无统计学差异,安罗替尼组非劣效于贝伐珠单抗组(图3)。安罗替尼组373例患者中有143例(38.34%)发生严重不良事件,贝伐珠单抗组375例患者中有129例(34.40%)发生严重不良事件,两组未出现不可预知的药物不良反应。安罗替尼组在疗效和安全性上非劣效于贝伐珠单抗组。
三、安罗替尼对比贝伐珠单抗:分子机制与临床应用
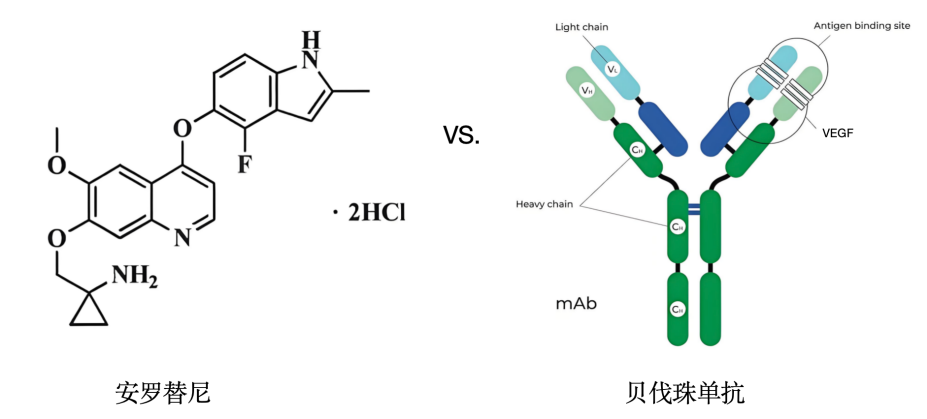
安罗替尼与贝伐珠单抗虽同属抗血管生成药物,但在分子结构和作用机制上存在显著差异。
3.1 基础情况对比
贝伐珠单抗为重组人源化单克隆抗体(大分子生物制剂)。特异性结合VEGF-A(血管内皮生长因子A),阻断其与受体VEGFR的结合,从而抑制VEGF/VEGFR信号通路。仅针对VEGF-A单一靶点,对PDGFR、FGFR等无直接抑制作用。安罗替尼为小分子多靶点酪氨酸激酶抑制剂(TKI)。同时抑制VEGFR1/2/3、PDGFR-α/β、FGFR1-4及c-Kit等受体。通过竞争性结合激酶ATP位点,阻断多条促血管生成通路,靶点范围更广(表1)[2-3]。
表1. 安罗替尼与贝伐珠单抗基础特征的差异。

3.2 作用机制差异
贝伐珠单抗的机制:①血管退化:促使现有异常血管退化,减少肿瘤血供。②抑制新生血管:阻断VEGF信号后,抑制内皮细胞增殖与迁移,减少新血管生成。③局限性:单靶点抑制易引发旁路激活(如PDGF/FGF通路代偿),会导致耐药发生。而安罗替尼的机制 ①多通路协同抑制:同步阻断VEGFR、PDGFR、FGFR三条主要通路,显著降低旁路激活风险。②双重抗肿瘤作用:抑制血管新生:降低内皮细胞增殖、迁移及微管形成能力。③直接干预肿瘤细胞:通过抑制c-Kit激酶,干扰肿瘤细胞增殖与存活。④血管正常化:改善肿瘤血管结构和功能,减少渗漏、缓解缺氧,提升化疗/靶向药物在瘤内分布[2-4]。
3.3 疗效与耐药性差异
作为多靶点酪氨酸激酶抑制剂(TKI),安罗替尼作用的分子机制为通过直接抑制多种受体酪氨酸激酶,有效阻断肿瘤血管生成信号通路,可同时靶向抑制多种与血管生成密切相关的受体酪氨酸激酶:VEGFR1/2/3:阻断血管内皮生长因子信号通路,抑制血管内皮细胞增殖和迁移,PDGFR-α/β:抑制周细胞招募和成熟血管形成,FGFR1~4:干扰血管重塑和稳定过程,这种多靶点协同抑制使安罗替尼能够更全面地阻断肿瘤血管生成信号网络,克服单一靶点抑制可能出现的代偿性激活。与单靶点抗血管生成药物如贝伐珠单抗(仅靶向VEGF-A)相比,安罗替尼具有更广泛的作用谱和更强的抗血管生成能力。贝伐珠单抗在结直肠癌一线治疗中易因缺氧诱导的代谢重编程(如乳酸介导的组蛋白乳酰化)产生耐药,而安罗替尼能实现多靶点特性延缓耐药[3-4] 。
表2. 安罗替尼与贝伐珠单抗在微环境干预上的分子机制差异。
3.4 给药方式、依从性 与联合治疗差异
贝伐珠单抗需静脉输注,安罗替尼为口服制剂,在维持治疗阶段优势显著(如ANCHOR研究中全口服方案PFS达7.06个月)。安罗替尼因促进血管正常化,更易与化疗、免疫治疗(如PD-1抑制剂)协同增效。贝伐珠单抗联合EGFR抑制剂时可能因通路串扰受限。贝伐珠单抗适用于需快速控制血管生成的晚期患者,但需警惕耐药及高血压、蛋白尿等不良反应。 安罗替尼更适合长期维持治疗(口服便利性),尤其适用于多线治疗失败或需联合免疫/靶向治疗的患者,其多靶点特性在抑制转移和逆转微环境抑制方面更具潜力(表2)[3-6] 。
四、治疗展望
尽管安罗替尼在结直肠癌治疗中已取得显著成果,以下研究方向仍需深入探索:
①circHAS2高表达亚组精准人群的探索:circHAS2的表达水平与安罗替尼治疗效果存在显著相关性:a. 高表达人群的显著获益; b. 治疗反应的早期预测:治疗过程中血清肿瘤标志物(CEA、CA125、CA19-9)的下降幅度与circHAS2表达水平呈正相关,可作为早期疗效预测指标;c. 分子分型指导治疗决策:约52.9%的结直肠癌病例呈现circHAS2高表达,这部分患者可能成为安罗替尼靶向治疗的理想人群,目前基于circHAS2表达水平的患者分层策略已被纳入多项前瞻性临床试验设计,有望为安罗替尼在结直肠癌的精准应用提供更高级别的循证医学证据。同时在耐药机制研究中,探索circHAS2非依赖性耐药通路,解决继发性耐药问题。
②联合治疗优化:a. 开展安罗替尼与免疫检查点抑制剂、EGFR抑制剂等的联合方案研究,寻找最佳配伍和用药时序; b. 双靶向阻断互补通路:与瑞戈非尼联用时,两者作用靶点互补,安罗替尼主要抑制VEGFR/FGFR/PDGFR,而瑞戈非尼还可靶向RAF通路,协同抑制血管增生。c. 逆转EGFR抑制剂耐药:对于EGFR突变型结直肠癌,安罗替尼可通过抑制替代血管生成通路,克服EGFR抑制剂耐药问题。
③其他:a. 生物标志物谱完善:除circHAS2外,寻找更多预测性生物标志物,建立多基因预测模型;b. 给药方案优化:探索间歇给药、剂量调整等策略,平衡疗效与安全性。
华中科技大学同济医学院附属同济医院-袁响林教授
ANCHOR研究是2025年ASCO大会LBA(最新突破摘要)之一,入选口头报告彰显中国肿瘤学研究国际影响力。本文对该研究的背景、方法以及结果和结论进行了深入且专业的解读,并在分子机制和临床应用上对安罗替尼和贝伐珠单抗两种抗血管生成的药物进行综合的剖析和对比,挖掘了ANCHOR研究中安罗替尼联合CapeOX应用于晚期一线RAS/BRAF野生型mCRC的临床价值以及全口服维持治疗方案更深远的疾病管理策略,最后对该方案的未来使用前景进行了展望。未来需进一步关注该研究OS数据成熟度,探索安罗替尼与免疫检查点抑制剂的联合策略,以及基于生物标志物的个体化用药与精准化应用。
【温馨提示】:如果您觉得王璐医生解读的好,请在下方为他点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
[1] Yue L, Ying Y, Yanqiao Z, et al. Anlotinib versus bevacizumab added to standard first-line chemotherapy among patients with RAS/BRAF wild-type, unresectable metastatic colorectal cancer: A multicenter, prospective, randomised, phase 3 clinical trial (ANCHOR trial). Journal of Clinical Oncology 2025 43:17_suppl, LBA3502.
[2] Yan M, Yang R, Li Q, et al. Anti-angiogenic and antitumor effects of anlotinib combined with bevacizumab for colorectal cancer [J]. Microelectronics Journal, 2024, 41.
[3] Song, Y, Liu, L, Min, J, et al. Efficacy and safety of anlotinib as a later-line treatment for advanced colorectal cancer. Journal of Clinical Oncology, 43(4_suppl), 194.
[4] Wang, M, Mao, M, Yonghua C, et al. Safety and efficacy of anlotinib hydrochloride capsules in advanced non-small-cell lung cancer: a multicenter, real-world study[J]. Future oncology, 19(25), 1729-1739.
[5] Yan M, Yang R, Li Q, et al. Anti-angiogenic and antitumor effects of anlotinib combined with bevacizumab for colorectal cancer [J].Translational Oncology, 2024, 41.
[6] Li H, Feng H, Zhang T, et al. CircHAS2 activates CCNE2 to promote cell proliferation and sensitizes the response of colorectal cancer to anlotinib. Mol Cancer. 2024;23(1):59.











 苏公网安备32059002004080号
苏公网安备32059002004080号


