随着新的瑞波西利联合NSAI用于广泛II-III期HR+/HER2-早期乳腺癌辅助治疗标准在适应症获得中国国家药品监督管理局(NMPA)批准并临床实践落地,引发了临床学者诸多思考。近日,欧洲肿瘤内科学会(ESMO)《肿瘤学年鉴》刊发了两则中日读者“来函”,探讨了NATELEE研究的对照组设计、终点、用药剂量等方面的实践意义1,2。众所周知,“来函”一般基于投稿人的观点、经验,主要价值在于引发思考,促进讨论,具有较强的交流特点,但无需经过同行评审流程。《孟子》云:“颂其诗,读其书,不知其人,可乎?是以论其世也。是尚友也”,即真正理解文本,必须结合作者生平(知其人)和时代环境(论其世)。对于临床研究的解读,也需贯彻“知人论世”的方法论,进而剖析其研究设计及影响,以期为临床实践带来更多思考。
本文将从以下几个方面进一步剖析NATALEE研究,论证其在乳腺癌诊疗领域的创新性、科学性、专业性及研究结果的突破性。
第一, 标准方案对照:从NATALEE研究入组开始到结束,研究设计完全立足于彼时的标准治疗方案,符合科学性要求,并获得了FDA、NMPA的批准实施。试验设计及结果具有划时代的革新意义
第二, 权威期刊发布:NATALEE研究iDFS事件数据均有明确披露公布,获益持续扩大并展现长期OS获益趋势。研究结果获得业界专家广泛认可,主要结果发表顶刊《新英格兰医学杂志》
第三, 科学剂量设计:瑞波西利400mg qd适合早期患者,是充分平衡疗效与安全性后的决策。剂量爬坡研究及AMALEE研究均可证明早期剂量的科学性与安全性,保障患者疗效安全双获益
时代革新,挑战标准方案
第一,NATALEE研究对照组为标准辅助治疗方案,试验设计具有时代革新意义。NATALEE研究为国际性、开放标签、随机、III期试验,主要针对II-III期HR+/HER2-乳腺癌患者,试验组使用瑞波西利+非甾体类芳香化酶抑制剂(NSAI),对照组使用NSAI治疗,覆盖美洲、欧洲、亚洲、大洋洲等387个中心,最终纳入了5101例患者。该研究在国际上于2018年12月7日正式入组首例患者,在中国于2020年6月23日入组首例患者3。
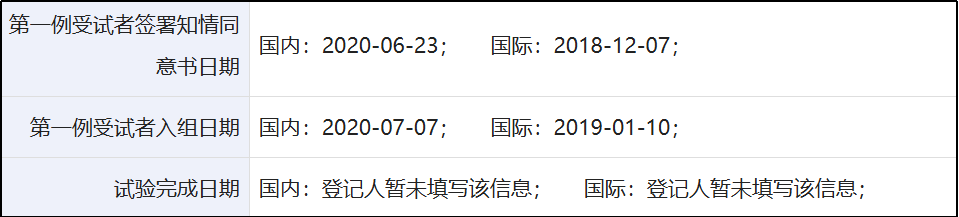
无论是试验开始的2018年,还是迟至中国首例受试者入组的2020年,彼时AI均是《NCCN指南2018v4》4、《CSCO BC指南2020》5推荐辅助治疗HR+/HER2-早期乳腺癌的标准方案。2021年4月20日,NATALEE研究的受试者入组完毕,该研究设计完全立足于彼时的标准治疗方案,符合科学性要求,并获得了FDA、NMPA的批准实施。

2022年,《NCCN指南 2022v1》首次推荐CDK4/6i作为高危HR+/HER2-早期乳腺癌的辅助治疗方案,但并未取消AI辅助治疗的标准方案8。该推荐意见中的人群与NATALEE研究入组标准有部分重叠但不完全匹配,NATALEE研究的覆盖人群较其更加广泛,覆盖了广泛的II-III期乳腺癌患者,并最终取得了阳性结果。因此,NATALEE研究对照组是在研究发起的年代下对比最为标准的治疗方案,且其结果具有划时代的革新意义。
iDFS获益,公认的OS替代终点
第二,NATALEE研究的iDFS获益获得广泛认可,长期生存获益值得期待。NATALEE研究的主要终点为iDFS。iDFS指乳腺癌治疗后无浸润性癌的生存期,是适用于乳腺癌更加精确的无病生存期(DFS)概念9,是几乎所有早期乳腺癌辅助治疗III期临床研究的通用主要终点。DFS(含iDFS)是国内外多个临床试验指导原则公认的临床研究终点。我国NMPA药品评审中心(CDE)在《抗肿瘤药物临床试验统计学设计指导原则》指出,DFS是衡量抗肿瘤药物临床获益的终点,多用于评价手术或放疗后的辅助治疗10。FDA肿瘤药物咨询委员会(ODAC)同样将DFS作为乳腺癌等多种癌种的研究终点,并指出DFS获益可能代表着更长的总生存期(OS)11。
2024年9月,NATALEE研究4年的Landmark分析结果在ESMO年会上以最新突破摘要(LBA)形式公布,进一步显示出该研究的学术地位与卓越成果。截至2024年4月29日,中位随访44.2个月的iDFS分析显示,iDFS为88.5% 和 83.6%,HR为0.715(0.609-0.840),降低ITT人群复发风险达28.5%,p<0.0001,获益绝对值提升至4.9%,为3年iDFS绝对获益(2.7%)2倍,呈现获益持续扩大的特点12。

此前,NATALEE研究3年数据显示,瑞波西利+NSAI vs NSAI的3年无复发生存率(RFS)为92.1% vs 89.1%,HR为0.727(0.602-0.877),P=0.0008,3年无远处转移生存率(DDFS)为92.9% vs 90.2%,HR为0.749(0.623-0.900),p=0.0020 13。此次4年数据显示瑞波西利+NSAI 的DDFS获益进一步扩大,HR为0.715(0.604-0.847),P<0.0001。
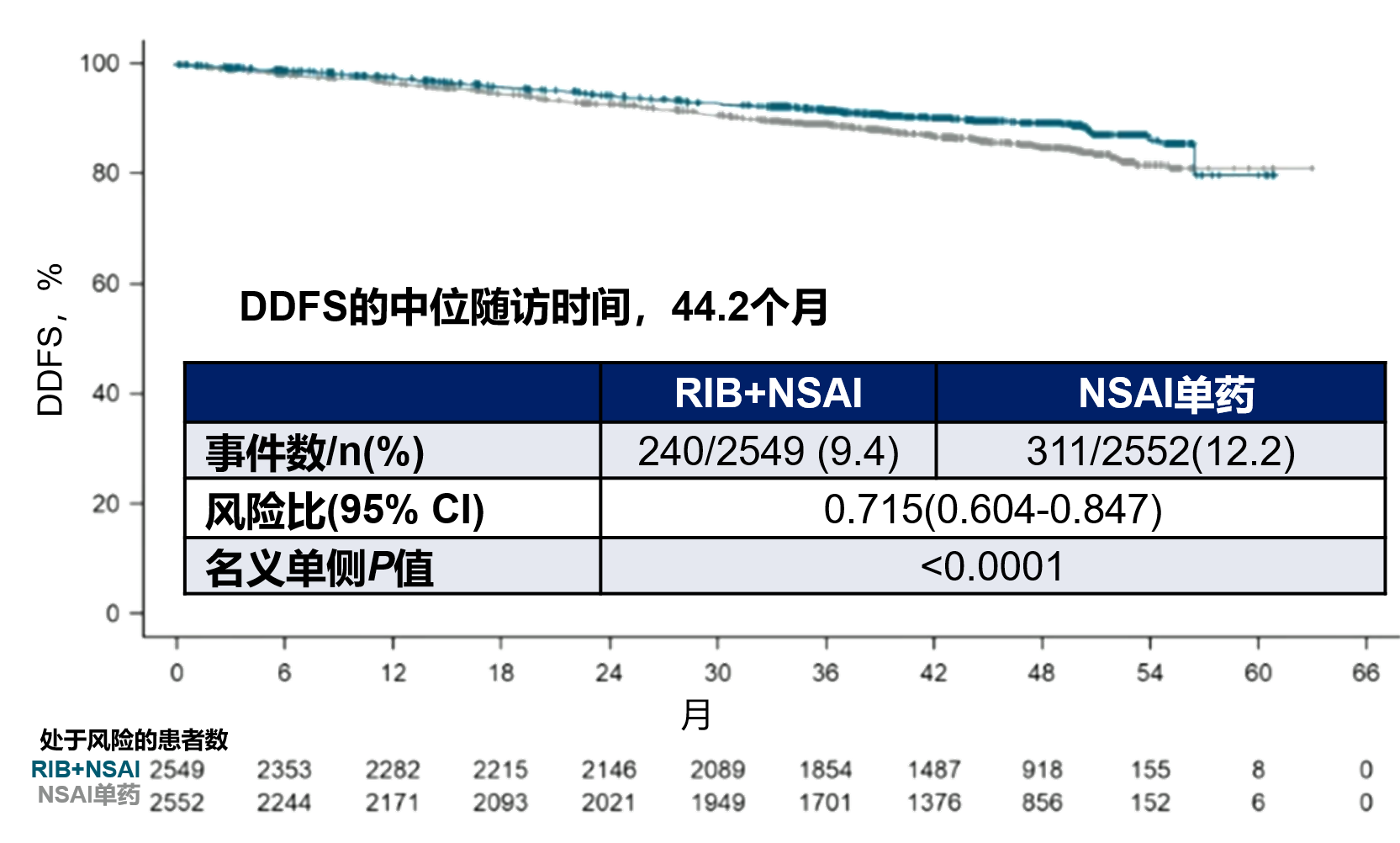
在所观察到的iDFS事件中,最主要的事件为远处复发转移,局部复发、死亡占比较低,且数据均有明确披露公布。在不同类型的iDFS事件的数值方面,瑞波西利+NSAI组均较NSAI具有发生率更低的趋势。在瑞波西利+NSAI取得iDFS获益的基础上,也展现了长期OS获益的趋势。

基于NATALEE研究,瑞波西利与芳香化酶抑制剂联合使用,作为激素受体(HR)阳性、人类表皮生长因子受体2(HER2)阴性高复发风险的早期乳腺癌患者的辅助治疗的适应症获得了NMPA、EMA、FDA批准,成为了国内外药品监管部门、行业协会及专家学者公认的HR+/HER2-早期乳腺癌辅助治疗新标准。
着眼长期获益,寻求更平衡的给药方案
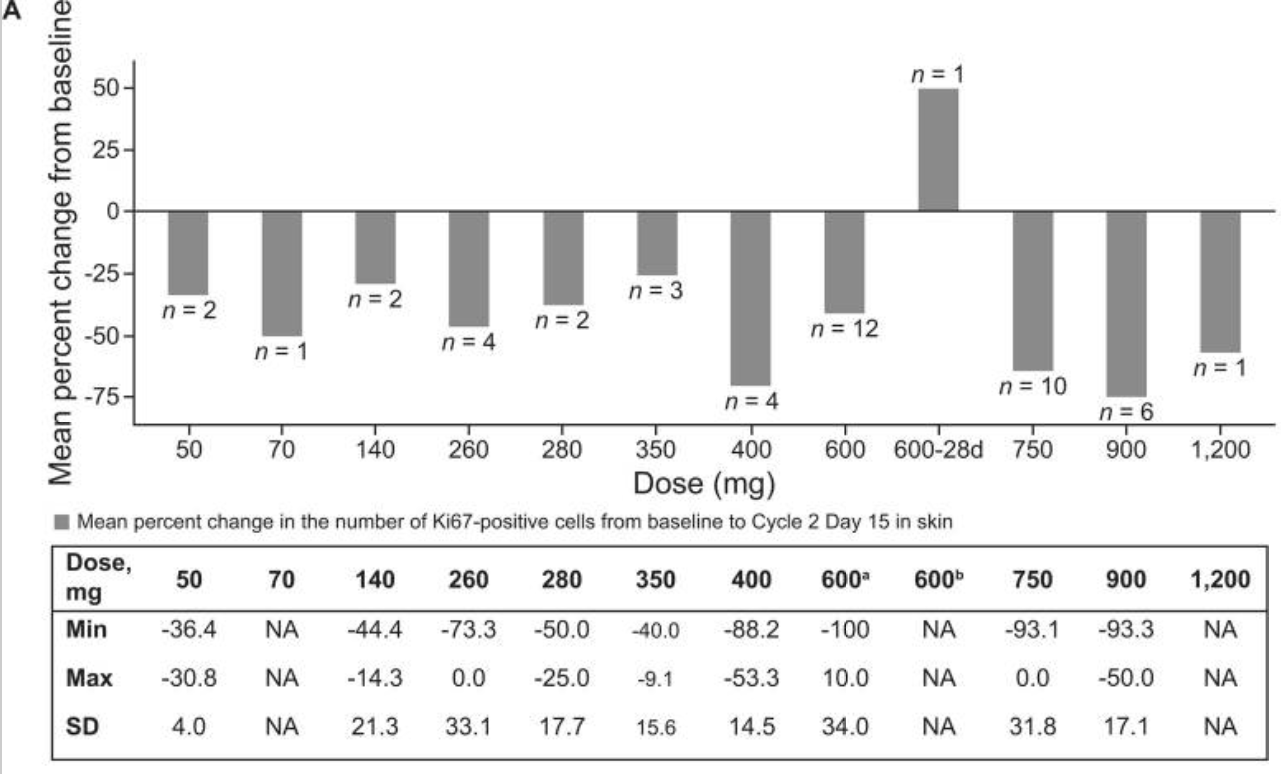
第三,瑞波西利400mg qd适合早期患者,保障疗效安全双获益。瑞波西利在早期乳腺癌患者应用的治疗剂量较晚期患者应用时更低,是充分平衡疗效与安全性后的决策。瑞波西利Ⅰ期剂量爬坡研究显示,自400mg qd(给药3周停药1周)之后,继续增加给药剂量,患者Ki-67较基线水平下降幅度趋于一致,其最大耐受剂量为900mg/kg,综合考虑药代动力学及药效学结果,确立了600mg qd、给药3周停药1周的方式14。
在瑞波西利获得FDA批准用于晚期HR+/HER2-乳腺癌治疗后,FDA规定了瑞波西利的剂量调整方式,若因不良反应需调整剂量,建议首次调整为400mg/天,再次调整为200mg/天,若仍需调整,则需中断治疗15。MONALEESA-2/3/7研究汇总分析显示,在一线接受瑞波西利治疗的患者中,有45.8%的患者因不良事件降低剂量,其中约三分之二为单次降低(400mg),剂量降低患者的客观缓解率(ORR)与临床获益率(CBR)并未受损,安全性获得改善16。
AMALEE研究直接对比了瑞波西利400mg+NASI与瑞波西利600mg+NASI一线治疗HR+/HER2-晚期乳腺癌的效果。疗效方面,ORR为47.5% vs 55.2%,HR为0.863(0.730-1.021),mPFS为24.9个月 vs 25.1个月,HR为1.07(0.78-1.46),无显著差异。
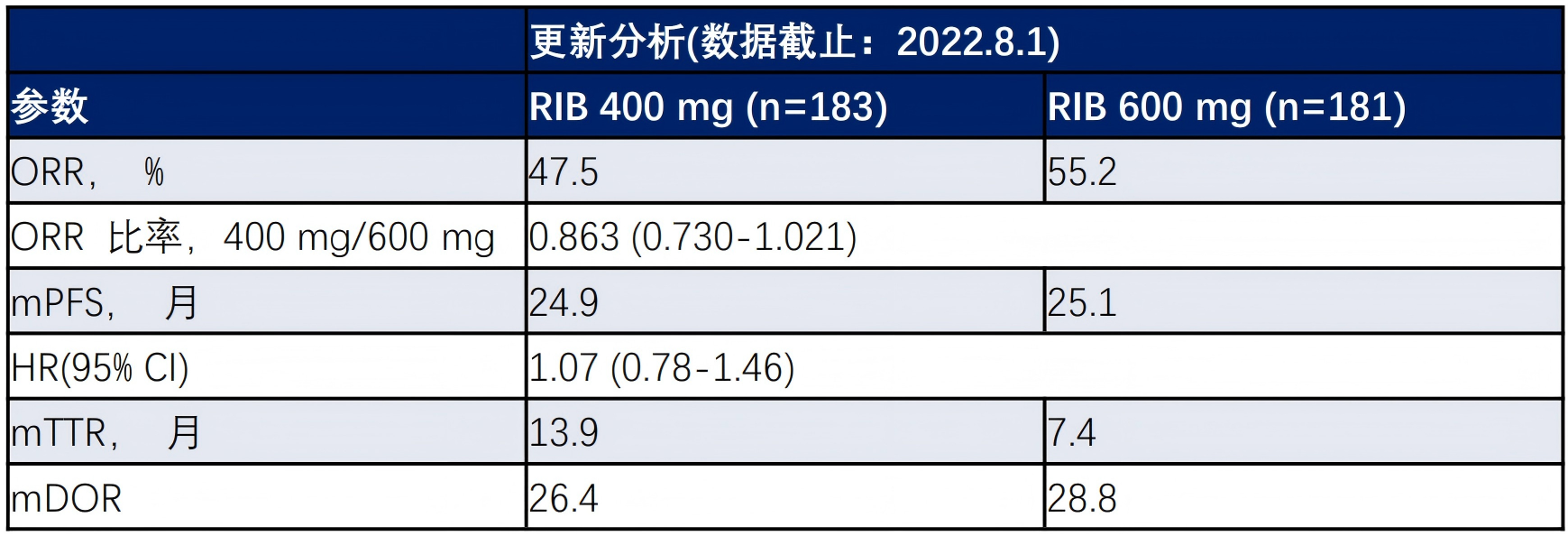
在安全性方面,400mg剂量组给药2h后QTcF平均变化更低(12.5ms vs 19.7ms),心脏不良事件更少,3-4度中性粒细胞减少发生率也更低(31.4% vs 46.3%)17。
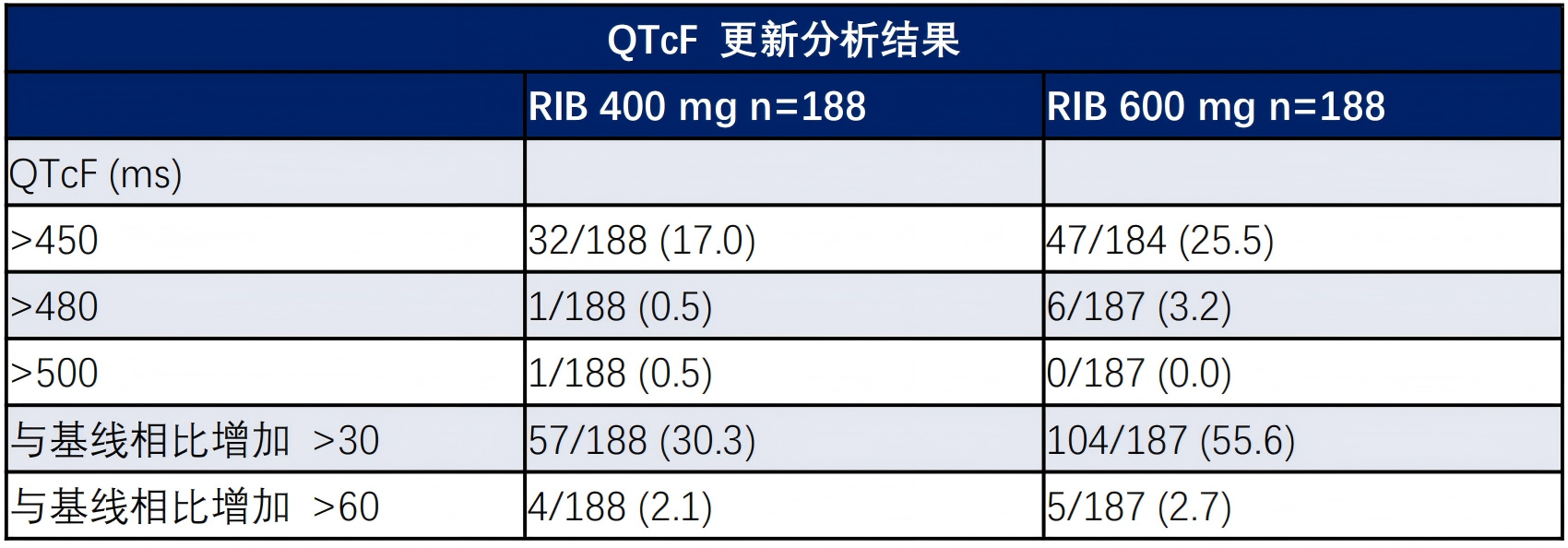
早期HR+乳腺癌的治疗目标是治愈。为了尽可能延长患者无病生存的基础上,进一步提高患者耐受性,降低远期不良反应。NATALEE的研究设计体现了剂量选择方面从最大耐受剂量到最小有效剂量的转变,在前期基础上采用400mg给药剂量作为早期患者的优选给药方案。最终NATALEE研究结果显示,瑞波西利+NSAI较NSAI不仅在疗效方面延长了iDFS,还在安全性方面较既往600mg的剂量取得了改善的趋势,其血液毒性、心脏毒性的发生率及严重程度均得到了进一步减轻。
在耐受性方面,NATALEE研究中62.8%的患者完成了计划的3年瑞波西利治疗,3年的给药方案成功覆盖了HR+/HER2-乳腺癌的复发高峰,充分降低了患者的复发风险。20.0%的患者因不良事件导致瑞波西利提前停药。然而,患者停药或减量导致剂量强度降低并未影响患者iDFS。研究显示瑞波西利中等相对剂量强度(RDI)(50.73%~96.47%)、低RDI(<50.73%)与高RDI(≥96.47%),并未显著提升HR值,未增加疾病进展或死亡风险18。

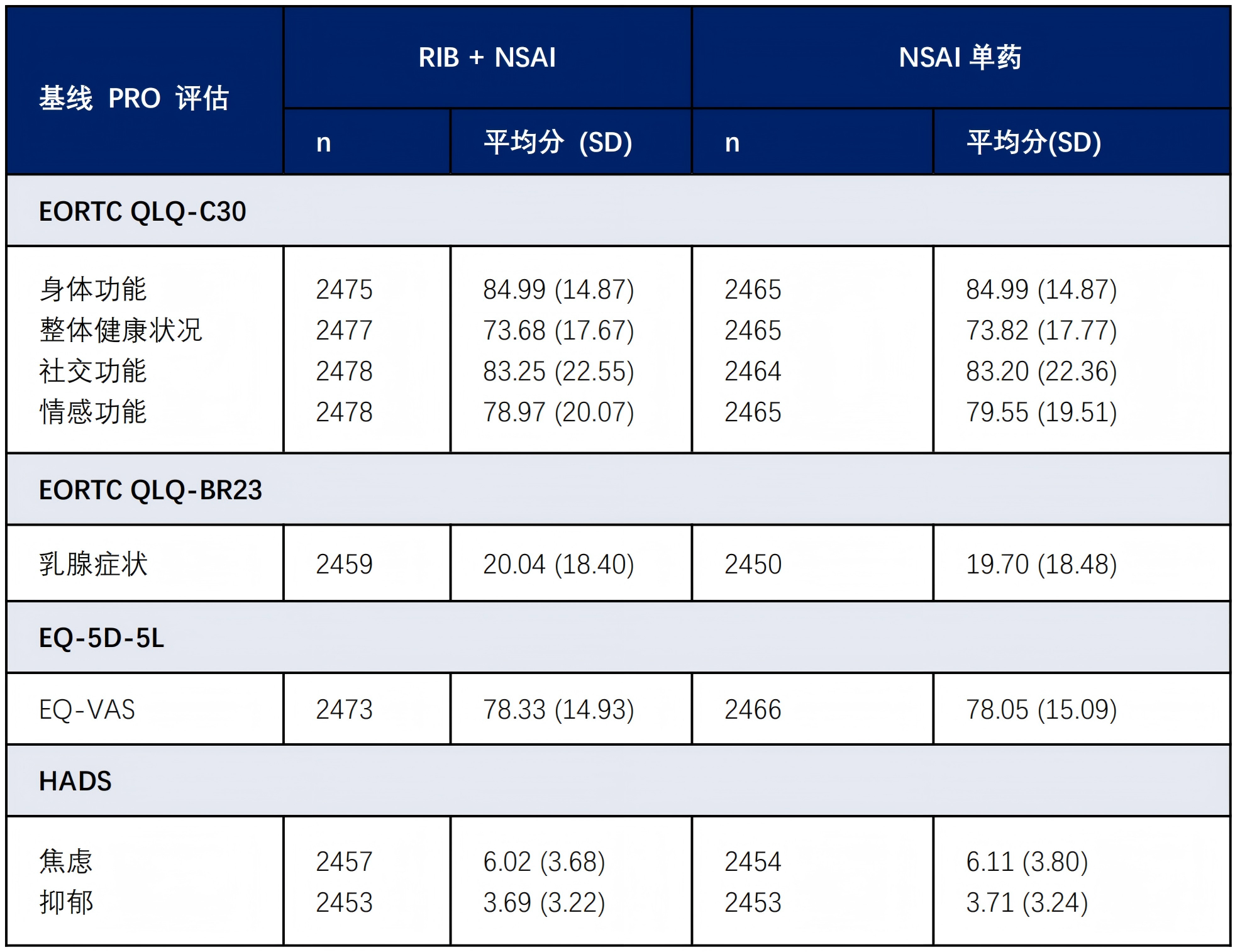
在生活质量方面,患者报告结局显示,在EORTC QLQ-C30评分、EORTC QLQ-BR23评分、EQ-5D-5L量表、HADS量表方面,瑞波西利+NSAI与NSAI两组在患者生理功能、心理健康、社会需求方面基本一致,保障了患者良好的治疗体验。从而为患者生存获益及生活质量带来了双重保障19。
著书立言,首个广泛Ⅱ-Ⅲ期HR+/HER2-乳腺癌辅助治疗新方案
NATALEE研究数据的陆续披露,显示了瑞波西利+NSAI较NSAI在iDFS的持续改善作用,而且随着时间的推移,iDFS的绝对获益在逐步扩大,OS方面已经展现出了获益的趋势,这与专家公认的iDFS获益可能转化为生存获益的观点相吻合,更长随访的OS结果令人期待。与此同时,安全性方面在所有的数据截止点均保持稳定,最新数据中位随访已达44.2个月,与上一个数据截止点(中位随访33.3个月)相比,因AE而停药的比率分别为20.0%和18.9%,增幅小于1.0%,表现出持续可耐受的特点。
在瑞波西利+NSAI的循证医学证据不断丰富,可及性日益提升的背景下,该方案已经成为《NCCN指南 2025v4》、《CSCO BC指南2025》等国内外指南推荐的首个广泛Ⅱ-Ⅲ期HR+/HER2-乳腺癌辅助治疗标准方案,成为了广泛II-III期HR+/HER2-乳腺癌辅助治疗的新标准,树立了新的里程碑。随着临床诊疗理念、方案在不断发展进步,将不断引发学者对现行诊疗的标准的思考,或许瑞波西利更低剂量、持续用药3年的给药方式更适合亚洲人群,希望未来能有更多循证医学证据不断验证,为临床实践带来更精准、更精确的用药指导,为患者争取更长的生存时间和更好的生活质量,最终实现乳腺癌的治愈目标。
1. Zhu, Xudong et al. Letter Re: A phase III trial of adjuvant ribociclib plus endocrine therapy versus endocrine therapy alone in patients with HR-positive/HER2-negative early breast cancer: final invasive disease-free survival results from the NATALEE trial. Annals of Oncology, Volume 0, Issue 0.
2. Mimura, Akari et al. Rethinking Ribociclib: Revisiting Dosing, Duration, and the N0 High-Risk Dilemma in the NATALEE Trial. Annals of Oncology, Volume 0, Issue 0.
3. 药物临床试验登记与信息公示平台. 一项在激素受体阳性、HER-2 阴性、早期乳腺癌患者中评估Ribociclib联合内分泌治疗作为辅助疗法疗效和安全性的研究. Available at: http://www.chinadrugtrials.org.cn/clinicaltrials.searchlistdetail.dhtml
4. National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Breast Cancer (Version 4.2018). 2019.02.08.
5. 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)乳腺癌诊疗指南. 北京: 人民卫生出版社, 2020
6. 药物临床试验登记与信息公示平台.Available at: http://www.chinadrugtrials.org.cn/clinicaltrials.searchlist.dhtml
7. NIH ClinicalTrials. A Trial to Evaluate Efficacy and Safety of Ribociclib With Endocrine Therapy as Adjuvant Treatment in Patients With HR+/HER2- Early Breast Cancer (NATALEE). Available at: https://clinicaltrials.gov/study/NCT03701334
8. National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Breast Cancer (Version 1.2022). 2021.11.24.
9. Gourgou-Bourgade S, Cameron D, Poortmans P, et al. Guidelines for time-to-event end point definitions in breast cancer trials: results of the DATECAN initiative (Definition for the Assessment of Time-to-event Endpoints in CANcer trials)† [published correction appears in Ann Oncol. 2015 Dec;26(12):2505-6. doi: 10.1093/annonc/mdv478.]. Ann Oncol. 2015;26(5):873-879. doi:10.1093/annonc/mdv106
10. 国家药品监督管理局药品评审中心. 药品审评中心公开征求《抗肿瘤药物临床试验统计学设计指导原则》意见. 2020.07
11. US FDA. Guidance for Industry : Clinical Trial Endpoints for the Approval of Cancer Drugs and Biologics. 2018.12. Available at: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/clinical-trial-endpoints-approval-cancer-drugs-and-biologics
12. Fasching PA,et al. Adjuvant ribociclib (RIB) plus nonsteroidal aromatase inhibitor (NSAI) in patients (Pts) with HR+/HER2− early breast cancer (EBC): 4-year outcomes from the NATALEE trialESMO 2024. Oral LBA13
13. Hortobagyi GN, Lacko A, Sohn J, et al. A phase III trial of adjuvant ribociclib plus endocrine therapy versus endocrine therapy alone in patients with HR-positive/HER2-negative early breast cancer: final invasive disease-free survival results from the NATALEE trial. Ann Oncol. 2025;36(2):149-157. doi:10.1016/j.annonc.2024.10.015
14. Infante JR, Cassier PA, Gerecitano JF, et al. A Phase I Study of the Cyclin-Dependent Kinase 4/6 Inhibitor Ribociclib (LEE011) in Patients with Advanced Solid Tumors and Lymphomas. Clin Cancer Res. 2016;22(23):5696-5705. doi:10.1158/1078-0432.CCR-16-1248
15. U.S. FDA. Ribociclib (Kisqali)-Full prescribing information for ribociclib. Available at: https://www.fda.gov/drugs/resources-information-approved-drugs/ribociclib-kisqali
16. Burris HA, Chan A, Bardia A, et al. Safety and impact of dose reductions on efficacy in the randomised MONALEESA-2, -3 and -7 trials in hormone receptor-positive, HER2-negative advanced breast cancer. Br J Cancer. 2021;125(5):679-686. doi:10.1038/s41416-021-01415-9
17. Cardoso F, et al. Abstract PD17-12: Primary efficacy and safety results from the AMALEE trial evaluating 600 mg vs 400 mg starting doses of first-line ribociclib in patients with HR+/HER2− advanced breast cancer. SABCS 2022. Poster PD17-12
18. Hamilton,et al. Abstract P1-11-16: Impact of ribociclib dose reduction on efficacy in patients with hormone receptor– "positive/human epidermal growth factor receptor 2–negative (HR+/HER2−) early breast cancer (EBC) in NATALEE”
19. Fasching PA,et al. VP3-2023: Health-related quality of life (HRQoL) in the phase III NATALEE study of adjuvant ribociclib (RIB) plus a nonsteroidal aromatase inhibitor (NSAI) vs NSAI alone in patients (pts) with HR+/HER2- early breast cancer (EBC). ESMO 2023 Virtual Plenary. Oral VP3-2023.
排版编辑:肿瘤资讯-CYX











 苏公网安备32059002004080号
苏公网安备32059002004080号


