中山大学附属第七医院消化医学中心 博士后
博士后研究方向:结直肠癌免疫治疗耐药、免疫微环境
以第一作者/共同第一作者在NPJ precision oncology、Cancer letters、Cancer Immunology immunotherapy等杂志发表论文多篇
ASCO2025 解读文献
LBA1
Randomized trial of standard chemotherapy alone or combined with atezolizumab as adjuvant therapy for patients with stage III deficient DNA mismatch repair (dMMR) colon cancer (Alliance A021502; ATOMIC).
LBA1:单纯标准化疗或联合阿替利珠单抗作为III期错配修复缺陷(dMMR)结肠癌术后辅助治疗的随机对照试验(Alliance A021502;ATOMIC研究)
摘要
研究背景
III期结肠癌的标准术后辅助化疗方案由氟尿嘧啶与奥沙利铂组成。错配修复缺陷(dMMR)III期结肠癌患者能否从免疫检查点抑制剂(ICI)与辅助化疗联用方案中获益,答案是尚不明确的。研究者开展了III期临床试验ATOMIC研究(NCT02912559),旨在探索抗PD-L1单抗阿替利珠单抗(Atezolizumab, atezo)联合mFOLFOX6方案(氟尿嘧啶+亚叶酸钙+奥沙利铂)是否能改善III期dMMR结肠癌患者的结局。
研究方法
研究者开展了一项由美国国家癌症研究所(NCI)资助的多中心随机III期临床试验,研究对象为 通过NCTN(国家临床试验网络)站点与德国研究中心入组的、年龄≥12岁的、接受根治性手术的III期dMMR 结肠腺癌患者(任何T分期 ,N1~2,M0)。肿瘤dMMR状态通过当地免疫组化检测并经中心实验室验证确认。研究采用1∶1随机分组设计:试验组接受mFOLFOX6联合阿替利珠单抗(840mg,静脉注射,每2周一次)治疗12个周期(6个月),后续接受13个周期阿替利珠单抗单药治疗(总疗程12个月);对照组仅接受mFOLFOX6治疗12个周期。随机分层因素包括:N分期(N1/2 vs N2)、T分期(T1~3 vs T4)以及肿瘤部位(近端 vs 远端结肠)。主要研究终点为无病生存期(DFS);次要研究终点为总生存期(OS)与不良事件(AE)(依据CTCAE与PRO-CTCAE标准评估)。主要疗效分析面对意向治疗人群开展,通过分层Log-rank检验(分层对数秩检验)比较组间DFS差异。采用分层Cox模型计算风险比(HR)及95%置信区间(CI),通过Kaplan-Meier法估算3年DFS率。结果显示,在700例患者中,经两次中期分析(分别达到50%和75%事件数)后,观察到165例DFS事件,该研究在指数生存分布假设和单侧α=0.025条件下,可达到90%的统计效能以检测HR=0.6的差异(3年DFS率:75% vs 84.2%)。本研究计划入组700例患者,在观察到165例DFS事件时进行两次中期分析(50%和75%事件数)。基于指数生存分布假设和单侧α=0.025的检验水准,当设定HR=0.6(对应3年DFS率75% vs 84.2%)时,研究具有90%的统计把握度。
研究结果
自2017年9月至2023年1月,共计712例患者(含1例儿科患者)被随机分配至阿替利珠单抗联合mFOLFOX6组(n=355)或单纯mFOLFOX6组(n=357)。入组患者的中位年龄为64岁。55.1%为女性。肿瘤特征方面,83.8%位于近端结肠;46.1%被评估为临床低风险患者(T1~3N1),而53.9%为高风险患者(T4和/或N2)。第二次中期分析结果显示,中位随访时间为37.2个月(四分位距为24.2至55.5个月),共观察到124 例无病生存事件。阿替利珠单抗联合mFOLFOX6组3年无病生存率为86.4%(95%CI:81.8%~89.9%),显著高于对照组mFOLFOX6组的76.6%(95%CI:71.3%~81%)(风险比HR:0.50;95%CI:0.35~0.72)。分层log-rank检验P值<0.0001,跨越预设的0.009疗效边界。阿替利珠单抗的疗效在各亚组中表现一致,包括70岁以上患者及不同风险分层人群。安全性方面,阿替利珠单抗组71.7%患者出现≥3级治疗相关不良事件,对照组为62.1%。
研究结论
在mFOLFOX6方案基础上联合阿替利珠单抗可显著改善III期dMMR结肠癌术后无病生存期(DFS),因此该联合方案应被视为其术后辅助治疗的新标准。本研究获得美国国家癌症研究所(资助号:U10CA180821、U10CA180882、U24CA196171)、罗氏集团成员基因泰克公司支持;致谢声明详见:https://acknowledgments.alliancefound.org。临床试验注册号:NCT02912559。研究资助方:美国国家癌症研究所(U10CA180882)及基因泰克公司。
解读
III期肠癌术后辅助化疗的发展与困境
自20世纪90年代起,氟尿嘧啶类药物[如氟尿嘧啶(5-FU)单药]被确立为结肠癌术后辅助治疗的标准方案。随着伊立替康、奥沙利铂等新型化疗药物在转移性结直肠癌治疗中展现出显著疗效,自2000年起,多项大型临床研究开始探索含奥沙利铂的联合化疗方案在辅助治疗中的应用。基于这些研究证据,氟尿嘧啶联合奥沙利铂的6个月化疗方案最终被确定为III期结肠癌术后辅助治疗的国际标准。
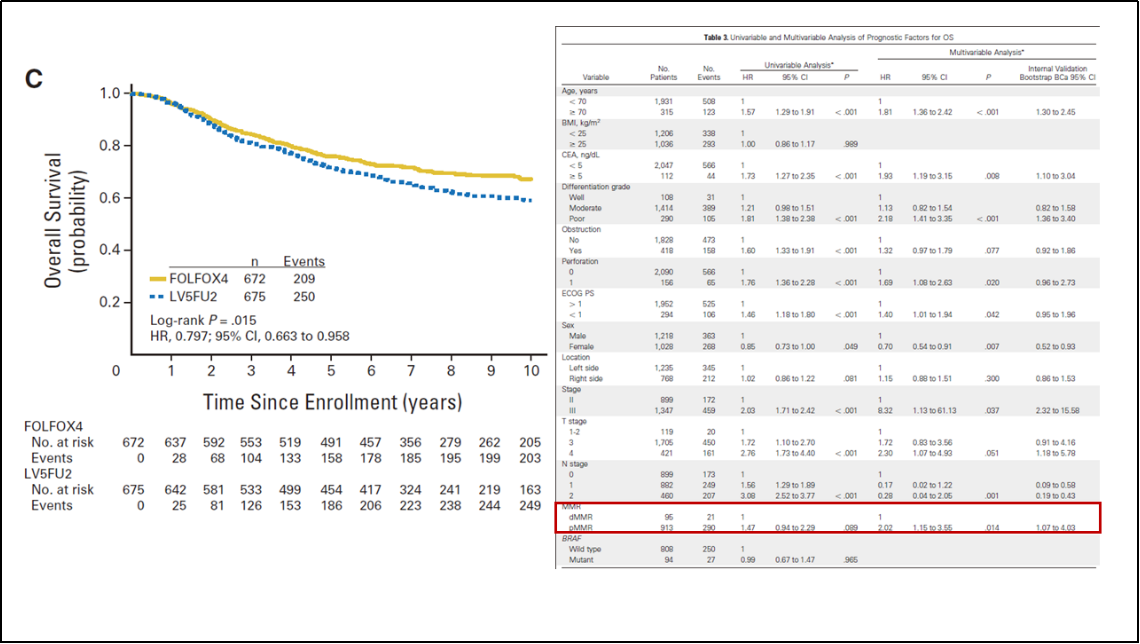
MOSAIC 研究是奠定氟尿嘧啶联合奥沙利铂方案作为II~III期结肠癌标准化疗方案的主要研究。该研究按照MMR状态与BRAF突变等特征对入组的2,246例II~III期结肠癌切除术后患者进行10年生存数据随访,其更新结果显示,全人群10年OS率在LV5FU2组和FOLFOX4组分别为67.1% vs 71.7%(HR 0.85;P=0.043)。其中III期患者获益更为显著,10年OS率分别为59.0% vs 67.1%(HR 0.80;P=0.016)。在所有入组人群中,95例(9.4%)为dMMR肿瘤,94例(10.4%)存在BRAF突变。BRAF突变对OS无预后意义(P=0.965),而dMMR是独立的预后因素(HR 2.02;95%CI 1.15~3.55;P=0.014)。综上所述,基于奥沙利铂的辅助化疗带来的OS获益,随时间推移和疾病严重程度的增加而显现,这一效应在II~III期结肠癌患者的10年随访中得到证实。其更新结果支持FOLFOX方案用于III期患者,包括dMMR或BRAF突变患者。为了维持疗效,并考虑到减轻骨髓抑制、消化道反应等副作用,逐步提高患者耐受性与依从性,FOLFOX4方案在后来的临床实践中逐渐调整了奥沙利铂的剂量,演变为mFOLFOX6方案。
根据MOSAIC研究的长期随访数据,约15%的患者在完成含奥沙利铂方案化疗4年后仍存在显著影响生活质量的神经病变,这一发现提示长期使用奥沙利铂导致的累积性神经毒性不容忽视。临床实践中,许多患者因难以耐受奥沙利铂相关毒性而被迫中断治疗。鉴于这一治疗困境,学界开始探索缩短疗程的可能性——既能保留奥沙利铂的抗肿瘤疗效,又可降低毒性负担并减少医疗成本。这直接引发思考:III期肠癌辅助化疗是否必须坚持6个月标准疗程?正是基于这一临床需求, IDEA研究应运而生。
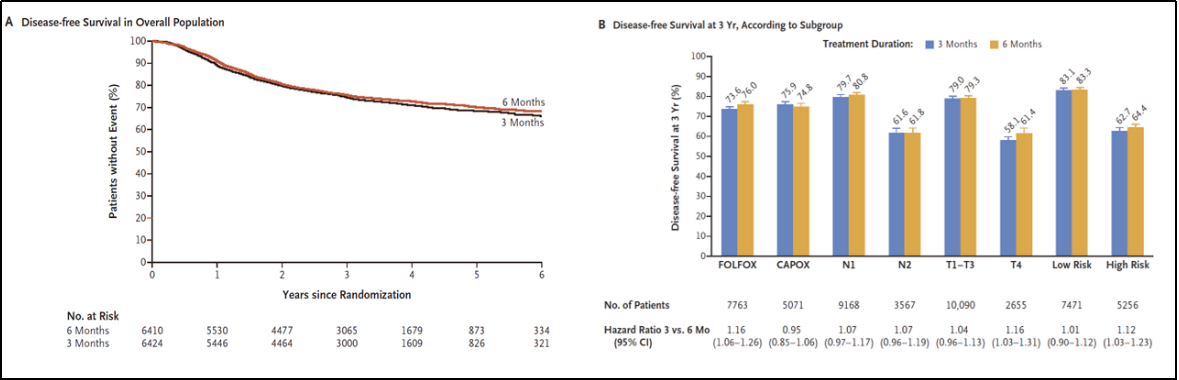
IDEA研究是一项大型国际多中心研究,针对6项同期开展的随机III期试验进行了前瞻性、预设的汇总分析,旨在评估3个月FOLFOX或CAPOX(卡培他滨+奥沙利铂)辅助治疗对比6个月疗程的非劣效性。在12,834例患者中,共观察到3,263例疾病复发或死亡事件,结果显示总体人群中未能证实3个月治疗非劣效于6个月(HR=1.07;95% CI 1.00~1.15)。在CAPOX方案中,短疗程显示出非劣效性,但在FOLFOX方案中未达到非劣效(HR=1.16;95% CI 1.06~1.26)。探索性分析表明,在T1~3N1患者中,3个月与6个月疗程的3年DFS率分别为83.1%和83.3%(HR=1.01;95% CI 0.90~1.12),满足非劣效性;而T4或N2患者中,6个月疗程的DFS率显著优于3个月(64.4% vs. 62.7%;HR=1.12;95% CI 1.03~1.23;优效性P=0.01)。该结果提示,在III期结肠癌患者中,FOLFOX或CAPOX辅助治疗的3个月疗程未在总体人群中证实其非劣效于6个月。然而,CAPOX治疗组(尤其是低危亚组)的3个月疗效与6个月相当。综上,IDEA研究推动了个体化辅助治疗决策,强调风险分层和方案选择的重要性,而非统一采用6个月化疗,从而在疗效和毒性之间取得更好平衡。
免疫治疗的发展历程
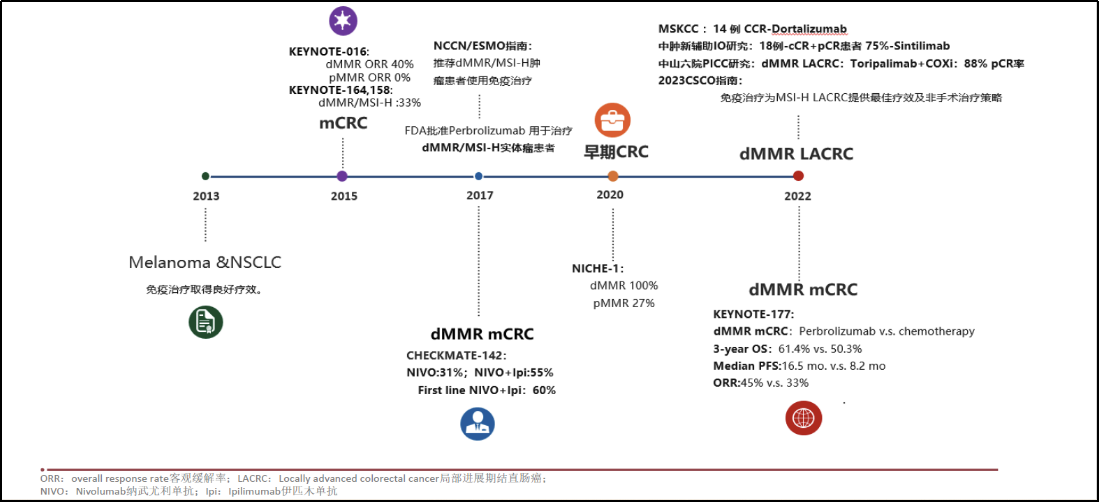
自2013年以来,免疫治疗在肿瘤领域,尤其是在难治性非小细胞肺癌和黑色素瘤中展现出空前的疗效,其中,以PD-1/PD-L1及CTLA-4抗体为代表的ICI研究最为广泛。KEYNOTE-016研究首次对转移性结直肠癌(mCRC)按dMMR与pMMR进行分组分析,结果显示帕博利珠单抗在dMMR型mCRC患者中的客观缓解率(ORR)达到40%。随后,KEYNOTE-164[3]、KEYNOTE-158[4]等5项临床研究进一步巩固了PD-1单抗在MSI-H/dMMR晚期结直肠癌治疗中的地位。2017年,美国食品药品监督管理局(FDA)正式批准帕博利珠单抗用于dMMR实体瘤患者的治疗。KEYNOTE-177与CHECKMATE 8HW研究表明,相较于单纯化疗,免疫治疗(无论是单免还是双免)均能为dMMR mCRC带来无进展生存(PFS)获益,确立了免疫治疗作为dMMR mCRC的一线标准治疗地位。随着研究的深入,免疫治疗的应用逐渐向早期结直肠癌拓展。NICHE研究首次将免疫治疗用于早期结直肠癌新辅助治疗,结果显示dMMR患者的ORR高达100%。2022年,MSKCC研究等将ICI的应用扩展至局部晚期dMMR结直肠癌,入组的12例局部晚期直肠癌患者均达到临床完全缓解(CCR)。以上研究的突破标志着ICI的应用已从晚期结直肠癌逐步覆盖至早期乃至局部晚期新辅助治疗领域。
III期dMMR结肠癌术后辅助免疫治疗的潜在可能性
dMMR/MSI-H在各大肿瘤当中占约3%~5%,而在散发结直肠癌患者中,其比例约为13%~14%[5]。dMMR/MSI-H在不同的结直肠癌(CRC)分期中分布差异显著: II期CRC中大约占20%,III期为12%,而IV期则仅有4%[6]。与同分期的pMMR CRC患者相比,II期的dMMR/MSI-H的CRC患者复发风险较低。现有研究表明,dMMR/MSI-H肿瘤对单药氟尿嘧啶类药物敏感性较低,可能存在一定程度的耐药性[7-11],因此,对于该类型患者,应当避免使用单药氟尿嘧啶类药物。
根据现行指南推荐,无论MMR状态如何,III期结肠癌的标准辅助化疗方案均应选择以氟尿嘧啶类联合奥沙利铂为基础的方案(CAPOX或mFOLFOX6,疗程为6个月)。因此基于目前研究结果,现下III期dMMR结肠癌的术后辅助治疗与pMMR结肠癌并无区别。研究指出,尽管接受了规范的术后辅助治疗(FOLFOX方案×6个月),仍有约23%~30%的III期结肠癌患者在结束治疗3年内出现疾病复发[12]。虽然ICI已被批准用于治疗转移性dMMR型结直肠癌,但其在III期dMMR结肠癌根治术后辅助治疗中的疗效尚未得到确证。
基于上述研究现状,研究者开展了针对dMMR III期结肠癌探索辅助治疗联合免疫治疗疗效的首个前瞻性随机对照研究——ATOMIC研究。
ATOMIC研究设计与研究结果
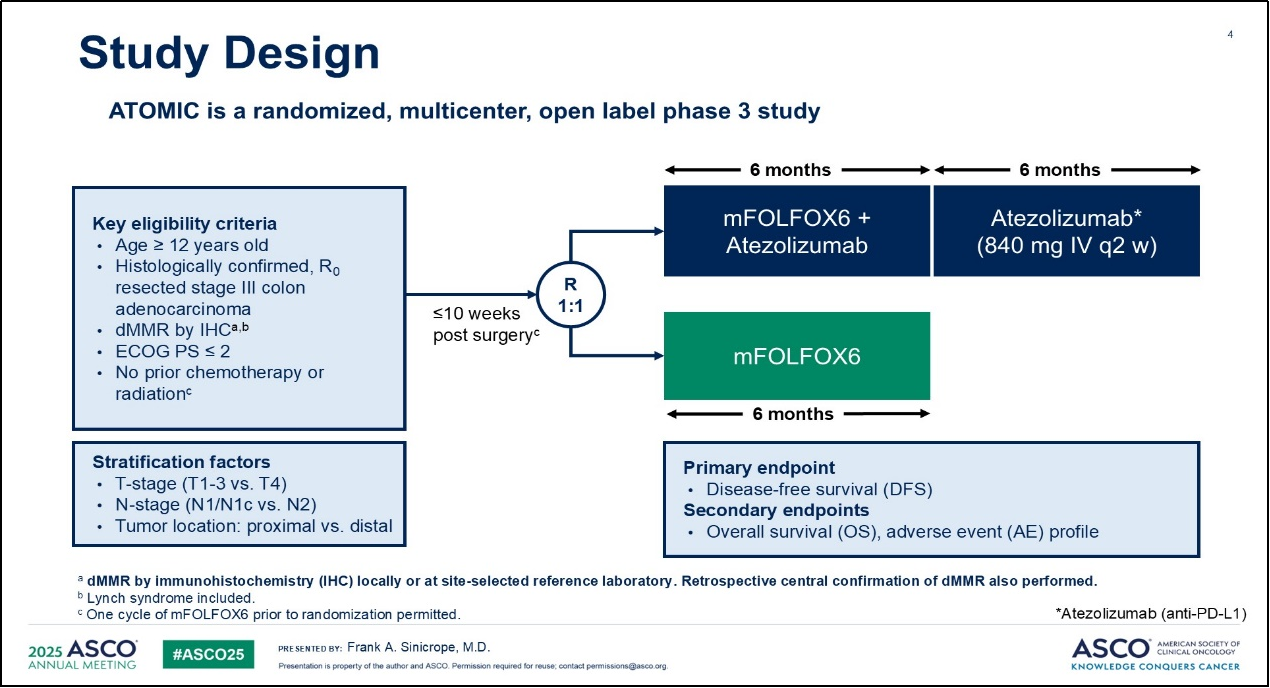
ATOMIC临床试验是一项随机、多中心、开放标签的III期临床研究。该研究的主要入组标准包括:(1)年龄≥12岁;(2)接受R0切除且病理确诊为III期结肠腺癌;(3)经免疫组化(IHC)检测证实为dMMR;(4)ECOG PS评分≤2;(5)既往未接受术前新辅助放化疗。入组患者需在根治术后10周内完成1∶1随机分组,分别进入试验组(mFOLFOX6联合阿替利珠单抗组)与对照组(mFOLFOX6组)。随机分层因素包括N分期(N1 vs N2)、T分期(T1~3 vs T4)以及肿瘤部位(近端结肠 vs 远端结肠)。试验组治疗方案为mFOLFOX6联合阿替利珠单抗(840mg,iv,q2w)治疗6个月,随后序贯阿替利珠单抗单药治疗6个月;对照组仅接受mFOLFOX6方案治疗6个月。研究主要终点为无病生存期(DFS),次要终点包括总生存期(OS)和安全性(AE)。研究特别说明:(1)允许Lynch综合征患者入组;(2)随机分组前可完成1个周期的mFOLFOX6治疗;(3)dMMR状态可由当地实验室初步检测,但需经中心实验室回顾性复核确认。
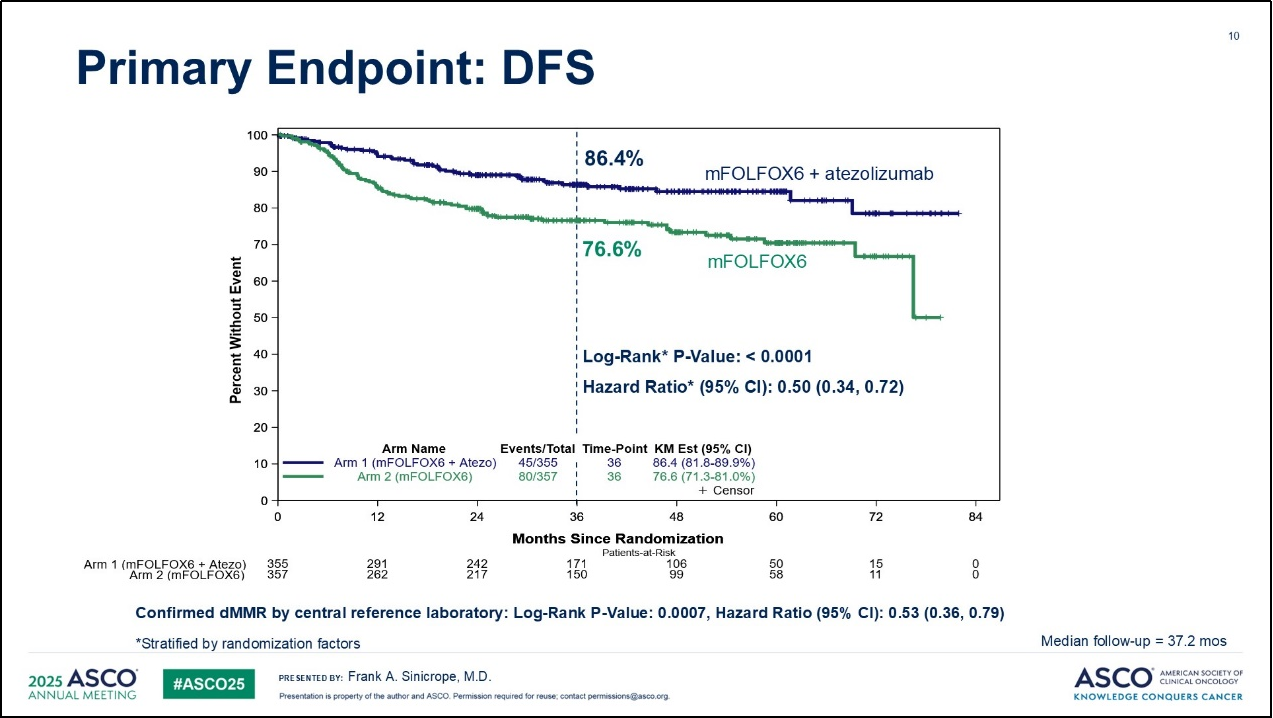
在研究主要终点DFS方面,mFOLFOX6联合阿替利珠单抗组的3年DFS率为86.4%,相较于对照组的76.6%的结果提高了约10%(95% CI:71.3%~81%),差异具有统计学意义(Log Rank P值<0.0001,HR:0.50,95%CI:0.34~0.72)。mFOLFOX6联合阿替利珠单抗组较单纯化疗组显著降低dMMR III期结肠癌患者的复发或死亡风险达50%(HR=0.50;95%CI 0.34~0.72;Log Rank P<0.0001),达到了预设疗效界值。此外,阿替利珠单抗的疗效在各亚组中表现一致,包括70岁以上患者及不同风险分层人群。
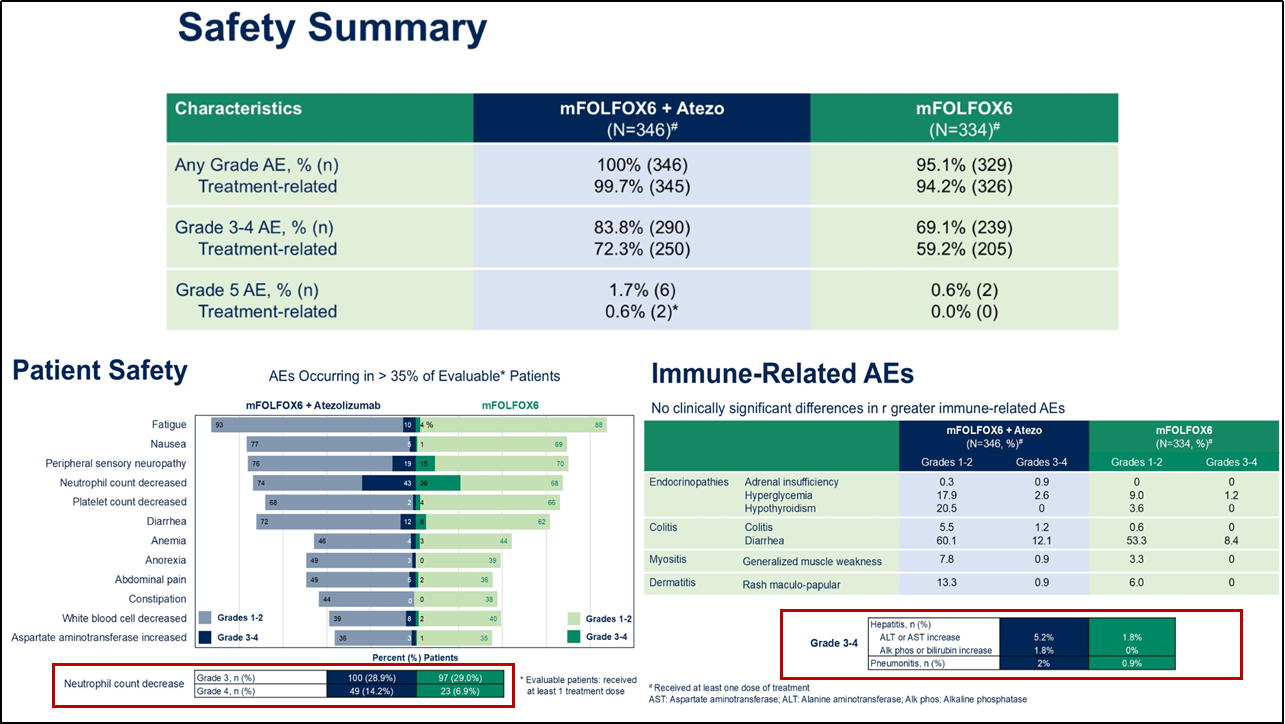
而在次要终点方面,整体生存期(OS)数据尚无定论,有待进一步随访。在不良反应方面,尽管联合用药组在中性粒细胞减少事件发生率稍有增加,但两组在常见不良事件发生率上未见明显统计学差异。这些常见不良事件符合既往药物安全性特征,整体可控,未出现难以控制或罕见的严重不良反应。此外,阿替利珠单抗联合用药组在3~4级免疫相关不良反应(如免疫性肝炎及肺炎)方面的发生率较对照组稍高,但组间未见明显统计学差异。
本研究数据证实,阿替利珠单抗联合mFOLFOX6方案将成为dMMR III期结肠癌患者的术后辅助治疗的新型标准治疗方案。
ATOMIC研究引发的思考
(1)入组患者人群剖析
本研究基于辅助治疗旨在清除术后残留微转移灶的理论基础,将入组标准严格限定为接受R0切除术的III期dMMR结肠癌患者,旨在探讨免疫治疗联合化疗对根治术后微小残留病灶的协同清除作用。研究设计特别强调通过中心实验室复核确认MMR状态,确保研究对象均为dMMR型结肠癌患者。值得注意的是,虽然2018年发表的IDEA研究证实III期结肠癌患者中CAPOX方案3个月疗程对低危人群非劣效于6个月标准治疗,但由于ATOMIC研究启动于2017年,其对照组仍采用当时标准的mFOLFOX6方案、6个月疗程作为基础化疗方案。
(2)单纯辅助免疫是否可行?
ATOMIC研究展示了令人振奋的结果:阿替利珠单抗联合mFOLFOX6将3年复发率从既往的30%降至13%,且77%的联合用药组患者在末次治疗后维持3年无疾病生存,提示免疫治疗为dMMR结肠癌患者带来持久的抗肿瘤效应。类似地,KEYNOTE-177和CheckMate 8HW等研究证实,在未接受手术治疗的dMMR mCRC中,无论是单药免疫治疗还是双免联合,相较于单纯化疗均能显著改善DFS。那么,对于已完成根治手术的dMMR III期结肠癌患者,单纯免疫治疗(单免或双免)是否也能提供持久的无复发生存获益?ATOMIC研究突破了免疫治疗在传统辅助治疗中的局限,进一步引发思考:在术后辅助治疗中,单纯免疫治疗能否像MSKCC研究中局部晚期直肠癌的完全缓解结局一样,彻底清除术后微小残留病灶?
化疗与免疫治疗的作用机制存在本质差异。化疗通过干扰DNA合成/修复、抑制微管功能或阻断代谢途径(如5-FU)直接杀伤快速增殖的肿瘤细胞。dMMR结直肠癌因编码区高频突变产生大量新抗原,促进肿瘤微环境中T细胞浸润,使其对免疫治疗高度敏感。ICI通过阻断PD-1/PD-L1或CTLA-4等抑制性信号通路,解除T细胞功能抑制,重启其抗肿瘤活性。因此,相对于化疗药物直接杀伤肿瘤细胞的角度,免疫治疗更像是一种非直接手段,而是通过激活宿主免疫系统实现长期抗肿瘤效应。
在ATOMIC研究中,笔者猜想,阿替利珠单抗与化疗发挥的协同抗肿瘤作用,可能源于化疗药物在破坏肿瘤细胞时暴露足量肿瘤新抗原,从而诱发广泛有效的免疫杀伤作用。对于接受根治性手术的dMMR III期结肠癌患者,尽管术后肿瘤负荷显著降低,残留的微小病灶仍可能因其固有的高突变特性持续产生免疫原性新抗原,但是,这些微量新抗原能否有效激活免疫系统并产生足够的抗肿瘤应答效应?那么在这一设想基础上,单纯的免疫治疗是否仍能发挥如新辅助免疫(肿瘤未切除时)相应的肿瘤杀伤效应,答案仍是未知的。此外,若是单免可行,双免是否也可行?这些关键问题的解答,将为dMMR结肠癌的辅助治疗策略提供重要依据。
(3)新辅助免疫 or辅助免疫?
关于新辅助免疫治疗与辅助免疫治疗的优劣比较,在可手术的非小细胞肺癌与黑色素瘤等领域中目前已有多个临床试验数据支持新辅助策略更具优势。如黑色素瘤的OpACIN试验[13],对比了纳武利尤单抗+伊匹木单抗新辅助与辅助免疫治疗的安全性与疗效。结果显示,在总疗程相同的情况下,将部分免疫治疗疗程提前至术前,患者预后更佳,提示免疫治疗宜早不宜迟。
NICHE-2研究作为目前结直肠癌领域样本量最大的新辅助免疫治疗的II期临床研究,共纳入111例III期dMMR结肠癌患者。所有患者在接受1个周期伊匹木单抗联合2个周期纳武利尤单抗治疗后,在6周内接受手术治疗,结果显示病理缓解率高达98%(109/111),其中病理完全缓解(pCR)率为68%(75/111)。在中位随访26个月时,3年DFS率达到100%,且所有患者均未出现疾病复发。相比之下,针对同样为dMMR III期结肠癌患者的ATOMIC研究中,接受手术联合术后化疗免疫辅助治疗组的3年DFS率仅为86.4%。然而需要指出的是,NICHE-2研究的样本量仅为100余例,远少于ATOMIC研究的700例,因此其研究结果仍需更大规模的临床试验加以验证。此外,NICHE-2研究采用双免疫联合治疗方案,而ATOMIC研究仅使用单免疫治疗方案。pCR/MPR等病理缓解指标能否替代DFS用于疗效评估?答案是未知的。目前尚缺乏直接比较结直肠癌新辅助免疫治疗与辅助免疫治疗疗效的头对头临床试验数据。
(4)未来展望
综上所述,ATOMIC 研究打破了免疫治疗在术后辅助治疗应用的局限,阿替利珠单抗联合mFOLFOX6方案将成为dMMR III期结肠癌患者的术后辅助治疗的新型标准方案,为III期结肠癌辅助免疫治疗设立了新的里程碑。然而,仍有不少问题亟待进一步解答,例如是否所有的dMMR结肠癌患者均能从单一化疗中获益?是否所有患者均需要进行长达1年的阿替利珠单抗治疗?是否应当根据IDEA研究对这类型患者进行风险分层,并据此制定不同的治疗方案?
荷兰癌症研究所Myriam Chalabi教授在点评ATOMIC研究时指出,基于该研究结果,临床实践中对初诊结肠癌患者应遵循以下诊疗路径:首先需进行MMR状态检测以明确是否为dMMR型。对于已确诊为dMMR的患者,需进一步进行临床风险评估:若存在cT4病灶和/或R1切除高风险因素,建议先行新辅助免疫治疗后再行根治性手术,术后根据病理结果决定辅助治疗方案;对于低风险患者,建议直接进行根治性手术,若术后病理证实为dMMR III期结肠癌,可考虑采用阿替利珠单抗联合mFOLFOX6或CAPOX方案进行辅助治疗。
ATOMIC研究作为全球第一个聚焦于dMMR III期结肠癌的术后免疫辅助治疗的临床研究,引发了学界的广泛关注于高度讨论,为免疫治疗从晚期向早期、从新辅助向辅助治疗全面推广应用,在dMMR结肠癌领域,去化疗策略可能成为未来方向。
中山大学附属第七医院-张常华教授
这篇对ATOMIC研究的解读全面而深入地剖析了这项里程碑式研究的临床价值与科学意义。作者精准把握了该研究的核心发现——PD-L1抑制剂阿替利珠单抗联合mFOLFOX6方案显著提升III期dMMR结肠癌患者3年DFS率达10个百分点(86.4% vs 76.6%)的关键数据,并敏锐指出这一成果将重塑临床实践格局。解读不仅系统梳理了从MOSAIC到IDEA研究的辅助治疗演进历程,更通过横向对比NICHE-2等新辅助免疫治疗研究,构建起完整的证据体系。此外,作者没有停留在数据表面,而是深入探讨了"化疗必要性"、"新辅助时机"等关键争议,既肯定了联合方案的突破性价值,又理性指出OS数据待成熟、去化疗可能性等未解问题,展现出批判性思维。全文逻辑严密,从历史背景到研究细节再到未来展望层层递进,既具学术深度又富有临床启发性,为读者提供了全面而平衡的研究评价。若能对安全性数据和不同风险亚组疗效差异作更具体分析,将使解读更加完善。
【温馨提示】:如果您觉得吴妙卿博士解读的好,请在下方为她点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
1. André T, de Gramont A, Vernerey D, et al. Adjuvant Fluorouracil, Leucovorin, and Oxaliplatin in Stage II to III Colon Cancer: Updated 10-Year Survival and Outcomes According to BRAF Mutation and Mismatch Repair Status of the MOSAIC Study. J Clin Oncol. 2015 Dec 10;33(35):4176-87. doi: 10.1200/JCO.2015.63.4238. Epub 2015 Nov 2. PMID: 26527776.
2. Grothey A, Sobrero AF, Shields AF, et al. Duration of Adjuvant Chemotherapy for Stage III Colon Cancer. N Engl J Med. 2018 Mar 29;378(13):1177-1188. doi: 10.1056/NEJMoa1713709. PMID: 29590544; PMCID: PMC6426127.
3. MARABELLE A, LE D T, ASCIERTO P A, et al. Efficacy of Pembrolizumab in Patients With Noncolorectal High Microsatellite Instability/Mismatch Repair-Deficient Cancer: Results From the Phase II KEYNOTE-158 Study [J]. J Clin Oncol, 2020, 38(1): 1-10.
4. LE D T, KIM T W, VAN CUTSEM E, et al. Phase II Open-Label Study of Pembrolizumab in Treatment-Refractory, Microsatellite Instability-High/Mismatch Repair-Deficient Metastatic Colorectal Cancer: KEYNOTE-164 [J]. J Clin Oncol, 2020, 38(1): 11-9.
5. HE Y, ZHANG L, ZHOU R, et al. The role of DNA mismatch repair in immunotherapy of human cancer [J]. Int J Biol Sci, 2022, 18(7): 2821-32.
6. BARETTI M, LE D T. DNA mismatch repair in cancer [J]. Pharmacol Ther, 2018, 189: 45-62.
7. Grady WM, Markowitz SD. The molecular pathogenesis of colorectal cancer and its potential application to colorectal cancer screening. Dig Dis Sci. 2015 Mar;60(3):762-72. doi: 10.1007/s10620-014-3444-4. Epub 2014 Dec 10. PMID: 25492499; PMCID: PMC4779895.
8. Boland CR, Goel A. Microsatellite instability in colorectal cancer. Gastroenterology. 2010 Jun;138(6):2073-2087.e3. doi: 10.1053/j.gastro.2009.12.064. PMID: 20420947; PMCID: PMC3037515.
9. Roth AD, Tejpar S, Delorenzi M, et al. Prognostic role of KRAS and BRAF in stage II and III resected colon cancer: results of the translational study on the PETACC-3, EORTC 40993, SAKK 60-00 trial. J Clin Oncol. 2010 Jan 20;28(3):466-74. doi: 10.1200/JCO.2009.23.3452. Epub 2009 Dec 14. PMID: 20008640.
10. Gutierrez C, Ogino S, Meyerhardt JA, et al. The Prevalence and Prognosis of Microsatellite Instability-High/Mismatch Repair-Deficient Colorectal Adenocarcinomas in the United States. JCO Precis Oncol. 2023 Jan;7:e2200179. doi: 10.1200/PO.22.00179. PMID: 36716414; PMCID: PMC9928756.
11. Sinicrope FA, Sargent DJ. Molecular pathways: microsatellite instability in colorectal cancer: prognostic, predictive, and therapeutic implications. Clin Cancer Res. 2012 Mar 15;18(6):1506-12. doi: 10.1158/1078-0432.CCR-11-1469. Epub 2012 Feb 2. PMID: 22302899; PMCID: PMC3306518.
12. Ribic CM, Sargent DJ, Moore MJ, et al. Tumor microsatellite-instability status as a predictor of benefit from fluorouracil-based adjuvant chemotherapy for colon cancer. N Engl J Med. 2003 Jul 17;349(3):247-57. doi: 10.1056/NEJMoa022289. PMID: 12867608; PMCID: PMC3584639.
13. Versluis JM, Menzies AM, Sikorska K, et al. Survival update of neoadjuvant ipilimumab plus nivolumab in macroscopic stage III melanoma in the OpACIN and OpACIN-neo trials. Ann Oncol. 2023 Apr;34(4):420-430. doi: 10.1016/j.annonc.2023.01.004. Epub 2023 Jan 18. PMID: 36681299.











 苏公网安备32059002004080号
苏公网安备32059002004080号


