骨原发肿瘤发病率极低,大部分骨肿瘤为肝癌、肾癌、肺癌等恶性肿瘤导致的骨转移,这类病理状态往往引起一系列临床症状和并发症,影响患者预后,带来沉重的医疗负担。骨肿瘤治疗主要包括外科手术治疗,内科系统性治疗如化疗、靶向治疗和免疫治疗,以及骨保护治疗。针对骨破坏机制的骨保护治疗在预防骨相关事件(SRE)、改善患者预后和生活质量方面有着重要作用。北京大学人民医院孙馨教授围绕肿瘤骨转移的流行病学与危害、发生机制以及骨转移治疗策略展开分享。【肿瘤资讯】特别整理其中内容,以飨读者。
民盟成员
北京大学人民医院骨肿瘤科
从事骨肿瘤专业18年,擅长骨与软组织肿瘤肿瘤的综合治疗
MGH麻省总医院research fellow
Rizzoli意大利骨科研究所clinical fellow
ISOLS国际保肢学会会员
COG儿童肿瘤协作组会员
中国抗癌学会骨肿瘤和骨转移癌委员会药物及精准治疗学组委员
肿瘤骨转移的流行病学与危害
骨肿瘤科主要诊疗范围涵盖颅骨以外的全身骨骼肿瘤。颅骨因与中枢神经系统关联密切,通常由神经外科处理。骨肿瘤通常涉及承重骨与中轴骨。这类骨骼主要功能包括身体支撑、内脏保护、运动功能、造血功能,以及矿物质代谢功能,其病变常引发疼痛及运动功能障碍,不仅直接损害生活质量,更会削弱患者对系统性抗肿瘤治疗的耐受性。
骨骼异常改变往往提示骨转移的发生甚至全身性病变进展。临床接诊携带X线或CT影像资料的患者时,需结合年龄、病灶部位进行鉴别诊断,首要考虑多发性骨髓瘤等原发骨肿瘤,其次排查转移性骨肿瘤可能。
骨骼特殊的解剖结构使其成为肿瘤转移的优选靶器官。松质骨具有多孔特性,适合肿瘤细胞驻留和定植;作为重要造血器官,骨骼具备丰富的血供系统,存在大量生长因子,且储存着丰富的营养物质,促进肿瘤存活与增殖。更关键的是,骨骼存在成骨-破骨动态平衡机制:成骨细胞完成基质沉积后通过骨重塑过程被吞噬,破骨细胞则持续参与骨吸收,这种生理性骨改建过程在肿瘤侵袭时易被病理化利用。
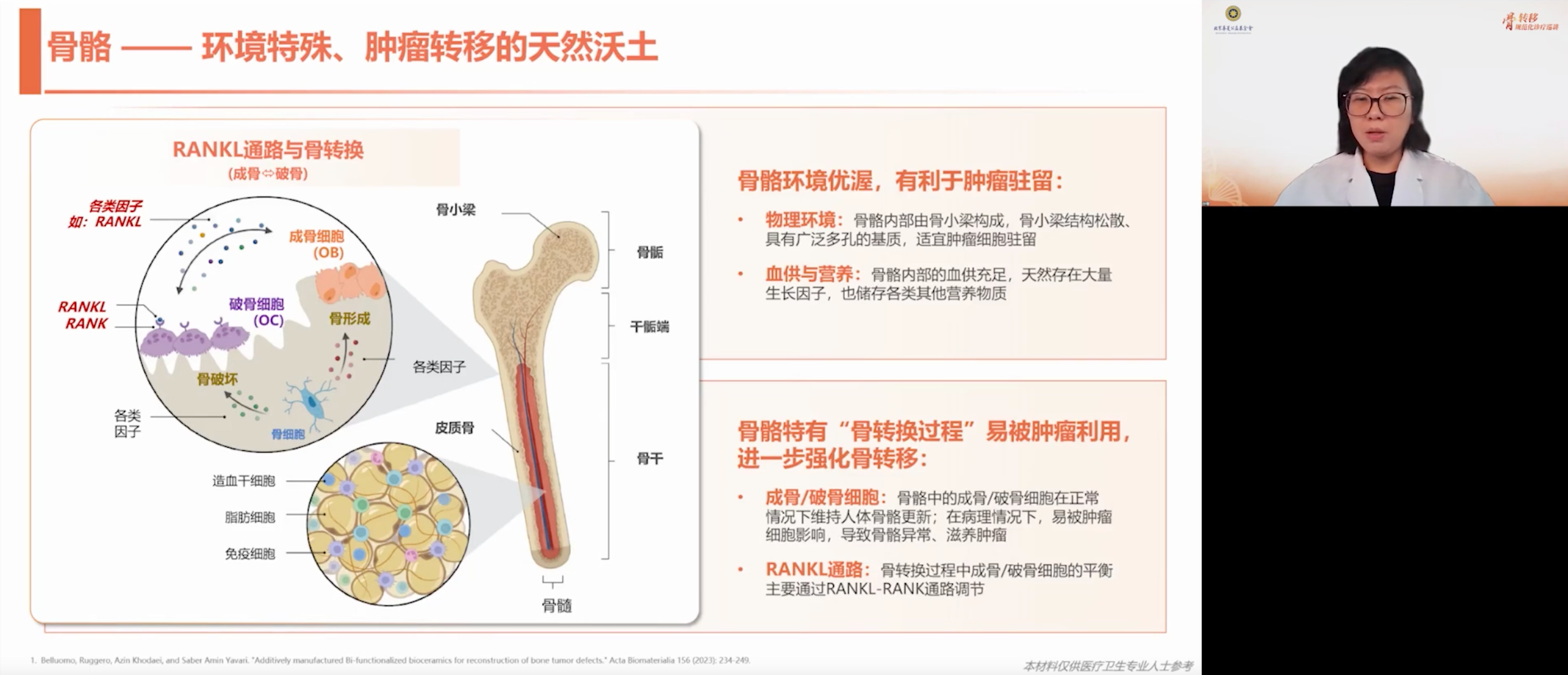
约70%的晚期恶性肿瘤患者会发生骨转移,不同瘤种转移特征差异显著:肺癌等侵袭性肿瘤在早期即可出现骨转移,而乳腺癌骨转移则多发生在原发肿瘤治疗10年后。骨转移可累及全身任何骨骼,人身上有多少骨头,理论上就有多少可以出现转移的位置。其中以脊柱、骨盆等中轴骨最为常见,因其存在松质骨结构、血供丰富且邻近常见原发灶。虽长骨远端转移较少,但需要注意部分肿瘤如甲状腺髓样癌仍有远端转移倾向。因此,在恶性肿瘤的治疗以及观察过程中,一般建议定期检查骨骼情况来帮助更早地识别和判断骨转移情况。

除病理性骨折与脊髓压迫外,骨转移还可引发多种严重并发症,影响原发肿瘤治疗,甚至危及生命。常见如高钙血症,表现为疼痛、麻木、肿胀、活动受限,若未及时处理,可能进展为休克。部分病理性骨折还可能损伤肝脾、肺、直肠、血管及神经等,引发脂肪栓塞、骨筋膜室综合征、感染或截瘫等严重后果。一旦出现重要脏器损伤,患者死亡风险显著升高。
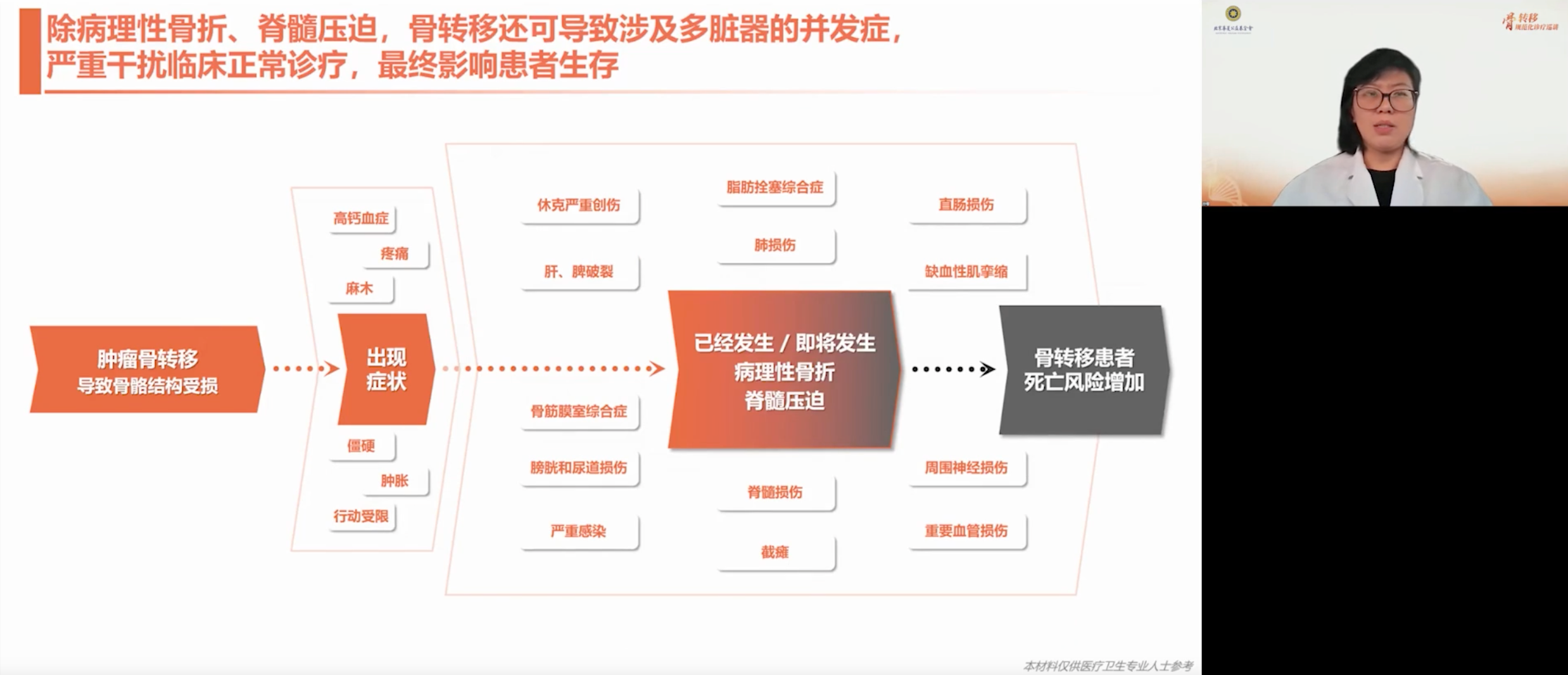
在当前积极抗肿瘤治疗的背景下,骨骼健康不应成为被忽视的隐性威胁。研究显示,肿瘤患者的骨折风险明显高于非肿瘤人群,且除前臂外,各部位骨折均与死亡风险密切相关,尤以病理性骨折发生后的首年风险最高。即便如前列腺癌、乳腺癌等低恶性程度肿瘤,患者在确诊十年后仍可能发生骨折,一旦发生,其死亡风险仍会增加。
骨转移和骨破坏的机制
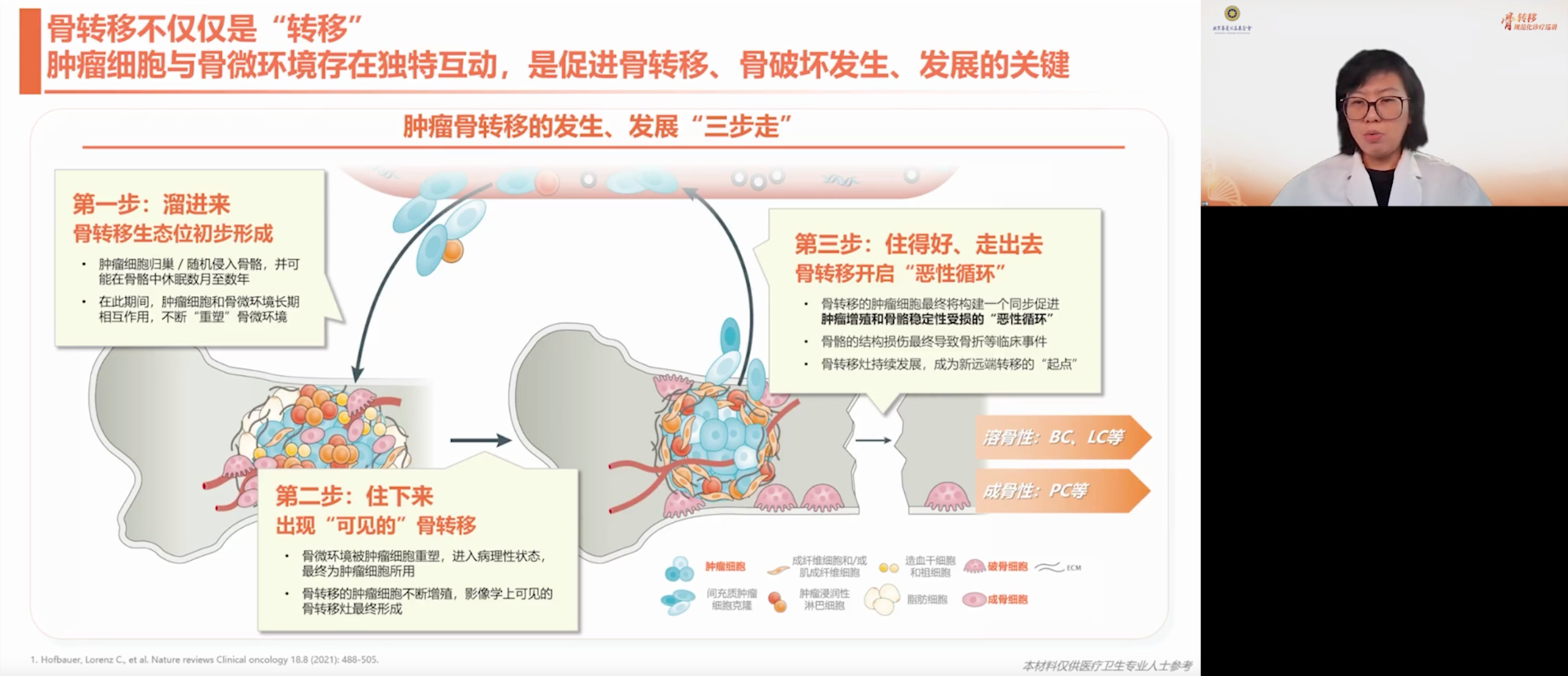
骨转移过程包括两个阶段:首先,肿瘤细胞“溜进来”,归巢至骨内,并且可以在骨骼中长期休眠,与骨微环境相互作用;随后,在微环境被重塑为病理状态后,“住下来”的肿瘤细胞增殖速度和变异速度越来越快,促进骨破坏并加速病灶扩展。
一旦形成影像学可见的骨转移病灶,肿瘤便进入一个同时促进增殖与破坏骨稳定性的恶性循环。病灶发展可引发病理性骨折等并发症,并可能成为新的转移源,促使肿瘤不断扩散,进入“溜进来、住下来、走出去”的循环过程。不同肿瘤类型在骨内的表现并不单一,既可能破坏骨质,也可能伴随异常成骨,进一步扰乱骨的代谢平衡。
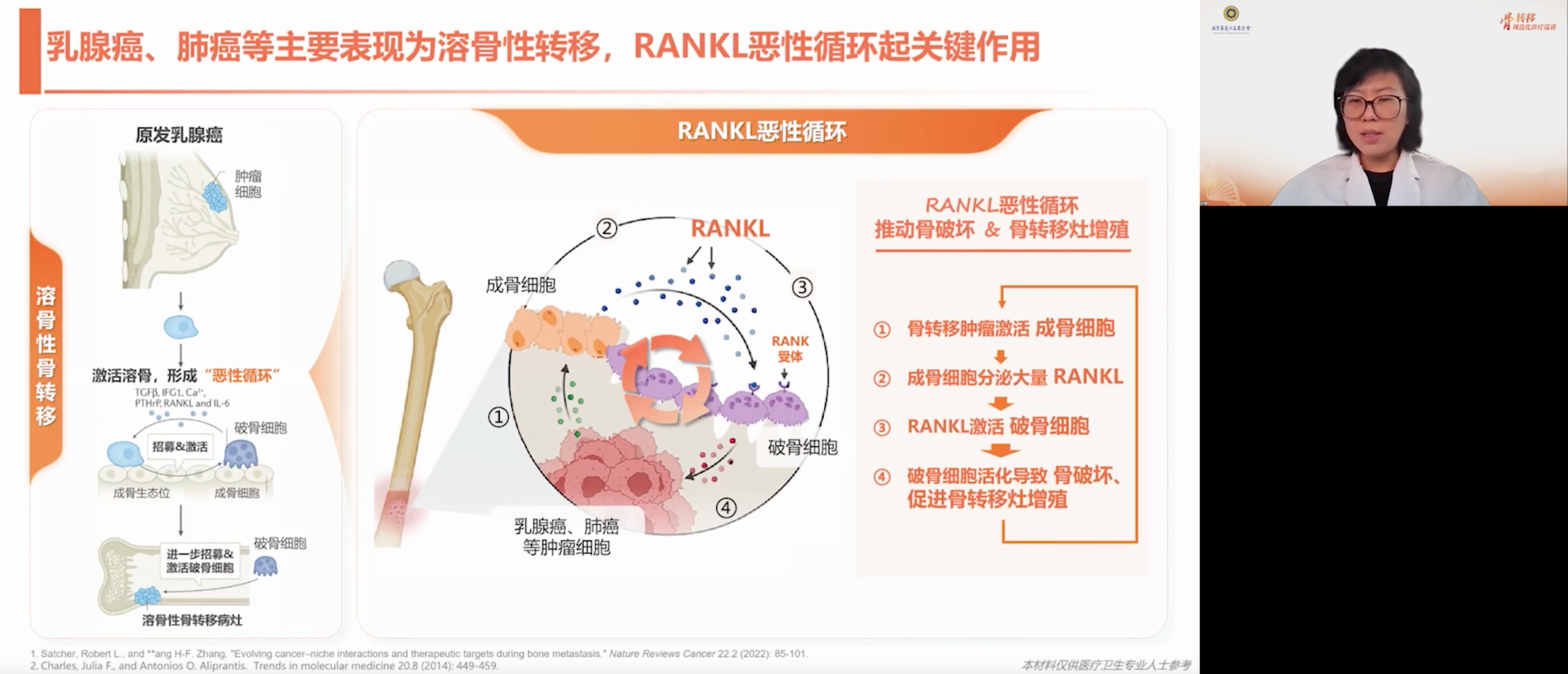
以乳腺癌为例,其肿瘤细胞可同时激活溶骨机制,诱导成骨细胞分泌大量RANKL,进而与破骨细胞表面的RANK结合,增强破骨细胞活性和成熟度,导致局部骨质破坏,影像学上呈现溶骨性改变。此过程正是骨转移“溜进来、住下来、走出去”的典型表现。
前列腺癌的成骨转移机制与其生物学特性(尤其是雄激素受体依赖性特征)密切相关,这使得其主要表现为成骨性转移。在这一过程中,RANK和RANKL通路起到了关键作用,促进了恶性循环。前列腺癌细胞在成骨细胞的作用下表现出类似成骨细胞的形态(骨拟态),并分泌碱性磷酸酶、骨钙素、骨桥蛋白和骨形态发生蛋白(BMP),驱动病理性骨硬化。骨硬化的形成直接大幅活化成骨细胞,同时促进正常的成骨过程,所以会表现出成骨的机制。然而,这一过程同时激活RANKL通路,在促进成骨的同时导致骨破坏,使成骨结构杂乱无章,其形成的骨结构如石膏般松散,在影像学上表现为密度增高,但脆性增加,韧性降低,易发生骨折。此时的成骨并非有益成骨,而是肿瘤转移导致的恶性成骨。
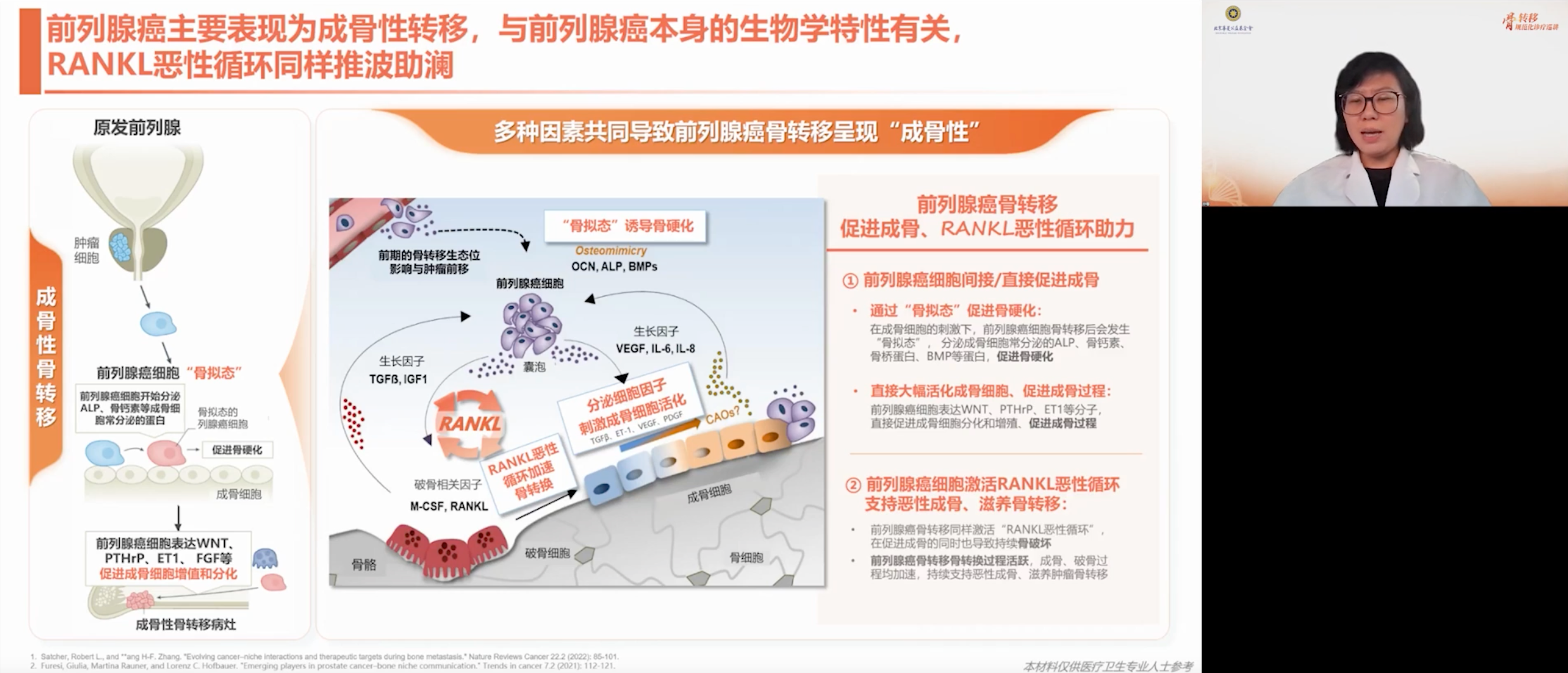
以脊柱的椎体为例,成骨性转移会破坏椎体结构,导致椎体内部受力不均和损伤,并沿着低骨量区域蔓延。因此患者会因翻身、扭腰等意外受力发生椎体压缩性骨折、脊髓压迫,进而诱发椎体功能性失效。如果脊髓受压往后突出,就可能压迫椎管,带来截瘫风险。
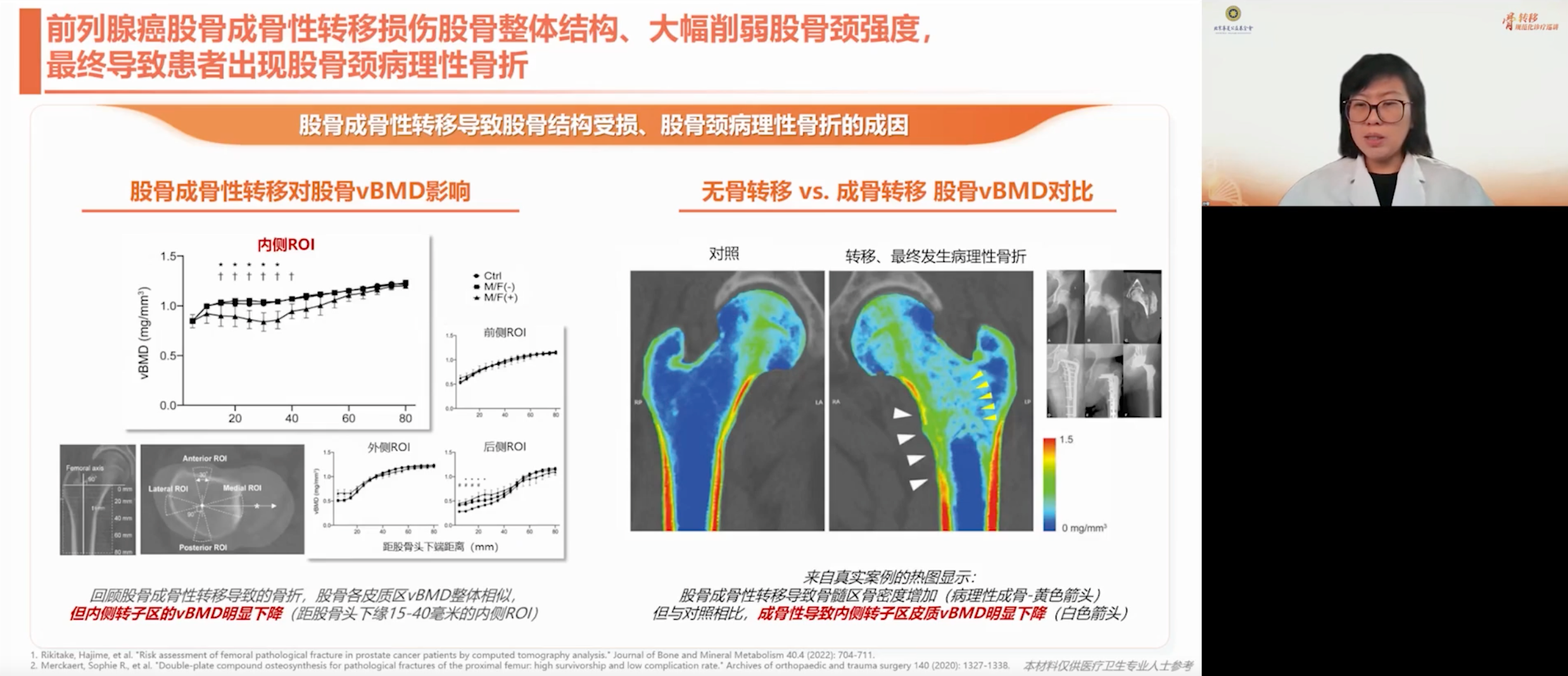
前列腺癌的成骨性转移更倾向累及长骨,这种成骨会削弱皮质骨的强度,进而导致病理性骨折的发生。真实案例的热图显示,股骨成骨性转移导致骨髓区骨密度增加,内侧转子区皮质骨密度明显下降,造成其强度降低。
RANK/RANKL通路是驱动各类型骨转移恶性循环的核心枢纽,它是导致骨破坏、促进骨转移肿瘤增殖的关键,也是骨转移特有的加速器。因此,在治疗骨转移时,需要打破这个恶性循环,让骨的成骨破骨平衡从其中突破出来,才有可能进行有效的肿瘤治疗。
骨转移的治疗目标和骨保护治疗
骨转移可引发多种并发症,显著增加患者死亡风险,因此治疗应同时抑制骨转移、肿瘤进展及骨破坏。单纯控制骨转移无法解决系统性恶性肿瘤;同样,仅控制原发病灶也无法逆转已受损的骨结构。就如白蚂蚁蛀蚀大树,即使蚂蚁被清除,受损的大树仍可能倒塌。因此,治疗需兼顾原发肿瘤与骨转移灶,协同干预,方能实现更优的治疗效果。
当前,骨转移及肿瘤治疗已步入综合治疗阶段,仅依赖化疗、靶向或免疫疗法远远不够,还需结合局部治疗手段,如骨保护治疗、骨放疗、疼痛管理和骨手术等。多模式协同干预,才能实现对骨转移的有效控制,提升患者整体获益。
治疗效果评估可围绕肿瘤的大小活性以及无进展生存期与总生存期等数据进行。对于溶骨性骨破坏,若治疗后骨量和骨强度提升,或病理性骨折风险评分下降,说明干预有效。然而,成骨性破坏会导致细胞周围留存骨基质,X线下,成熟骨质会使成骨范围看似扩大,故影像学难评判骨内病灶,需结合并发症发生情况及生化指标(如血钙、碱性磷酸酶水平)综合评估治疗效果。
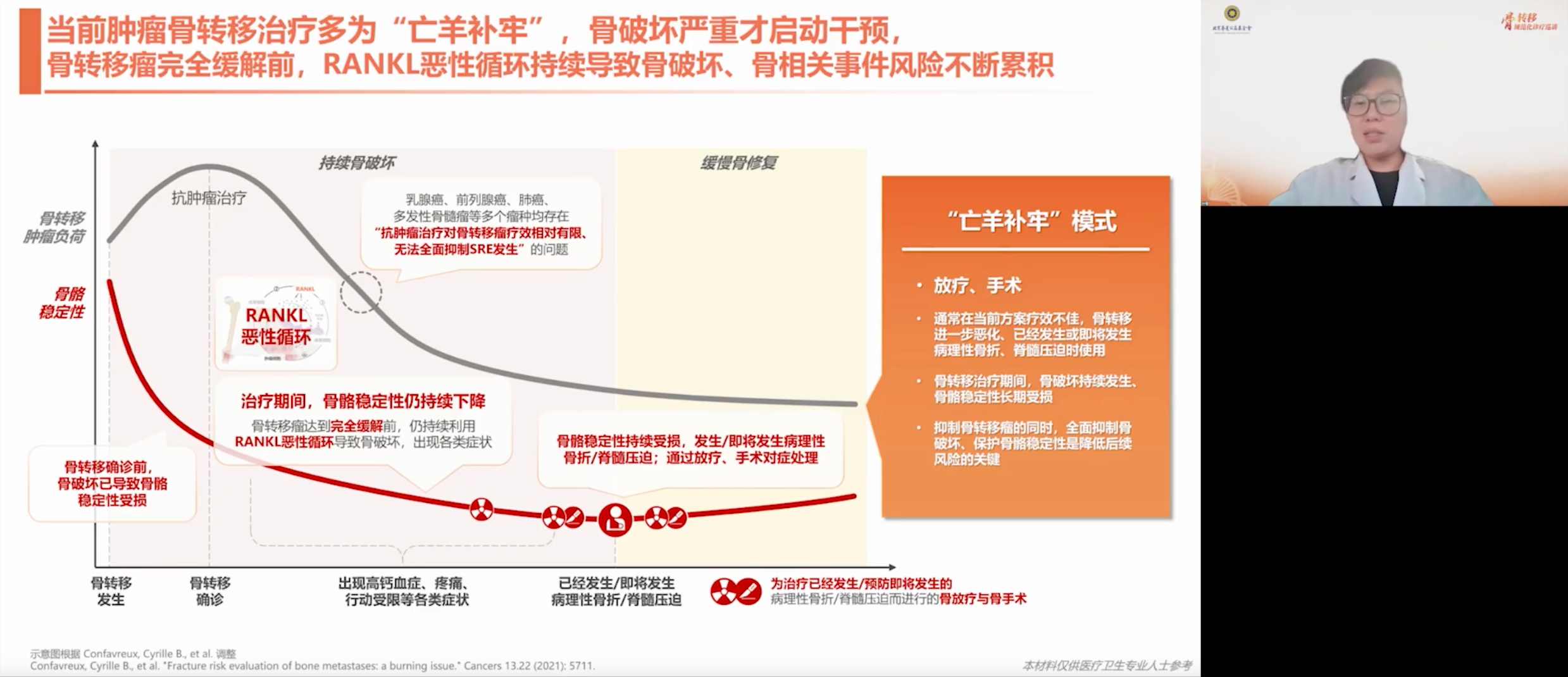
此外,临床上可通过分析骨相关事件(SRE)评估骨保护治疗效果。SRE广义上指骨转移引发的临床问题,主要包括病理性骨折、脊髓压迫,以及为应对这些并发症而进行的骨放疗或骨手术。其发生常提示当前治疗未能有效控制全身肿瘤及骨转移,骨破坏仍在进展。此时需考虑优化治疗策略,加入更有效的干预手段,以延缓或减少SRE的发生。

骨转移治疗整体疗效受多种因素影响,尤其是原发肿瘤控制效果。此外,某些抗肿瘤治疗会影响骨代谢,如乳腺癌内分泌治疗会模拟绝经状态,降低激素水平,进而加重骨质疏松,若合并骨转移,将进一步提高SRE发生风险。因此,治疗需结合不同瘤种、转移部位及个体差异,制定个体化方案,兼顾原发肿瘤与骨转移的双重管理。
局部干预(如手术、放疗)虽可应急处理因骨转移引发的严重并发症,但并不能根治骨转移。患者常误以为切除病灶便可治愈,实际上手术期间会暂停系统治疗,患者的免疫及心理状态在这一时期也通常处于低下状态,可能加速肿瘤发展。因此,局部治疗仅起“救火”作用,整体改善仍需对原发肿瘤的系统治疗以及骨保护药物的使用。
在抗肿瘤治疗中,骨保护治疗不可或缺。骨保护药物旨在打破RANK/RANKL通路恶性循环,实现转移后治疗与转移前预防的双重目标;此外,骨保护药物有助于逐步修复局部骨结构。只有同时遏制骨转移和破坏,维持骨骼稳定,才能有效降低风险。
地舒单抗作为一种RANKL抑制剂,是打破骨转移恶性循环的有效药物,可从根源上抑制治疗期间持续发生的骨破坏。其抑制RANK和RANKL结合,从而抑制破骨细胞的激活,并能改善骨骼的免疫微环境,起到抑制骨破坏、抑制肿瘤转移的作用。

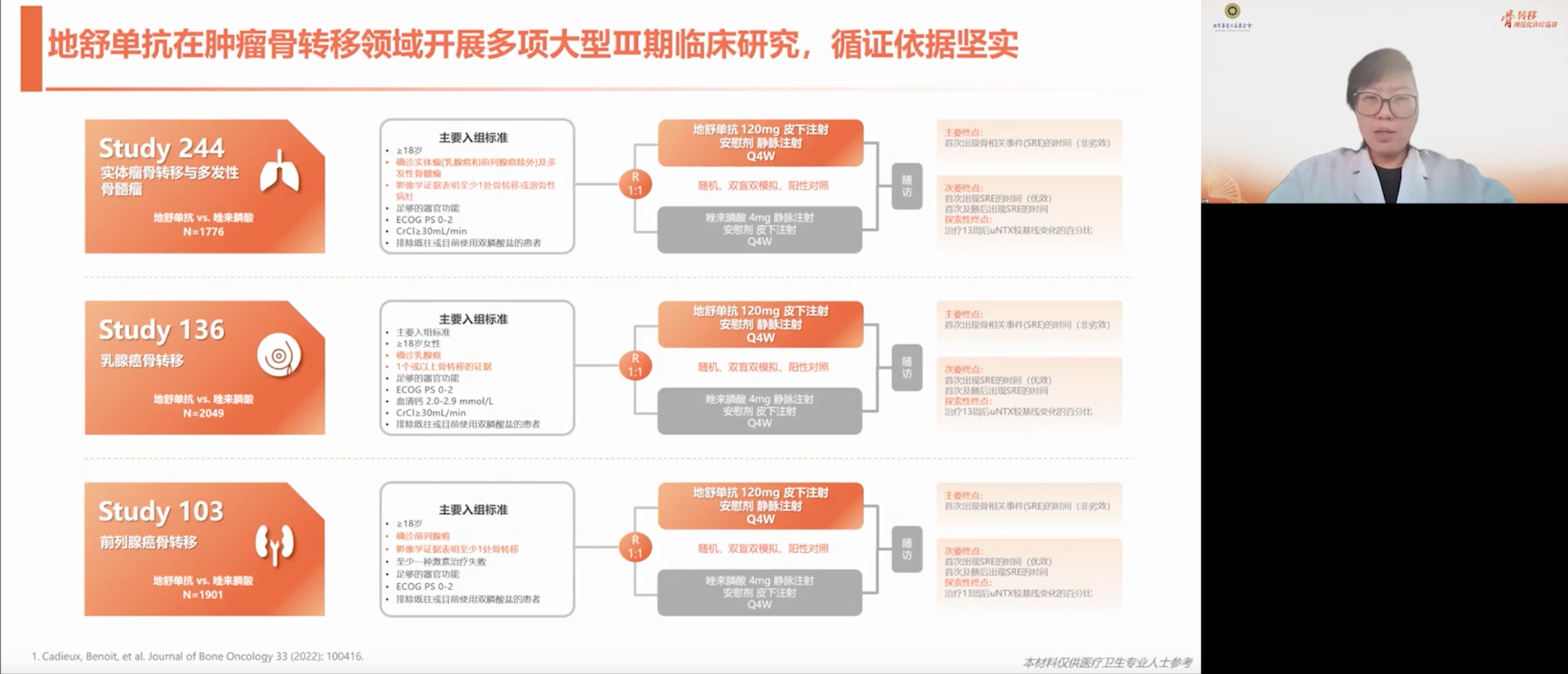
目前,地舒单抗在肿瘤骨转移领域开展了众多临床试验。在与双膦酸盐(如唑来膦酸)的头对头试验,以及针对实体瘤、乳腺癌、多发性骨髓瘤等多种肿瘤的实验中,均取得了良好效果,临床数据表现优异,安全性良好。
骨转移患者使用地舒单抗,可大幅降低病理性骨折、脊髓压迫的风险,也能大幅降低为预防或治疗以上事件而进行骨放疗、骨手术的风险,首次发生SRE的时间大幅延迟。此外,地舒单抗在与放疗、手术等其他治疗手段联合应用时,具有协同增益作用。有数据表明,地舒单抗与放疗协同可降低骨放疗引发的骨髓风险。放疗后,使用地舒单抗能提升骨骼强度,联合手术时,地舒单抗促进硬骨痂形成和重塑,有助于骨折预后改善,加速病理性骨折恢复。基于循证优势,地舒单抗已成为骨保护治疗的基石性选择。
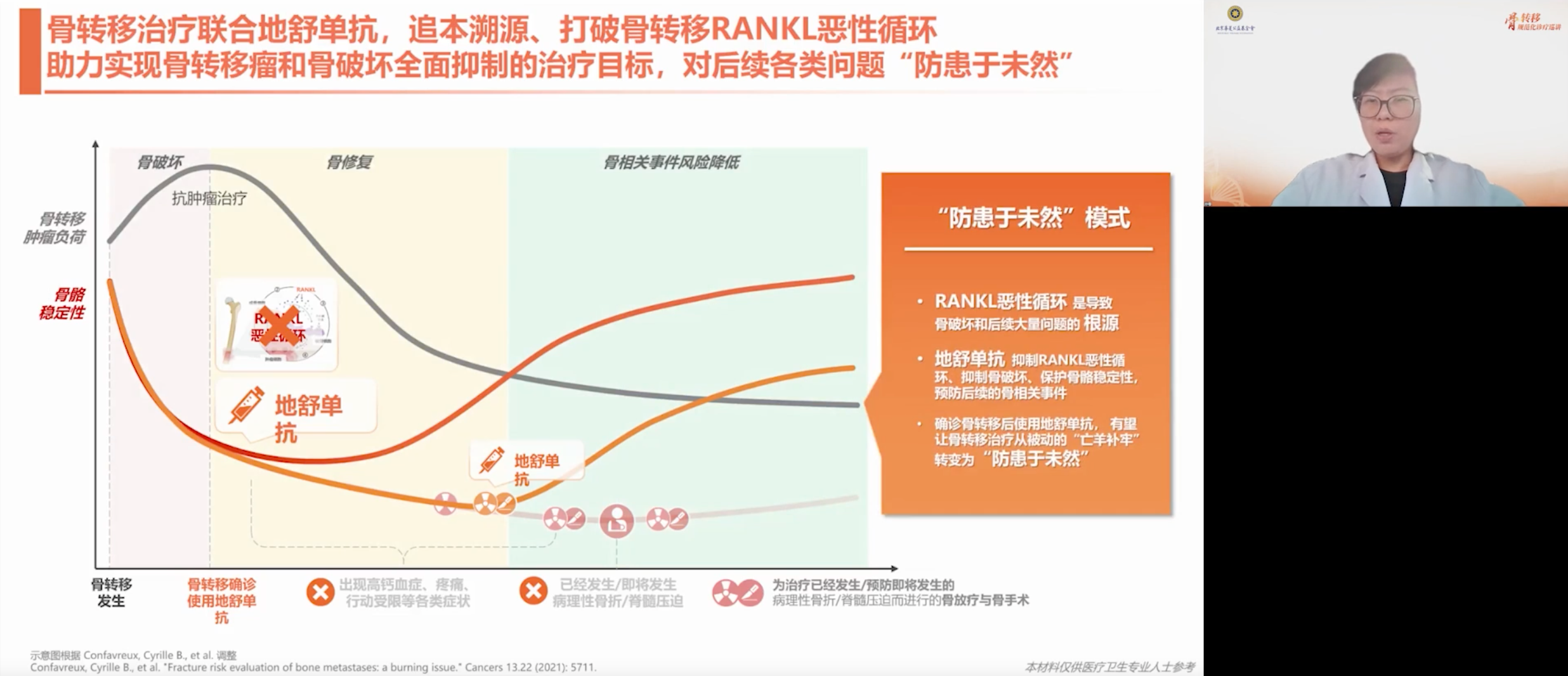
肿瘤骨转移是一种复杂且常见的临床问题。在抗肿瘤治疗中,我们应高度重视骨健康管理,通过系统与局部多模式协同干预,特别是合理应用骨保护治疗,预防或延缓SRE的发生,提升患者生活质量与总体生存。
排版编辑:肿瘤资讯-IRIS











 苏公网安备32059002004080号
苏公网安备32059002004080号


