肺外神经内分泌癌(epNEC)是一类侵袭性极强的恶性肿瘤,可发生在肺外各个身体部位,如胃肠胰腺、泌尿生殖系统等。对于晚期epNEC,一线治疗主要采用含铂化疗方案,虽客观缓解率可达60%~70%,但缓解持续时间较短,中位无进展生存期仅约4~6个月。而针对二线及以后的患者,目前缺乏标准治疗方案,临床多以化疗为主,其客观缓解率仅为20%~30%,疗效十分有限[1]。由于epNEC具有罕见性和异质性特点,给临床研究带来极大挑战,因此该治疗领域迫切需要创新药物,以使患者获得更优的生存益处。
2025年美国临床肿瘤学会(ASCO)年会上公布了多项关于epNEC人群的最新临床研究结果,为epNEC的精准治疗带来崭新的希望。本文特邀西安交通大学第一附属医院的吴胤瑛教授,深入解析ASCO年会上公布的T细胞衔接器(TcE)、抗体偶联药物(ADC)和双特异性抗体(BsAb)等新兴疗法在epNEC人群中的临床研究探索,挖掘DLL3、SEZ6等靶点在epNEC治疗领域的潜在临床价值。希望能为临床医生提供全面的学术视角,以期更好地理解和应用这些创新疗法。
专家介绍
吴胤瑛 教授
副主任医师,医学博士
西安交通大学第一附属医院肿瘤内科
CSCO胆道肿瘤专家委员会常委
CSCO神经内分泌肿瘤专委会委员
CSCO青年专家委员会委员
CSCO结直肠专家委员会委员
国家药品食品监督管理局临床试验现场数据核查专家
中国抗癌协会肿瘤靶向治疗专业委员会青委会委员
陕西省抗癌协会肿瘤生物治疗青年委员会主任委员
陕西省抗癌协会神经内分泌肿瘤专业委员会副主任委员
陕西省抗癌协会抗癌药物专业青年委员会副主任委员
陕西省抗癌协会综合治疗专业青年委员会副主任委员
深入探讨DLL3靶点疗效预测功能,TcE疗法在肺外神经内分泌癌再破局
Delta样配体3(DLL3)是Notch信号通路的抑制性配体,其高表达时对神经内分泌癌(NEC)肿瘤表型维持及发生发展意义重大[2]。正常成人细胞表面几乎不表达DLL3,但其在各部位NEC肿瘤细胞表面广泛存在。在肺NEC中,约75%~80%的小细胞癌(SCLC)患者表达DLL3[3];胃肠胰、膀胱、前列腺、宫颈等部位的epNEC患者,DLL3表达比例为68%~81%[4]。这使得DLL3成为NEC理想的治疗靶点。目前,DLL3靶向TcE类药物在SCLC人群中的疗效探索如火如荼,而在epNEC群体中,其临床价值仍需进一步探索。
1438.1研究:Obrixtamig单药治疗在二线及以后epNEC中的I期临床研究(Abstract 3004)
Obrixtamig(BI 764532)是一种DLL3/CD3 IgG样双特异性TcE,通过同时结合肿瘤细胞上的DLL3和T细胞上的CD3来诱导肿瘤细胞裂解。1438.1研究(NCT04429087)是一项正在进行的I期剂量递增试验,其中纳入了DLL3阳性(DLL3+)肺部和肺外NEC患者,这些患者对标准治疗无效。今年ASCO会议公布的数据重点关注了Obrixtamig在epNEC患者中的治疗效果,基于DLL3表达情况对epNEC的疗效和安全性差异进行了分析[5]。
Obrixtamig通过静脉注射,采用多种剂量递增方案(RA、RB1、RB2、RB3),直至疾病进展(PD)或出现不可接受的毒性。DLL3高表达定义为≥50%的肿瘤细胞被DLL3抗体(SP347,Roche Diagnostics)染色。截至2024年6月21日,共纳入60例epNEC患者,其中DLL3高表达组和DLL3低表达组各30例。患者来源包括胃肠胰腺(GEP):45.0%,泌尿生殖系统(GU):30.0%,其他/原发灶不明:25.0%。两组患者的基线特征(如中位年龄、既往治疗线数)平衡。所有患者均接受过既往全身治疗,其中DLL3高表达组和低表达组均有30.0%的患者接受过>2线治疗。
数据显示,DLL3高表达患者的客观缓解率(ORR)、疾病控制率(DCR)和缓解持续时间(DoR)均显著高于DLL3低表达患者。
DLL3高表达组(n=30):ORR 40.0%(95%CI:25%~58%),DCR 67%(95%CI:49%~81%)(图1),中位DoR 7.9个月[95%CI:6.2个月~不可评估(NE)]。
在DLL3高表达患者中,胃肠胰腺和泌尿生殖系统epNEC患者的ORR最高,分别为50.0%和60.0%。有7例DLL3高表达患者仍在接受治疗。DLL3低表达组(n=30):ORR 3%(95%CI:1%~17%),DCR 27%(95%CI:14%~44%)(图1),中位DoR 2.8个月(95%CI:NE~NE)。
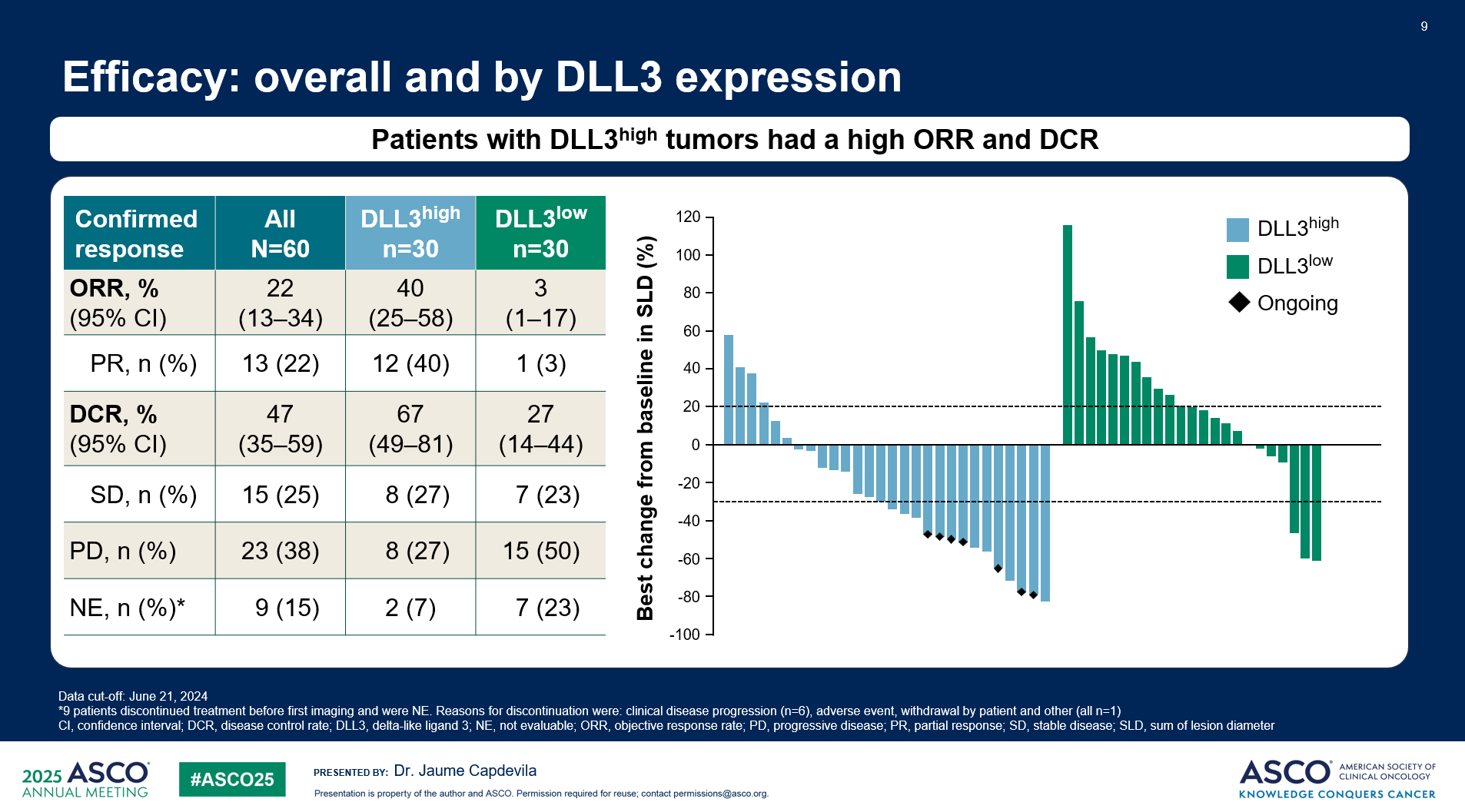
安全性方面,大多数治疗相关不良事件(TRAE)为轻度至中度,且DLL3高表达组和低表达组之间的安全性可比。在DLL3高表达组,≥3级TRAE发生率为23.3%,≥3级CRS发生率为3.3%,≥3级神经毒性[包括免疫效应细胞相关神经毒性综合征(ICANS)]发生率为6.7%。
高级别NEN新靶点,SEZ6靶向ADC药物初步探索
人类癫痫相关同源物6(SEZ6)是神经内分泌肿瘤组织中特异性表达的跨膜蛋白。正常情况下,其主要在神经系统(脑、垂体等)表达,参与神经树突形成及信号传递,而在气管、心脏、胃等大多数组织中低表达;但在神经内分泌肿瘤中,SEZ6表达显著升高[6],因此SEZ6靶点被视为神经内分泌肿瘤潜在的治疗靶点。
NCT05599984:ABBV-706在复发/难治性高级别NEN中的I期临床研究(Abstract 105)
ABBV-706是一种靶向SEZ6靶点的ADC药物,有效载荷为强效拓扑异构酶1抑制剂。NCT05599984是一项I期剂量递增和扩展队列研究,在晚期实体瘤患者中开展。本次ASCO大会主要报道了ABBV-706在复发/难治性高级别神经内分泌肿瘤(NEN)患者中的疗效及安全性[7]。
患者通过静脉注射接受1.3~3.5 mg/kg ABBV-706,每3周一次。截至2025年1月3日,共有65例NEN患者入组,其中包括大细胞NEC、胃肠胰NEC(GEPNEC)、甲状腺髓样癌(MTC)、神经内分泌前列腺癌(NEPC)、NET G3和其他NEC。患者中位既往治疗线数为3(范围1~8)。
在65例NEN患者中,整体ORR为36.9%,中位DoR为6.37个月(95%CI:4.44~9.46个月),中位无进展生存期(PFS)为7.62个月(95%CI:5.52~8.31个月)(图2)。不同NEN亚型ORR表现有一定差异:NEPC亚组为60.0%(3/5),GEPNEC亚组为23.1%(3/13),NET G3亚组为33.3%(2/6)。
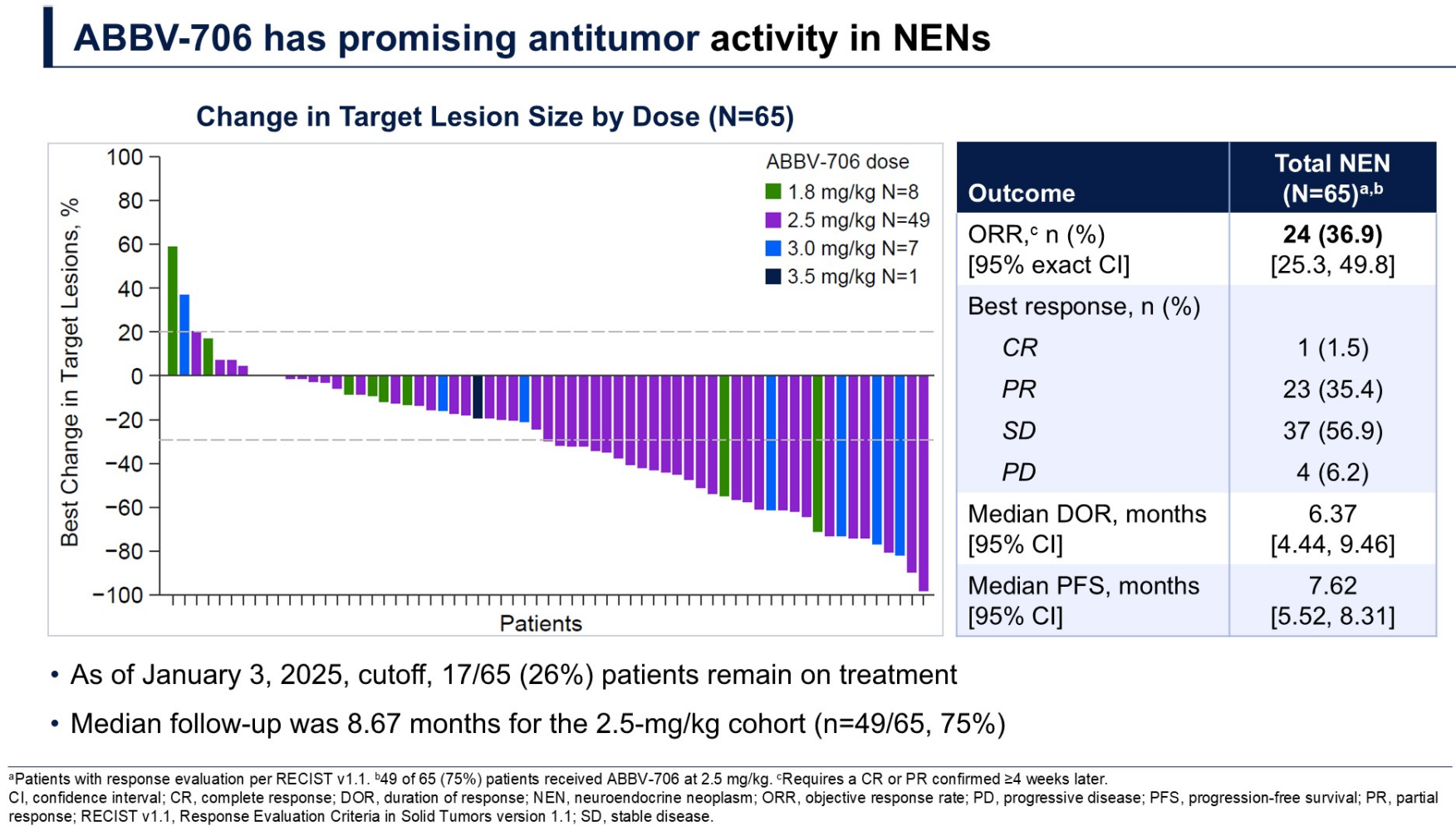
所有级别治疗期间不良事件(TEAE)发生率为95%,其中≥3级TRAE发生率为79%。最常见的血液学TEAE包括贫血(所有级别/≥3级:60.0%/49.2%)、中性粒细胞减少症(所有级别/≥3级:50.8%/41.5%)、血小板减少症(所有级别/≥3级:33.8%/20.0%)等。未判定的肺炎/间质性肺病发生率为3%(其中≥3级1例)。ABBV-706的安全性特征在各个NEN亚型中相似。
免疫治疗挑战“冷肿瘤”,PD-L1/4-1BB BsAb在epNEC展现有效信号
4-1BB是T细胞表面一种激活型免疫检查点分子,也称为CD137,主要在抗原启动的T细胞上表达。PD-L1是PD-1的配体,可以抑制CD8+T细胞增殖,帮助肿瘤免疫逃逸。同时靶向PD-L1和4-1BB一方面可以解除PD-1/PD-L1免疫抑制,同时通过4-1BB共刺激作用有效聚集和激活T细胞,增强免疫性抗肿瘤活性,以期改善双特异性抗体在epNEC等“冷肿瘤”中的治疗效果[8]。
NCT06157827:LBL-024联合标准治疗(SOC)在晚期NEC一线治疗的Ⅰb/Ⅱ期临床研究(Abstract 2500)
LBL-024是一款PD-L1/4-1BB双特异性抗体。ASCO大会报道了LBL-024的一项在晚期NEC人群中开展的剂量递增(Ⅰb期)和剂量优化/扩展(Ⅱ期)临床试验的初步结果,评估了不同剂量水平LBL-024联合EP/EC(每三周一次)治疗一线晚期NEC患者的疗效及安全性[9]。
截至2025年4月15日,Ⅰb期共入组15例患者(包括SCLC、MiNEN及epNEC),Ⅱ期共入组40例epNEC患者。在52例疗效可评估患者中,ORR为75.0%,DCR为92.3%(表1)。其中,共18例epNEC患者接受15mg/kg(RP2D)LBL-024与EP/EC联合治疗,一线治疗ORR达到83.3%(15/18),DCR为100%(18/18)(表1)。
表1. NCT06157827疗效分析(截至2025年4月15日)
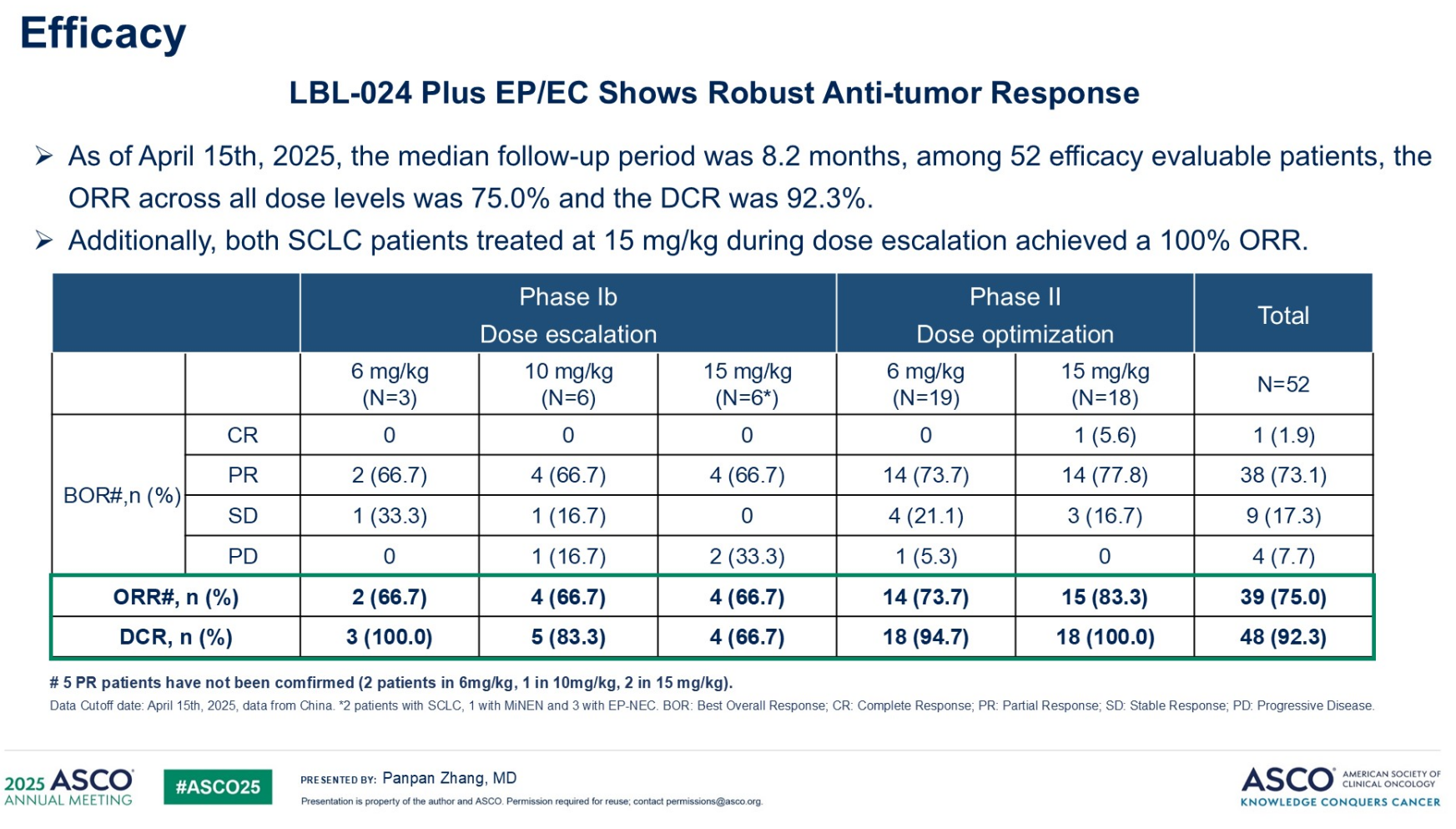
在15mg/kg(RP2D)剂量水平,所有级别TRAE发生率为100%,其中≥3级TRAE发生率为76.9%。免疫相关不良反应(irAE)发生率为34.6%(≥3级irAE发生率为15.4%)。
专家点评
晚期epNEC作为一种罕见的、高度异质性的“冷肿瘤”,长期面临治疗方案缺乏、疗效有限的临床挑战。2025 ASCO大会公布的DLL3/CD3 TcE、SEZ6 ADC和PD-L1/4-1BB BsAb等研究数据为epNEC靶向治疗带来了重要突破,从不同角度为当前epNEC治疗的困境提出解决思路。
一方面,epNEC缺乏广泛的驱动基因突变,因此限制了传统靶向治疗在epNEC治疗领域的应用[10]。然而,DLL3及SEZ6等靶点在神经内分泌癌细胞上具有异常性过表达,而在正常组织中表达有限。靶向这些肿瘤特异性抗原的药物设计为epNEC的精准治疗提供了新的可能[4,6]。Obrixtamig在epNEC中的I期剂量爬坡研究结果,特别是其在DLL3高表达患者中展现出的40%的ORR和7.9个月的DoR,为epNEC后线治疗的未满足需求带来了突破。更重要的是,该研究提示DLL3高表达(定义为≥50%肿瘤细胞DLL3阳性)与Obrixtamig在epNEC人群中的疗效具有潜在关联(高表达组ORR 40% vs 低表达组ORR 3%)[5],为后续临床试验的人群选择提供了证据,也强烈提示DLL3表达在epNEC中可能具有重要的预测性生物标志物价值,可能作为未来临床筛选潜在获益患者的工具。值得注意的是,在SCLC人群中开展的临床试验似乎并未观察到DLL3表达对靶向DLL3的TcE药物的疗效具有影响[11],这种差异恰恰强调了在不同肿瘤类型中进行DLL3表达检测和患者分层的必要性,这对于实现epNEC的精准治疗至关重要。
另一方面,传统免疫治疗,如PD-(L)1免疫检查点抑制剂,在epNEC这类“冷肿瘤”中的治疗效果尚未得到临床证据支持。然而,TcE及BsAb等新一代免疫疗法为epNEC的各线治疗注入新的活力。Obrixtamig作为DLL3/CD3 TcE,通过桥接epNEC肿瘤细胞表面的DLL3和T细胞表面的CD3,有助于将T细胞重定向至epNEC肿瘤细胞附近,重塑肿瘤微环境,激活免疫杀伤[5]。另一方面,LBL-024双抗从机制上可以同时通过结合PD-L1和4-1BB解除肿瘤微环境的免疫抑制状态,并促进T细胞活化,以增强抗肿瘤免疫反应[9]。
尽管DLL3、SEZ6和PD-L1/4-1BB等靶向治疗为epNEC患者带来了全新希望,但该领域仍存在诸多值得进一步探索的方向。基于epNEC的肿瘤异质性(包括细胞亚型异质性、部位异质性、肿瘤内部异质性等),深入研究DLL3和SEZ6等新兴靶点在不同类型epNEC中的表达差异以及动态变化监测至关重要。同时,对于潜在具有疗效预测性功能的靶点,未来仍需建立标准化的检测方法和阈值界定,以指导患者精准筛选。另外,随着靶向药物临床研究的不断深入,对于耐药机制的研究以及克服耐药策略的探索也至关重要。鉴于epNEC的罕见性,推动国际性epNEC登记数据库的建立有助于整合真实世界数据,进一步支持epNEC治疗领域的药物研究和临床开发。随着对epNEC肿瘤生物学和免疫微环境认识的不断加深,epNEC患者将实现从“无药可用”到“精准治疗”的历史性跨越。
1. Stumpo, S. et al. Extrapulmonary Neuroendocrine Carcinomas: Current Management and Future Perspectives. J. Clin. Med. 12, 7715 (2023).
2. D’Souza, B., Meloty-Kapella, L. & Weinmaster, G. Chapter Three Canonical and Non-Canonical Notch Ligands. Curr. Top. Dev. Biol. 92, 73–129 (2010).
3. Tanaka, K. et al. Prevalence of Delta-like protein 3 expression in patients with small cell lung cancer. Lung Cancer 115, 116–120 (2018).
4. Yao, J. et al. DLL3 as an Emerging Target for the Treatment of Neuroendocrine Neoplasms. Oncol. 27, 940–951 (2022).
5. Capdevila, J. et al. Efficacy and safety of the DLL3/CD3 T-cell engager obrixtamig in patients with extrapulmonary neuroendocrine carcinomas with high or low DLL3 expression: Results from an ongoing phase I trial. J. Clin. Oncol. 43, 3004–3004 (2025).
6. Wiedemeyer, W. R. et al. ABBV-011, A Novel, Calicheamicin-Based Antibody–Drug Conjugate, Targets SEZ6 to Eradicate Small Cell Lung Cancer Tumors. Mol. Cancer Ther. 21, 986–998 (2022).
7. Cooper, A. J. et al. Safety and efficacy of ABBV-706, a seizure-related homolog protein 6 (SEZ6)–targeting antibody-drug conjugate, in high-grade neuroendocrine neoplasms. Presentation presented at 2025 American Society of Clinical Oncology's (ASCO) Annual Meeting; American Society of Clinical Oncology
8. Lu, M. et al. A novel and uniquely designed bispecific antibody (LBL-024) against PD-L1 and 4-1BB in patients with advanced malignant tumors and neuroendocrine carcinoma: A report of safety and robust efficacy of LBL-024 monotherapy in phase I/II, first-in-human, open-label, multicenter, dose escalation/expansion study. J. Clin. Oncol. 42, 4010–4010 (2024).
9. Lu, M. et al. Assessment of efficacy of LBL-024, a novel and uniquely designed bispecific antibody against PD-L1 and 4-1BB, combined with etoposide/platinum-based chemotherapy in treatment-naive advanced extrapulmonary neuroendocrine carcinoma (EP-NEC): A multicenter phase Ib/II trial. Presentation presented at 2025 American Society of Clinical Oncology's (ASCO) Annual Meeting; American Society of Clinical Oncology
(ASCO) Meeting; May 30–June 3, 2025. Chicago, IL.
10. Vijayvergia, N. et al. Molecular profiling of neuroendocrine malignancies to identify prognostic and therapeutic markers: a Fox Chase Cancer Center Pilot Study. Br. J. Cancer 115, 564–570 (2016).
11. Ahn, M.-J. et al. Tarlatamab for Patients with Previously Treated Small-Cell Lung Cancer. N. Engl. J. Med. 389, 2063–2075 (2023).
审批编号:SC-CN-16818
排版编辑:肿瘤资讯-Delia











 苏公网安备32059002004080号
苏公网安备32059002004080号


