2020年,中国的新发癌症病例数占全球的23.7%,预计未来这一比例将持续上升,因此癌症防控已成为公共卫生的紧迫任务[1]。神经营养因子受体络氨酸激酶(NTRK)基因融合作为泛瘤种致癌驱动因子这一重要发现,为实体瘤诊疗带来新突破。目前,针对NTRK基因融合的精准检测技术开发及其靶向治疗(如TRK抑制剂)的临床应用,为肿瘤精准治疗领域的发展提供重要方向。
NTRK基因:揭开泛瘤肿的共同治疗靶点
NTRK基因(NTRK1/2/3)编码的促肌球蛋白受体激酶(TRK)在神经系统发育中起关键作用,NTRK基因融合导致的组成型活性TRK融合蛋白的表达,已成为成人和儿童实体瘤的重要致癌机制[2,3]。NTRK基因融合在特定瘤种中呈现显著高发趋势,如成人分泌性乳腺癌、唾液腺分泌性癌、婴儿纤维肉瘤和先天性中胚层肾瘤中检出率高达90%,但在常见肿瘤(如非小细胞肺癌和结直肠癌)中检出率相对较低[3,4]。NTRK基因融合的发现,成为首个“泛瘤种”靶向治疗的理想靶点,实现了不限年龄、不限组织学类型实体瘤的精准治疗突破。
拉罗替尼创疗效新高:一线治疗成人和儿童实体瘤ORR达77%,PFS超5年!
拉罗替尼是全球首个获批用于治疗成人和儿童TRK融合阳性实体瘤靶向药物。最新发布的拉罗替尼一线治疗成人和儿童实体瘤患者数据,为临床实践提供了强有力的循证依据[5]。
研究方法
本研究纳入既往未接受过系统治疗的转移性或不可切除NTRK基因融合成人和儿童患者,且参与过以下三项拉罗替尼临床试验中的任意一项:针对≥18岁患者的I期试验(NCT02122913)、针对≤21岁患者的I/II期SCOUT试验(NCT02637687),以及针对≥12岁患者的II期NAVIGATE“篮子试验”(NCT02576431)。主要终点为总缓解率(ORR),次要终点包括至缓解时间(TTR)、缓解持续时间(DoR)、无进展生存期(PFS)和总生存期(OS)。
研究结果
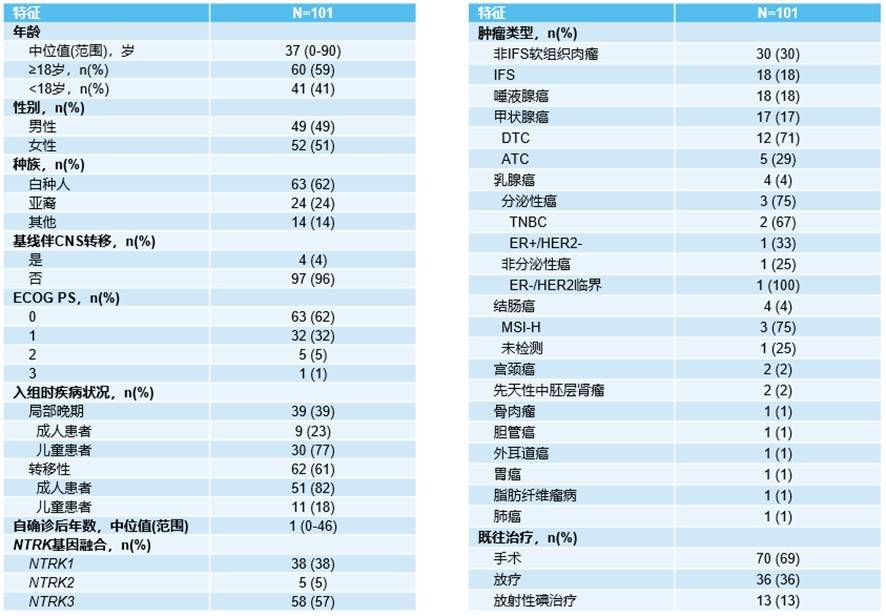
截至2023年7月20日,共入组101例接受拉罗替尼一线治疗的NTRK基因融合患者,包括59%的成人患者和41%的儿童患者,共涉及14种不同的肿瘤类型,其中NTRK3为常见的基因融合类型(表1)。
表1 患者基线特征
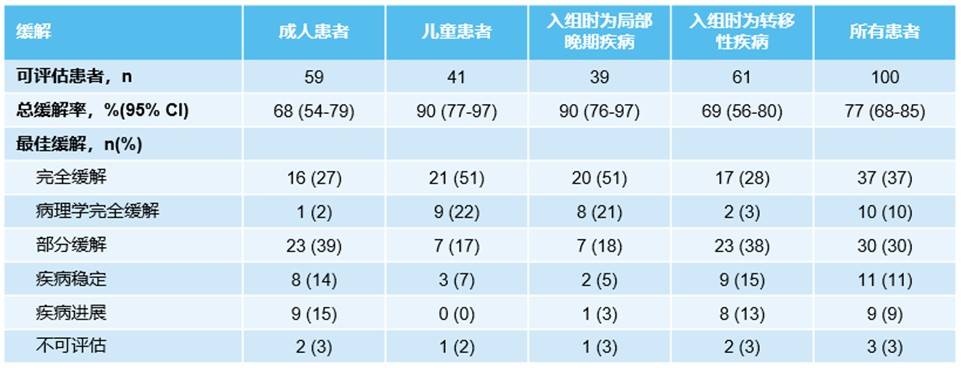
ORR:数据截止时,100例疗效可评估患者的ORR为77%(95% CI 68%-85%),其中47%的患者达到完全缓解(其中10例为病理学完全缓解)。对于成人和儿童患者,ORR分别为68%(95% CI 54%-79%)和90%(95% CI 77%-97%),入组时为局部晚期和转移性患者的ORR分别为90%(95% CI 76%-97%)和69%(95% CI 56%-80%)(表2,图1)。
表2 拉罗替尼治疗的最佳缓解
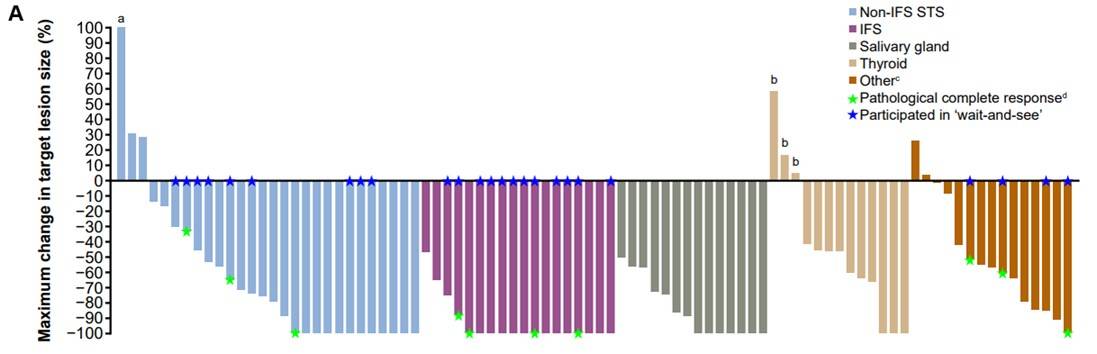
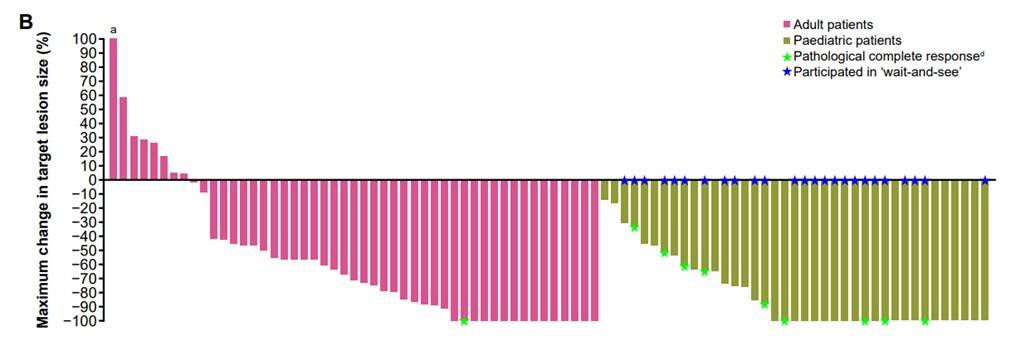
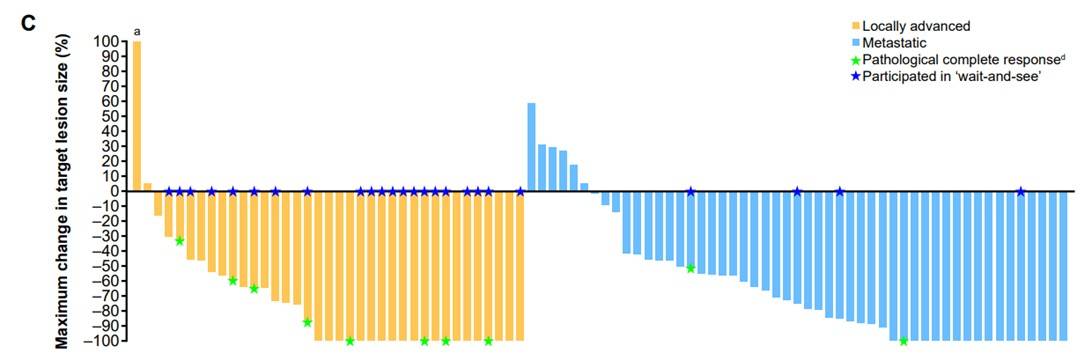
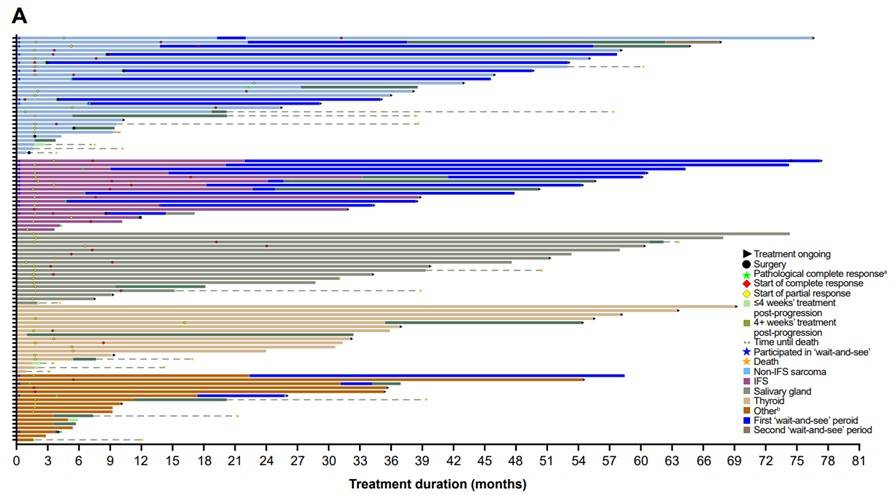
治疗持续时间和至缓解时间:所有患者的中位至缓解时间为1.8个月,治疗持续时间为0至77+个月。成人患者和儿童患者的治疗持续时间分别为0至74+个月和1至77+个月,入组时为局部晚期和转移性患者的治疗持续时间分别为2至77+个月和0至74+个月。截至数据分析时,47例(47%)患者仍在接受治疗,42例(42%)患者疾病进展,其中26例在进展后继续或重启治疗(图2)。
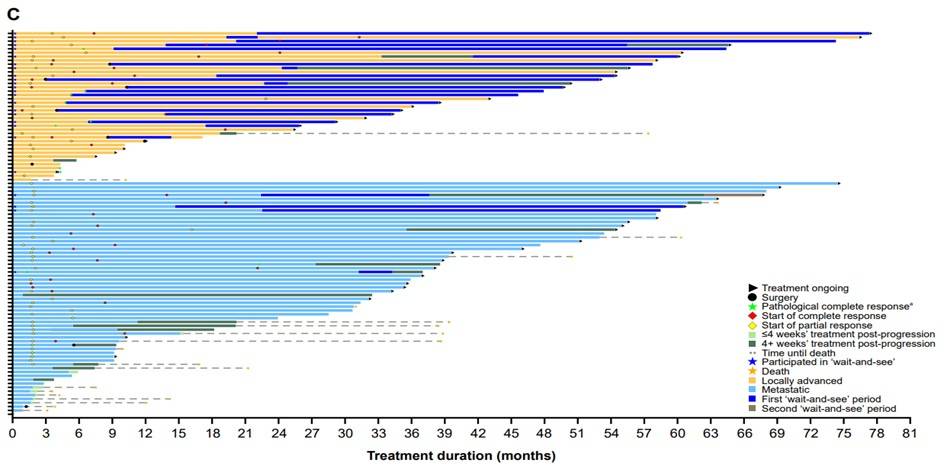
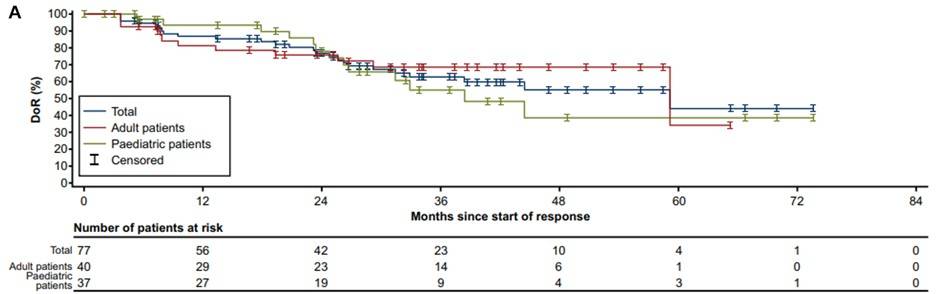
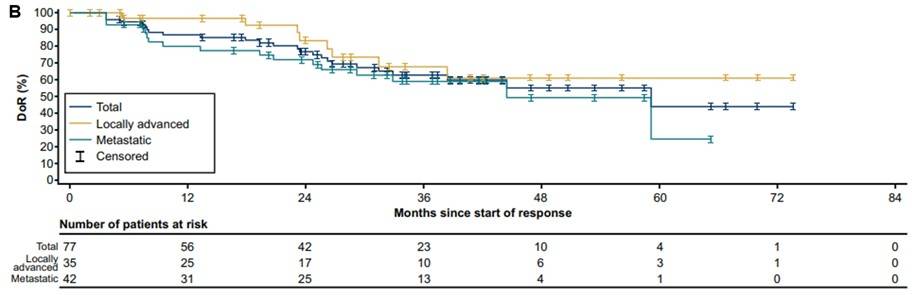
DoR:所有初治患者的中位DoR为59个月(95% CI 33-NE),成人和儿童患者的中位DoR分别为59个月(95% CI 59-NE)和38个月(95% CI 26-NE),入组时为局部晚期患者的中位DoR尚未达到(95% CI 27-NE),转移性患者为45个月(95% CI 26-NE)(图3)。
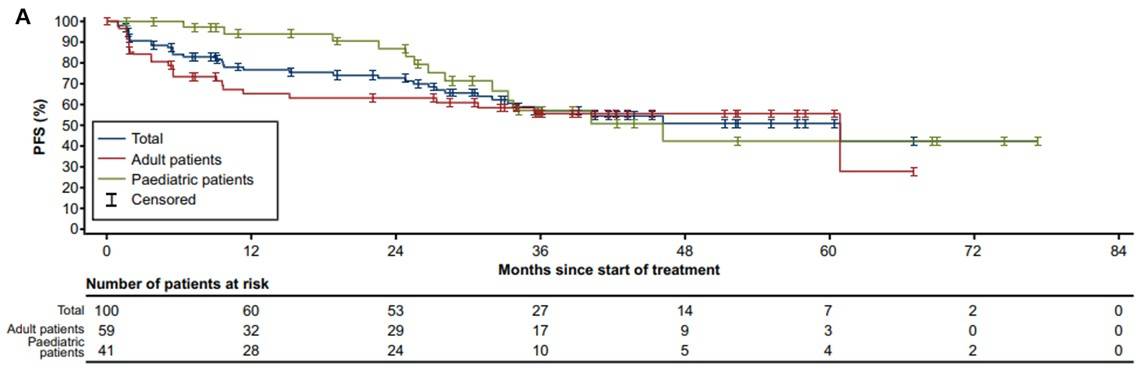
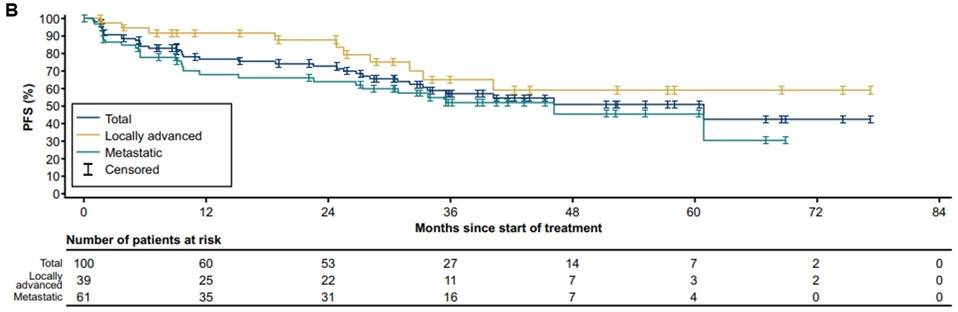
PFS:所有初治患者的中位PFS为61个月(95% CI 33-NE)。成人和儿童患者的中位PFS分别为61个月(95% CI 15-NE)和46个月(95% CI 32-NE),入组时为局部晚期和转移性患者的中位PFS分别为未达到(95% CI 32-NE)和46个月(95% CI 23-NE)(图4)。
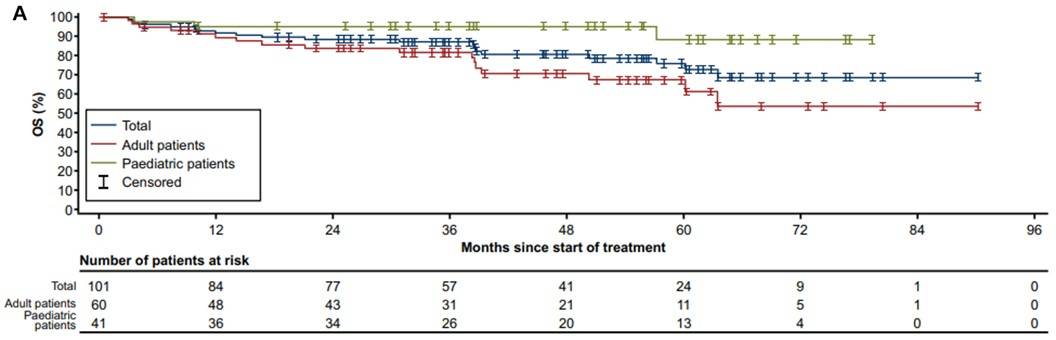
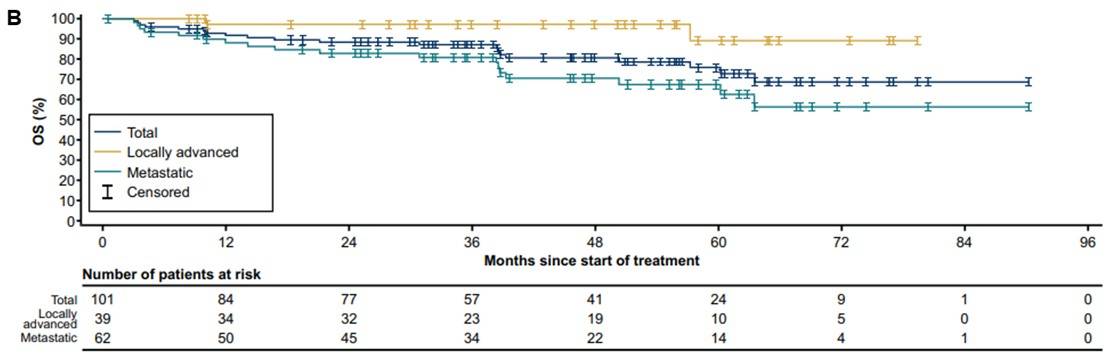
OS:所有初治患者的中位OS尚未达到,5年OS率为76%(95% CI 65%-86%)。成人和儿童患者的5年OS率分别为67%(95% CI 53%-82%)和88%(95% CI 73%-100%),入组时为局部晚期和转移性患者的5年OS率分别为88%(95% CI 71%-100%)和67%(95% CI 54%-81%)(图5)。
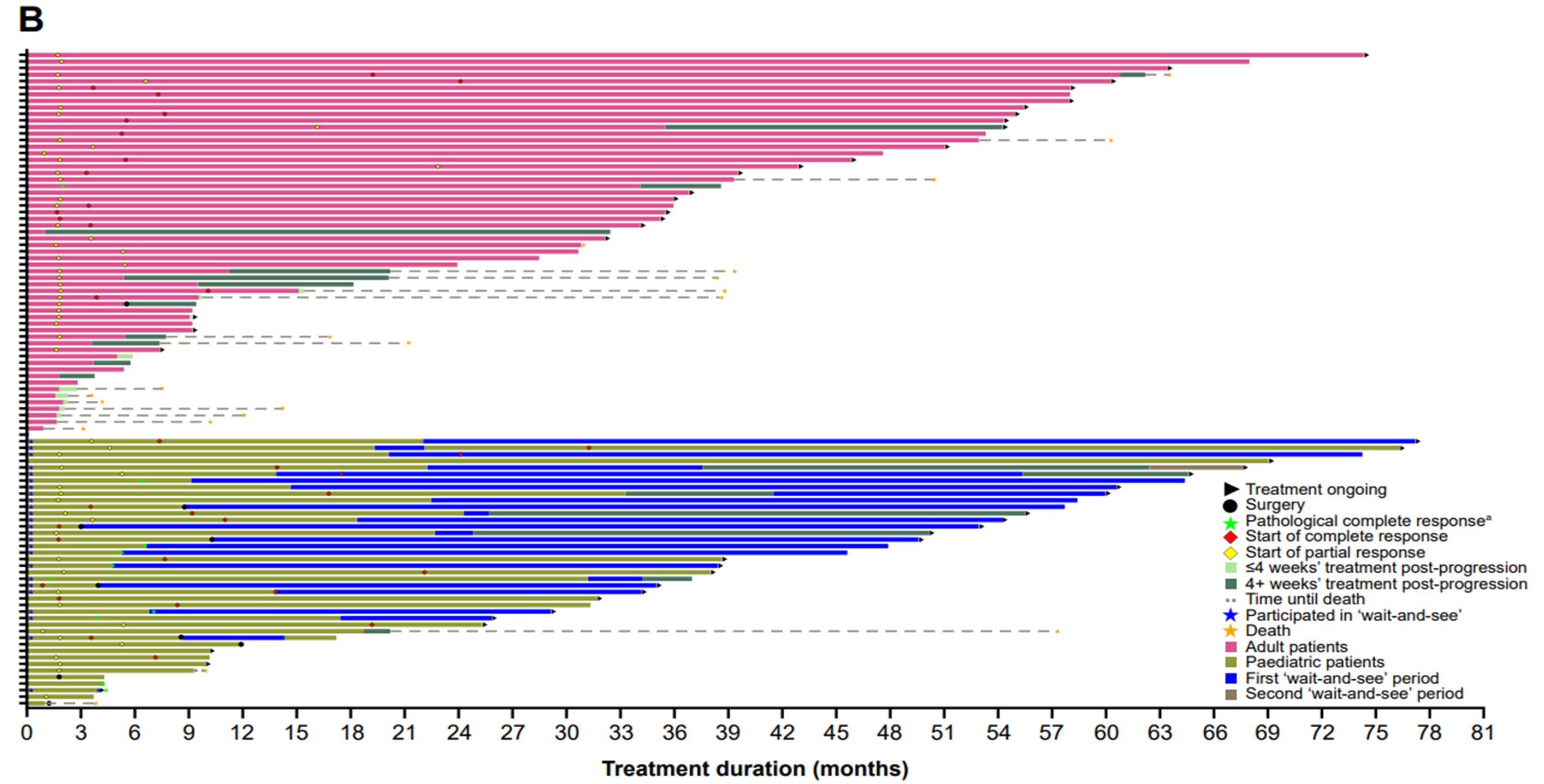
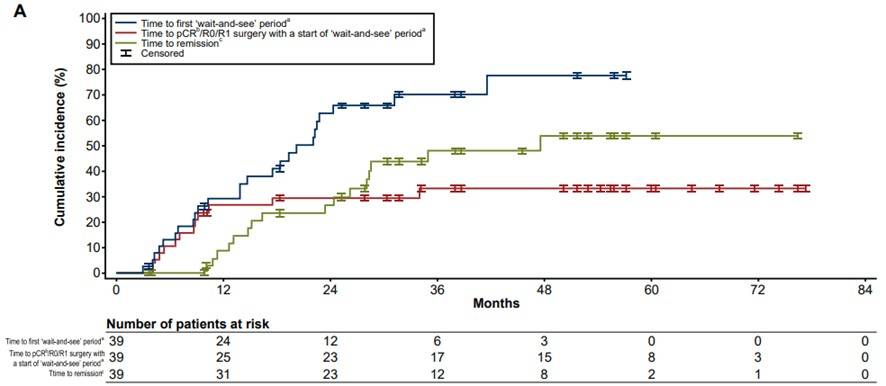
“观望”分析(‘Wait-and-see’ analysis):参与SCOUT研究的患者若经研究者评估确认治疗期间未出现疾病进展,则可暂停拉罗替尼治疗并进入“观望”期分析进行主动随访。本研究共有39例儿童患者符合条件纳入“观望”分析,首次进入“观望”期的中位时间为20个月(范围:3-57个月)。从开始“观望”至达到pCR或R0/R1手术的中位时间尚未达到(范围:4-77个月),患者达到缓解的中位时间为48个月(范围4-76个月)(图6A)。
在纳入“观望”分析的患者中,25例(64%)患者进入至少一个“观望”期。所有进入“观望”期患者的中位治疗时间为14个月(范围3-42个月)。数据截止时,12例(48%)患者仍处于“观望”期。首个“观望”期的中位持续时间为35个月(范围0至55+个月)。在13例(52%)结束第一个“观望”期的患者中,7例发生PD后恢复治疗。在恢复拉罗替尼治疗的7例患者中,5例患者对再次治疗产生缓解(3例完全缓解、1例部分缓解、1例待确认的部分缓解),2例疾病稳定。所有进入至少一个“观望”期的患者在末次随访时仍存活(图6B)。

安全性:拉罗替尼在成人和儿童实体瘤患者中显示出可控的安全性特征,TRAEs多为1-2级,26%的患者发生3-4级TRAEs。10例(10%)患者(5例成人和5例儿童患者)发生骨折事件,均与治疗无关。
综上所述,拉罗替尼一线治疗TRK融合阳性实体瘤患者展现出快速且持久的治疗缓解、长期的生存及良好的安全性,为拉罗替尼的临床应用提供了有力支持。目前,拉罗替尼已成为国内外权威指南推荐用于多种NTRK基因融合实体瘤一线治疗的标准方案,确立了其在肿瘤精准治疗领域的重要地位。
规范NTRK基因检测:优化TRK抑制剂精准治疗策略
NTRK基因融合结构复杂且融合伴侣较多,给临床诊断带来了巨大挑战。目前主要检测手段包括IHC、FISH、RT-PCR和NGS[6]。在实际临床应用中,检测方法应考虑多种因素,包括特定肿瘤类型中NTRK基因融合的发生率、患者的疾病状态、检测平台的可用性等。建议所有晚期成人和儿童实体瘤患者进行NTRK基因融合检测[7],一般而言,NGS是检测NTRK基因融合的首选方法,尤其是基于RNA的NGS技术可有效识别新型融合伴侣;IHC也可作为筛查手段,但阳性结果需经NGS进一步验证[8]。NTRK基因检测的规范化实施,为拉罗替尼的精准应用提供了分子基础,有望真正实现“检测指导治疗”的精准医疗范式。
成人专家点评
现任上海交通大学医学院附属仁济医院 头颈外科主任
中国临床肿瘤学会(CSCO)甲状腺癌专业委员会主任委员
中国抗癌协会头颈肿瘤专业委员会常委
中国抗癌协会甲状腺肿瘤专业委员会委员
主要从事甲状腺,唾液腺,软组织及其他头颈部良恶性肿瘤的诊断和治疗的临床及研究工作
承担国家自然科学基金面上项目3项
负责及参与多项国际及全国多中心临床研究项目
本研究首次系统评估了拉罗替尼一线治疗TRK融合阳性实体瘤的临床价值,证实了其在成人和儿童患者中的卓越疗效。在成人患者队列中,拉罗替尼充分展现了治疗优势,中位PFS长达61个月,5年OS率高达67%,其中在唾液腺癌和甲状腺癌患者中的5年PFS率分别为75%和52%,5年OS率分别为71%和76%,这一系列数据充分证实了拉罗替尼作为成人TRK融合阳性实体瘤一线治疗方案的确切疗效。此外,拉罗替尼已获国内外权威指南一致推荐,成为NTRK基因融合实体瘤患者的关键治疗选择。规范的基因检测流程是临床精准治疗的基石,通过保障治疗方案准确实施,可有效避免无效治疗,进而精准匹配靶向药物,降低总体医疗支出并减轻患者及家庭的心理负担,最终实现患者生存获益最大化与生活质量的双重提升。
儿科专家点评
国家卫生健康委儿童肿瘤专家委员会实体肿瘤组副主任委员
中华医学会小儿外科学会副主任委员
上海市小儿外科学会主任委员
中国研究型医院学会儿童肿瘤专业委员会副主任委员
中国抗癌协会儿童肿瘤专业委员会常委
上海市肿瘤学会骨与软组织肿瘤学组委员
亚太小儿外科学会(PAPS)会员
国家卫生健康委员会内镜诊疗技术规范化应用小儿外科项目专家组成员
主攻儿童胚胎性恶性肿瘤的规范化综合治疗和手术,擅长神经母细胞瘤、肝母细胞瘤、肾母细胞瘤和各类软组织肿瘤的诊治。研究成果获国家妇幼健康科技进步奖三等奖,上海市医学科技进步奖二等奖,中华医学科技奖三等奖。作为主要参加者完成的课题“基于小儿肝胆胰计算机辅助手术系统研发、临床应用及产业化”项目获国家科技进步二等奖。
拉罗替尼作为全球首个不限瘤种、且唯一获批用于儿童实体瘤的TRK抑制剂,开启了精准医学的新纪元。拉罗替尼治疗NTRK基因融合儿童患者的ORR高达90%,5年OS率达到88%,使部分晚期转移性患儿首次实现长期带瘤生存甚至临床治愈。更为突出的是,在婴儿纤维肉瘤患者中,拉罗替尼一线治疗的疗效更为卓越,其ORR达100%,5年OS率同样为100%。在对来自SCOUT研究的儿童患者进行“观望”分析时发现,对于经过筛选的患者,可考虑停止拉罗替尼治疗,且当停药后疾病复发时,再次接受拉罗替尼治疗仍可获得治疗缓解,说明在一线治疗中选择性地暂时停止使用拉罗替尼对于儿童患者可能是可行的,但需要密切监测患者的病情变化,并在必要时及时恢复拉罗替尼治疗。部分不能手术患者,在应用拉罗替尼达到CR后,经过观察随访,可能不再需要手术治疗,有望避免手术所带来的并发症。拉罗替尼的突破为发育期儿童提供了兼具疗效与安全性的治疗选择,更深刻印证了“基于驱动基因而非组织学类型”的治疗范式在儿科领域的巨大潜力。未来需要通过规范的基因检测早期识别获益人群,让更多患儿在器官功能完整的前提下获得生存希望。
[1] Li M, et al. JAMA Netw Open. 2024 Oct 1;7(10):e2440381.
[2] Amatu A, et al. Ann Oncol. 2019 Nov 1;30(Suppl_8):viii5-viii15.
[3] Cocco E, et al. Nat Rev Clin Oncol. 2018 Dec;15(12):731-747.
[4] Westphalen CB, et al. NPJ Precis Oncol. 2021 Jul 20;5(1):69.
[5] Hong DS, et al. ESMO Open. 2025 May 22;10(6):105110.
[6] Sébastien Perreault, et al. Curr Oncol. 2021 Jan 9;28(1):346-366.
[7] Xu C, et al. Thorac Cancer. 2022 Nov;13(21):3084-3097.
[8] Lim KHT, et al. Asia Pac J Clin Oncol. 2022 Aug;18(4):394-403.
审核号:MA-LAR-CN-0294-1
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


