急性髓系白血病(AML)是成人常见恶性血液肿瘤,年发病率约1.62/10万[1],整体5年相对生存率仅45%,随着患者年龄的增长,5年相对生存率迅速下降,且携带高危基因突变的患者预后更差,复发风险及生存质量等未满足需求也亟待改善[2]。靶向治疗的发展为AML精准诊疗带来了希望。自2017年首个FMS样酪氨酸激酶3(FLT3)抑制剂获批以来,异柠檬酸脱氢酶1/2(IDH1/2)抑制剂、B淋巴细胞瘤-2基因(BCL-2)抑制剂等药物相继问世,显著改善特定亚型患者的预后[3]。
近日,肿瘤领域的核心指南:中国临床肿瘤学会(CSCO)指南及中国抗癌协会(CACA)立足国际前沿进展与本土实践,均发布了最新版本[1,4]。本文特邀吉林大学第一医院的高素君教授对新版指南中关于AML靶向治疗的更新要点进行详细解析,涵盖FLT3突变AML、IDH1/2突变AML等靶向治疗的最新进展和推荐,旨在为临床医生提供最新的诊疗思路和依据。
IDH1/2突变AML靶向治疗的更新要点
IDH1/2突变可导致 AML 细胞出现异常的表观遗传调控并阻断分化,在AML的发生、发展中均发挥着重要的作用[5]。据报道,中国成人AML患者中,分别有6.2%-11%和8.7%-13%可能发生IDH1/2突变[6-7]。值得注意的是,IDH1突变通常与总生存期(OS)和无事件生存期(EFS)显著缩短相关,而IDH2突变可能预示着相对更优的预后[5]。
针对IDH突变AML的诊疗策略,我国指南在近年持续进行优化。如2024年版CSCO指南对不同年龄及体能状态的患者实施分层诱导缓解治疗管理,也推荐了IDH抑制剂治疗IDH突变 AML患者;对于复发难治性(R/R)AML患者,均一致Ⅱ级推荐艾伏尼布用于IDH1突变患者[8],具体推荐详见表1。
 表1. 2024 年版CSCO恶性血液病指南对IDH抑制剂的主要推荐[8]
表1. 2024 年版CSCO恶性血液病指南对IDH抑制剂的主要推荐[8]
本次新版CSCO指南更新,在≥60岁新诊断(ND)unfit AML部分,对IDH1突变患者新增Ⅰ级推荐艾伏尼布联合去甲基化药物,及Ⅱ级推荐艾伏尼布联合维奈克拉+AZA;对存在IDH2突变患者,也新增Ⅰ级推荐恩西地平联合AZA。此外,在IDH1突变R/R AML患者中,新增Ⅱ级推荐艾伏尼布联合去甲基化药物;对IDH2突变的R/R AML患者,新增Ⅱ级推荐恩西地平±去甲基化药物(表2)[4]。2025年版CACA指南对于IDH1/2突变AML治疗的更新则主要集中于ND患者(图1),不再按年龄细分患者类型,新增推荐含中剂量 Ara-C的诱导治疗方案联合IDH抑制剂治疗可耐受强化疗的IDH突变AML 患者;对于不能耐受强化疗的IDH1突变AML 患者推荐艾伏尼布±AZA[1]。
 表2. 2025年版CSCO恶性血液病指南对IDH抑制剂的推荐[4]
表2. 2025年版CSCO恶性血液病指南对IDH抑制剂的推荐[4]
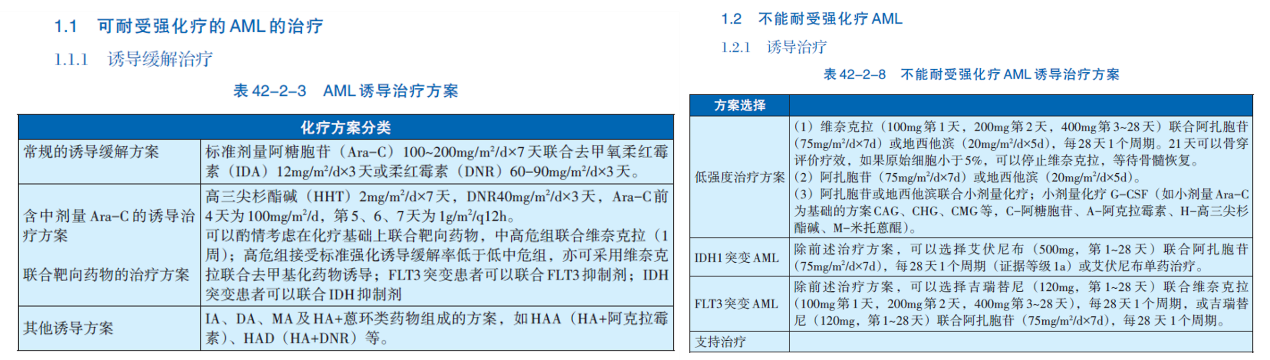 图1. 2025年版CACA白血病指南的主要更新内容[1]
图1. 2025年版CACA白血病指南的主要更新内容[1]
最新版CSCO指南及CACA指南依然推荐艾伏尼布用于IDH1 突变R/R AML的治疗[1,4],主要基于全球多中心研究AG120-C-001及中国桥接研究CS3010-101。AG120-C-001研究表明,在IDH1 突变R/R AML患者中,艾伏尼布单药治疗的完全缓解+完全缓解伴部分血液学恢复(CR/CRh)率可达31.8%,中位OS也达到9个月[9]。在CS3010-101研究中,CR/CRh率为36.7%,中位OS时间达9.1个月[10]。均体现了艾伏尼布在R/R AML治疗中的不俗疗效。
指南新增艾伏尼布联合阿扎胞苷(AZA)用于ND unfit AML的推荐意见则主要基于AGILE研究。AGILE研究是一项全球性、双盲、随机、安慰剂对照、Ⅲ期试验,研究显示,艾伏尼布+AZA组的CR率(47% vs 15%)、CR/CRh率(53% vs 18%)均明显优于安慰剂+AZA组[11]。长期随访结果进一步证实,艾伏尼布+AZA可以带来更长的生存期、更佳的生存质量:中位随访28.6个月,中位OS长达29.3个月,显著优于安慰剂+AZA组的7.9个月(图2);≥3级发热性中性粒细胞减少症发生率(27.8% vs 33.8%)、≥3级感染发生率(13.9% vs 17.6%)也更低[12]。
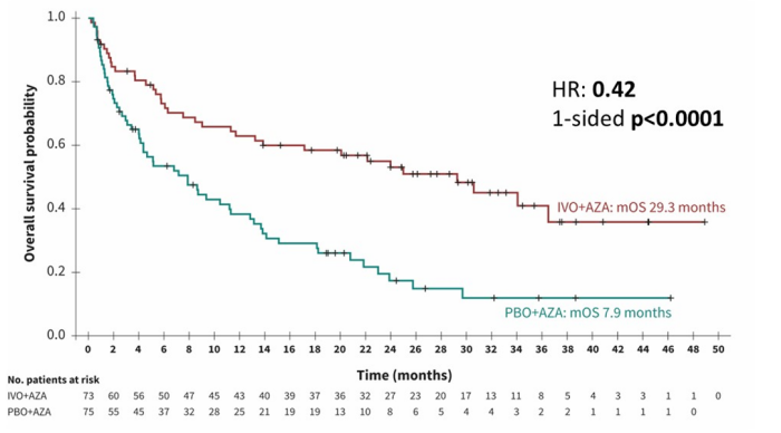 图2. AGILE研究长期随访结果中的生存情况[12]
图2. AGILE研究长期随访结果中的生存情况[12]
除了单药使用以及与去甲基化药物联合应用外,艾伏尼布三联方案也受到新版CSCO指南推荐[4]。一项Ⅰb/Ⅱ期研究显示,艾伏尼布+维奈克拉±AZA治疗ND及R/RAML患者,可实现高缓解率(CRc分别达94%和83%)、深度缓解(流式可测量残留病[MRD]阴性率分别高达77%和78%),且可为患者带来长期生存获益(3年OS率分别为71%和52%)[13]。艾伏尼布联合标准化疗治疗Fit ND患者的优势也在另一项Ⅰ期临床研究中得到了验证:经艾伏尼布联合标准化疗治疗后,80%的患者可达到MRD阴性,中位随访36.3个月时,3年OS率为67% [14]。这些联合方案提供了进一步延长生存的新策略,是未来值得探索的研究方向。
FLT3突变AML靶向治疗的更新要点
FLT3突变是AML最常见的驱动基因变异之一,主要包含内部串联重复序列(FLT3-ITD)和酪氨酸激酶结构域(FLT3-TKD)突变两种类型。其中FLT3-ITD突变较为常见,占AML患者的20%-35%[15]。与未突变的患者相比,伴有FLT3突变的AML患者往往预后更差,复发风险更高[16]。
随着对AML发病机制的深入研究,FLT3抑制剂在临床治疗中的应用日益受到重视,CSCO指南也依据相关研究成果持续更新推荐方案 。在2024版CSCO指南中,按照不同年龄及体能状态患者进行细分治疗选择,详细推荐见表3[8]。
 表3. 2024 年版CSCO恶性血液病指南对FLT3抑制剂的推荐[8]
表3. 2024 年版CSCO恶性血液病指南对FLT3抑制剂的推荐[8]
新版CSCO指南对FLT3突变患者的更新主要集中在≥60岁的患者,如新增标准7+3方案联合FLT3抑制剂用于Fit FLT3突变患者(Ⅰ级推荐),并在Unfit患者中新增吉瑞替尼±AZA/LDAC(Ⅰ级推荐)(表4),同时将维奈克拉+LDAC的推荐等级降为Ⅱ级[4]。新版CACA指南新增推荐含中剂量Ara-C的诱导治疗方案联合FLT3抑制剂治疗可耐受强化疗的FLT3突变AML患者;对于不能耐受强化疗的突变AML 患者推荐吉瑞替尼+维奈克拉或吉瑞替尼+AZA(图1)[1]。
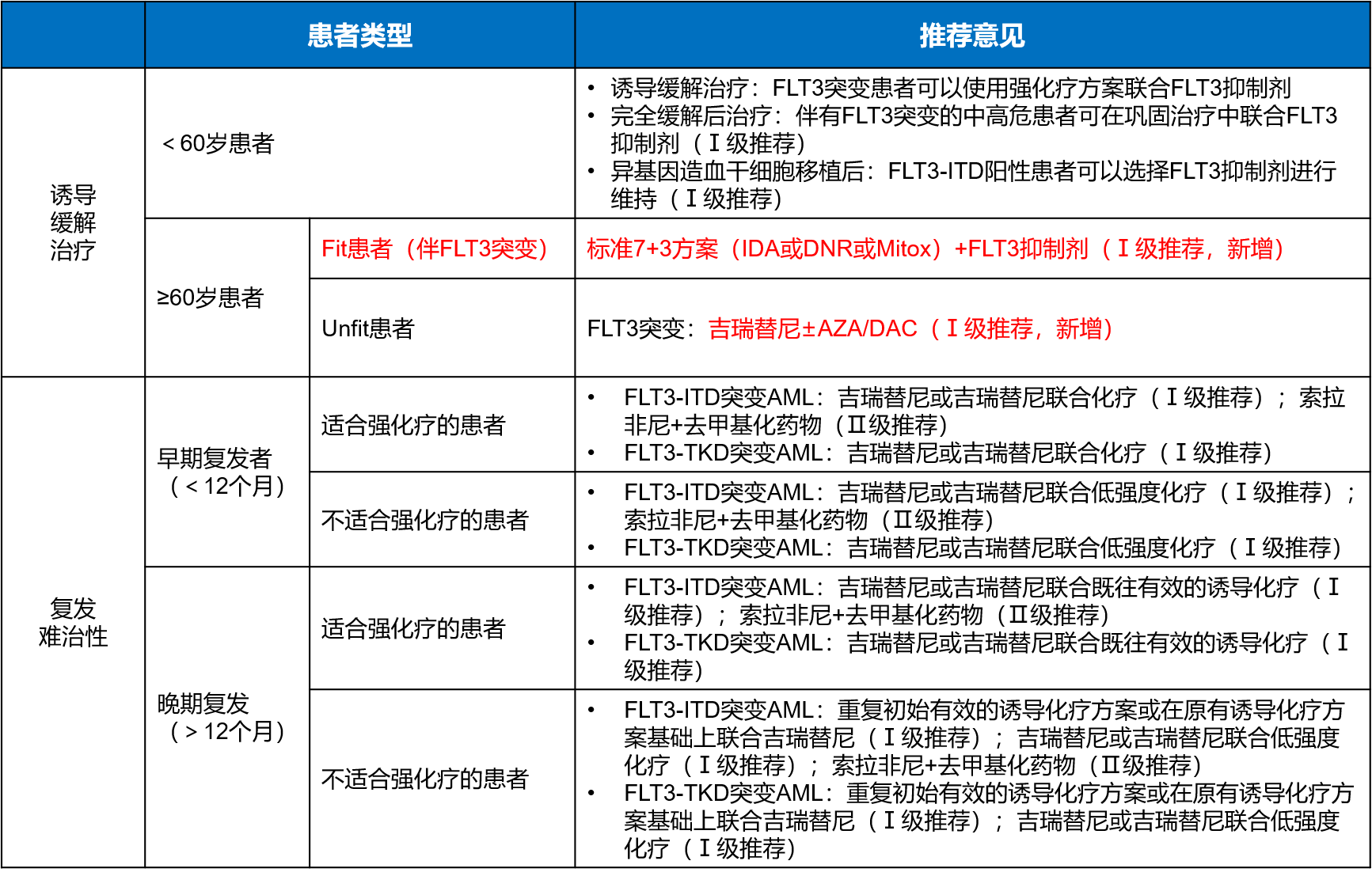 表4.2025年版CSCO恶性血液病指南对FLT3抑制剂的推荐[4]
表4.2025年版CSCO恶性血液病指南对FLT3抑制剂的推荐[4]
目前三款FLT3抑制剂获监管批准:米哚妥林、吉瑞替尼与奎扎替尼,其中仅吉瑞替尼获批用于R/R AML治疗[17]。吉瑞替尼的Ⅲ期ADMIRAL研究显示,与挽救性化疗相比,它能显著提高FLT3-ITD突变R/R AML患者CR/CRh率(34.0% vs 15.3%)、延长OS(9.3个月 vs 5.6个月,P<0.001)[18]。亚洲COMMODORE研究也进一步验证了吉瑞替尼在中国患者中的疗效,中位OS达到10.0个月(化疗组5.7个月)[19]。虽然奎扎替尼的Ⅲ期随机试验QuANTUM-R研究显示,奎扎替尼相较挽救化疗明显延长OS(6.2个月vs 4.7个月,P=0.02),但FDA考虑到研究数据存在差异,仍未准其用于R/R AML治疗[16-17]。其他新型FLT3抑制剂目前也正在 R/R AML中进行研究,包括Crenolanib、Tuspetinib和BMF-500等[16-17]。
在FLT3突变AML的一线治疗中,奎扎替尼凭借Ⅲ期 QuANTUM-First 研究的阳性生存结果,被批准用于FLT3-ITD突变AML的一线治疗,在该研究中,奎扎替尼联合化疗用于诱导/巩固治疗,并单药维持治疗。结果显示,奎扎替尼组与安慰剂组的CR率相似,但中位随访39.2个月时,奎扎替尼组的中位OS明显改善(31.9个月vs 15.1个月)[20]。另外RATIFY研究也证实,≤60岁ND AML和FLT3突变成年患者在标准诱导化疗和高剂量阿糖胞苷巩固治疗基础上联合米哚妥林,可以改善中位EFS和OS(分别为8.2个月vs 3个月,P=0.002;74.7个月vs 25.6个月,P=0.009)[16]。一项Ⅱ期研究也发现新型抑制剂Crenolanib联合化疗在ND FLT3 突变AML患者中展现出良好潜力,中位随访29个月时,85%的患者实现CR,70%的患者保持无疾病状态[16]。此外,一项Ⅱ期研究评估了FLT3抑制剂三联疗法(FLT3抑制剂+维奈克拉+地西他滨)在老年ND FLT3突变型AML患者中的应用,在ND AML患者中,CRc率达到92%,2年OS率为80%,本研究证实FLT3抑制剂三联治疗对于ND FLT3 突变的老年患者安全有效,需要更大样本量的研究进一步探寻[16]。
其他靶向治疗的更新要点
在新版CSCO指南中,仍推荐BCL-2抑制剂维奈克拉联合方案(如联合去甲基化药物、化疗、其他靶向药物)用于≥60岁AML患者的诱导治疗及R/R AML患者的治疗,但随着特异性靶向药物的新兴,部分维奈克拉联合方案在特定基因突变中的地位有所下降,如维奈克拉+DAC[1]。
除了临床常见的IDH抑制剂、FLT3抑制剂及BCL-2抑制剂以外,多种新型靶向药物也在AML领域中进行研究探索,如Menin抑制剂、MCL1抑制剂、MDM2抑制剂、MEK抑制剂、CDK9抑制剂以及TP53调节剂[17]。新版CSCO指南也新增了新型靶向药物推荐:Ⅱ级推荐口服Menin抑制剂Revumenib治疗KMT2A-r AML患者[1]。Revumenib在KMT2A r/NPM1突变 R/R AML中的Ⅰ/Ⅱ期研究(AUGMENT-101)表明,总体缓解率(ORR)为63.2%,22.8%的患者达到CR/CRh[17]。包括Ziftomenib、DSP-5336等的多个口服Menin抑制剂也研究显示,该类药物的ORR可达到32%-40%[17],或有望成为新型靶向药物选择之一。
新型靶向药物也在探索联合方案的应用,目前正在ND和 R/R AML患者中,探索Menin 抑制剂联合标准诱导化疗或维奈克拉的疗效与安全性[17]。随着这些新型靶向药物探索的不断深入与临床实践的持续积累,未来AML的靶向治疗选择将越来越多元和丰富。
总结
最新版CSCO恶性血液疾病诊疗指南及CACA白血病指南在AML靶向治疗部分的更新进一步优化了特定基因突变患者的诊疗路径,充分凸显了AML的精准治疗理念。在整体更新中,IDH1突变AML的推荐尤为突出:针对新诊断unfit患者,新增艾伏尼布联合去甲基化药物Ⅰ级推荐及艾伏尼布联合维奈克拉+AZA的Ⅱ级推荐,CACA指南同步建议可耐受强化疗患者采用中剂量Ara-C联合IDH抑制剂;复发难治患者也新增联合去甲基化药物,强调艾伏尼布联合治疗的深度缓解与长期生存潜力。此次更新通过整合艾伏尼布联合治疗策略与精准分型,不仅为IDH1突变患者提供更优生存选择,更整体推动AML诊疗向更高层次的个体化迈进。未来,随着多靶点联合和动态监测技术的成熟,AML有望从“不可治愈”逐步迈向“慢性病”管理模式,实现更长生存、更优生存。
专家简介
吉林大学白求恩名师
中华医学会血液学分会委员
中国医师协会血液分会委员
中国医药教育协会血液学专业委员会副主任委员
中国抗癌协会血液肿瘤专业委员会委员
CSCO抗白血病联盟专家委员会常务委员
吉林省医学会血液学分会副主任委员
吉林省医师协会血液学分会副主任委员
吉林省健康管理学会血液病专业委员会主任委员
长春市医学会血液学分会主任委员
[1]. CACA白血病指南.2025 v2版.
[2]. Wiese M, et al. Am J Manag Care. 2018 Aug;24(16 Suppl):S347-S355.
[3]. 邱林,马军.急性髓系白血病靶向治疗研究进展[J].白血病·淋巴瘤,2022,31(04):197-203.
[4]. CSCO恶性血液病指南.2025年版.
[5]. 戚栋铭, 李丽. 临床医学进展, 2023, 13(6): 9202-9210.
[6]. 吴瑞盈等.中华血液学杂志,2021,42(01):39-44.
[7]. Wang JH,et al.PLoS One.2015 Oct 14;10(10):e0140622.
[8]. CSCO恶性血液病指南.2024年版.
[9]. ASCO 2018 Annual Meeting. Abstract 7000.
[10]. Mingyuan Sun. et al. Blood Science (2024) 6, 1–9:e00196.
[11]. Montesinos P, et al. N Engl J Med . 2022 Apr 21;386(16):1519-1531.
[12]. De Botton, et al. Presented at 2023 ASCO. Abstract P142.
[13]. Jennifer Marvin-Peek,et al.2024 ASH.Oral 219.
[14]. Stein EM, et al. 2021 ASH, Abstract 1276.
[15]. Kantarjian H, et al. Blood Cancer J. 2021 Feb 22;11(2):41.
[16]. Zhao JC,et al.Blood Rev.2022;52:100905.
[17]. Moore CG, et al. Am J Hematol. 2025 Mar;100 Suppl 2:23-37.
[18]. Perl AE, et al. N Engl J Med 2019; 381: 1728–1740.
[19]. Wang JX, et al. 2024 EHA P1781.
[20]. Erba HP, et al. Lancet. 2023 May 13;401(10388):1571-1583.
免责声明:
本内容仅供医学科学事务部科学沟通使用,不用做药品推广。医疗卫生专业人士在作出任何与治疗有关的决定时,应根据患者具体情况,参考药监局核准的药品说明书。
排版编辑:肿瘤资讯-Olivia











 苏公网安备32059002004080号
苏公网安备32059002004080号


