病史摘要:患者女,47岁,因“不规则道出血2周,确诊宫颈癌10余天”入院。因劳累后不规则阴道出血就诊,宫颈活检病理提示:宫颈中分化鳞癌。MR示:1. 宫颈部软组织块影,考虑宫颈癌,累及前后穹隆,病灶向宫颈外口生长,宫颈基质环破坏;2. 双侧腹股沟区、髂血管旁及闭孔区多发淋巴结显示;骶骨异常信号灶,转移待排。全身骨显像:左骶髂关节骨代谢增高,建议进一步检查。
症状体征:妇科检查:外阴:已婚已产式;阴道:通畅,左穹隆变浅;宫颈:菜花样增大,直径约4cm,触血(+);宫体:中位,常大,无压痛;宫旁:双侧增厚未达盆;直肠:壁光滑,指套无血染。
诊断方法:根据病史、体征、影像及病理可确诊,初步诊断:宫颈鳞癌IIIC1r期。
治疗方法:盆腔放疗,给予6MV-X线,VMAT,95%PTV DT50Gy/25f,PTVnd DT62.5Gy/25f。完成后行腔内后装治疗,HR-CTV D95% 24Gy/4f。同步行3周期化疗联合靶向治疗,具体:卡铂,500mgD1+紫杉醇,240mgD1+贝伐珠单抗,500mgD1。后序贯行3周期化疗,具体:卡铂,400mgD1+紫杉醇,210mgD1+贝伐珠单抗,500mgD1。第3-6周期化疗后24h给予硫培非格司亭6mg,ih。
临床转归:第1、2次同步放化疗后白细胞计数降低,第3-6次化疗后24h给予硫培非格司亭后查白细胞均正常。硫培非格司亭可预防宫颈癌同步放化疗中性粒细胞减少症的发生。治疗后肿瘤疗效为CR。
适合人群:肿瘤科;放疗科;妇科;妇产科。
关键词:宫颈癌;放化疗;中性粒细胞减少症;硫培非格司亭
前言
世界范围内,宫颈癌的发生在女性恶性肿瘤中位列第四[1]。宫颈癌的治疗主要包括手术和放疗、化疗等综合治疗。目前NCCN指南推荐针对局部晚期宫颈癌患者的标准治疗方案是以铂类为基础的同步放化疗[2]。相比单纯放疗患者而言,同步放化疗产生的不良反应率显著升高,以化疗后中性粒细胞及白细胞数减少为代表的骨髓抑制为主[3],多发生于化疗后第3天至第2周。据文献报道,同步放化疗期间Ⅲ-Ⅳ度白细胞减少和中性粒细胞减少的发生率为10%-50%[4]。
目前,临床对于宫颈癌放化疗相关中性粒细胞减少症常使用重组人粒细胞集落刺激因子(rhG-CSF)等短效升白药物进行治疗,需多次注射且药效维持时间短。而宫颈癌放化疗周期延长将直接缩短患者的总生存时间[5],所以更需要长效药物预防中性粒细胞减少的频繁发生,避免放化疗延迟及周期的延长。当前,在宫颈癌放化疗期间,尚无使用硫培非格司亭预防中性粒细胞减少症的临床研究报道。在此报道1例宫颈癌患者使用硫培非格司亭预防放化疗联合靶向治疗期间中性粒细胞减少症的发生,现展示如下。
临床资料
一般资料
患者,女,47岁,因“不规则阴道出血2周,确诊宫颈癌10余天”于2023年9月25日入院。2023年9月15日因劳累后不规则阴道出血就诊于中国科学院大学深圳医院,行宫颈活检,病理提示:宫颈浸润性癌,建议进一步做免疫组化明确组织分型。后再次就诊于富平县医院,行宫颈活检,病理提示:宫颈中分化鳞癌。盆腔MR提示:1. 宫颈部软组织块影,考虑宫颈癌,累及前后穹隆,病灶向宫颈外口生长,宫颈基质环破坏;2. 双侧腹股沟区、髂血管旁及闭孔区多发淋巴结显示;骶骨异常信号灶,转移待排,建议进一步检查。于2023年9月19日就诊我科门诊,行全身骨显像:左骶髂关节骨代谢增高,建议进一步检查。
既往史:否认肝炎、结核、疟疾病史,否认高血压、心脏病史,否认糖尿病、脑血管疾病、精神疾病史,否认手术、外伤、输血史,无药物过敏史,无食物过敏史,无其他过敏史,预防接种史不详。
个人史:无疫区居住史,无疫水、疫源接触史,无放射性物质、毒物接触史,无吸烟史,无饮酒史,无冶游史。月经史:初潮14岁,行经天数4/月经周期28天,月经量中量,无痛经。婚育史:结婚年龄27岁,妊娠次数:4,生产次数:1,流产次数:3;育有1子,配偶健康状况良好。
家族史:父健在,母健在,兄弟姐妹健在,否认家族性遗传病史。
检查
1. 病理(中国科学院大学深圳医院,2023年9月15日,12315727):宫颈浸润性癌,建议进一步做免疫组化明确组织分型。2. 病理(富平县医院,2023年9月18日,202339853):宫颈中分化鳞癌。3. 盆腔MR(富平县医院)提示:1)宫颈部软组织块影,考虑宫颈癌,累及前后穹隆,病灶向宫颈外口生长,宫颈基质环破坏,累及阴道下三分之一;2)双侧腹股沟区、髂血管旁及闭孔区多发淋巴结显示;3)右侧附件区囊性病灶,考虑生理性囊肿,随诊观察;4)盆腔少许积液;5)骶骨异常信号灶,转移待排,建议进一步检查;6)右侧臀大肌与股方肌肌间占位灶,考虑良性病变,随诊观察。4. 全身骨显像(西安交通大学第一附属医院,2023年9月19日):左骶髂关节骨代谢增高,建议进一步检查。
诊断与鉴别诊断
初步诊断:宫颈鳞癌IIIC1r期。鉴别诊断:病理诊断明确,无需鉴别。
治疗
于2023年9月25日开始行盆腔放疗,给予6MV-X线,VMAT,95%PTV剂量DT50Gy/25f,PTVnd DT62.5Gy/25f。CTV包括:宫颈、子宫、宫旁、阴道受侵下3-4cm+盆腔淋巴结引流区(髂总、髂内、髂外、骶前、闭孔+腹股沟深淋巴结引流区),GTVnd为盆腔肿大淋巴结,PTV=CTV+外放0.5cm,PTVnd=GTVnd+外放0.3cm。
于2023年11月2日至2023年11月16日行CT引导下三维腔内后装治疗,HR-CTV D95% 24Gy/4f。
于2023年9月27日、2023年10月17日、2023年11月10日同步行3周期TC联合靶向方案化疗,具体方案:卡铂,500mgD1+紫杉醇,240mgD1+贝伐珠单抗,500mgD1。于2023年12月7日、2024年1月3日、2024年1月24日行序贯3周期TC联合靶向方案化疗,具体方案:卡铂,400mgD1+紫杉醇,210mgD1+贝伐珠单抗,500mgD1,第3周期开始化疗后24h给予硫培非格司亭6mg,ih。
治疗结果、随访及转归
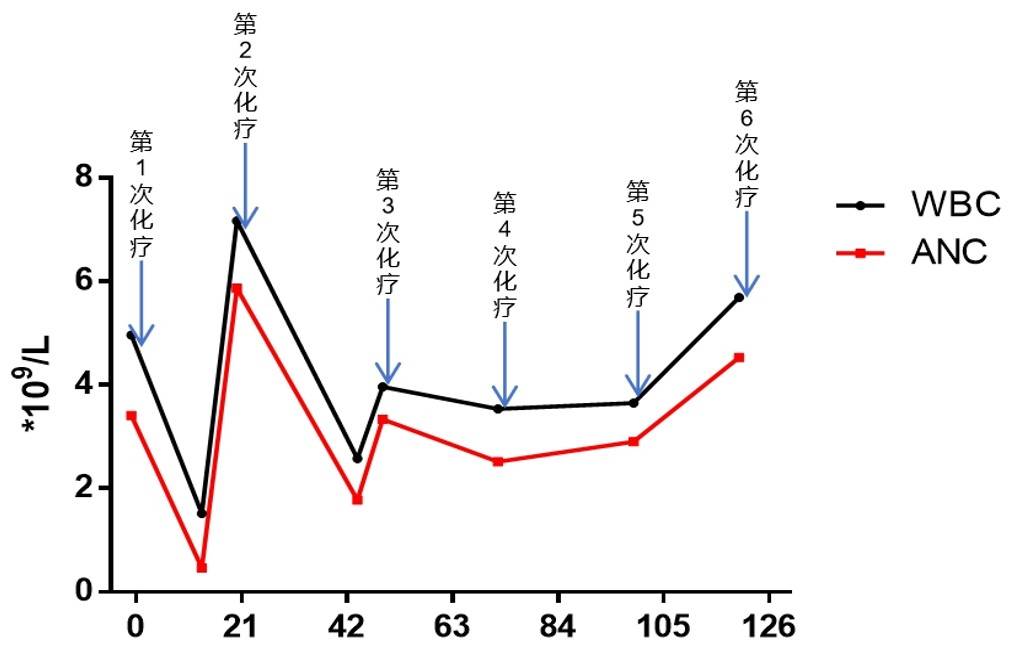
第1次化疗后11天查血常规(2023年10月9日):红细胞计数3.66×1012/L;白细胞计数(WBC)1.52×109/L;中性粒细胞计数(ANC)0.46×109/L,给予粒细胞集落刺激因子升白细胞治疗。
第2次化疗后7天查血常规(2023年10月23日):红细胞计数2.79×1012/L;血红蛋白95g/L;白细胞计数2.58×109/L;中性粒细胞计数1.78×109/L;给予粒细胞集落刺激因子升白细胞治疗。
第3-6次化疗后24h给予硫培非格司亭6mg,ih,后查血常规提示白细胞均正常(图1),且未发生骨痛等相关不良反应。
讨论
近年来,我国宫颈癌的发病率极高,且日趋年轻化,成为危及女性健康的重大隐患之一。研究表明,估计有42.0%-72.0%的接受化疗的患者发生骨髓抑制中性粒细胞减少症。发热性中性粒细胞减少症(febrile neutropenia,FN)和感染是化疗后中性粒细胞减少的主要并发症,导致患者住院时间延长和病死率增加[6]。
重组人粒细胞集落刺激因子可分为短效重组人粒细胞集落刺激因子(rhG-CSF)和长效PEG-rhG-CSF,是目前临床上常用且可有效降低中性粒细胞减少症发生风险的药物。PEG-rhG-CSF是使用基因重组技术生产的一种细胞因子,可有效预防肿瘤患者在放化疗过程中出现中性粒细胞减少。同时也有研究证实,未经一级预防的患者,一旦发生FN,后续化疗过程中再次发生FN的风险为50~60%,因此,二级预防在这些患者中,显得尤为重要。二级预防使用G-CSF一方面可显著降低患者再次发生FN的风险,同时还可促进前1个周期化疗导致粒细胞下降的恢复过程,保障下个周期化疗的剂量以及按时进行。硫培非格司亭注射液是在非格司亭基础上进行聚乙二醇修饰的一种PEG-rhG-CSF。2020年中国临床肿瘤学会(CSCO)制定了《硫培非格司亭临床应用专家共识》,推荐成年非髓性恶性肿瘤患者化疗时,可使用硫培非格司亭以降低发热性中性粒细胞减少症为表现的感染发生率[7]。有研究表明,硫培非格司亭在预防连续周期化疗引起的中性粒细胞减少症时有效且患者耐受性良好[8]。硫培非格司亭能够有效降低中性粒细胞减少症的发生情况,而且在治疗终点和安全性等方面与每日使用rhG-CSF相当[9]。在一项真实世界研究中,患者对硫培非格司亭通常耐受性良好,未观察到意外不良事件的发生,连续给药硫培非格司亭能够使中性粒细胞减少症的发生率保持在相对较低的水平[10]。但目前关于硫培非格司亭预防宫颈癌患者放化疗后中性粒细胞减少的有效性和安全性评价较少。本研究报道了1例宫颈癌患者放化疗期间应用硫培非格司亭预防中性粒细胞减少症,并表明硫培非格司亭可减少放化疗后中性粒细胞减少症发生率,并且安全性良好[1] [2] 。二级预防作为防治CIN的重要手段,对于保障患者安全,改善患者预后具有重要意义。考虑到患者前两次次放化疗期间出现的骨髓抑制情况,在后续放化疗周期后对患者进行了二级预防,确保患者能够平稳且安全地完成治疗,保障了治疗效果。硫培非格司亭在晚期肿瘤患者的治疗过程中发挥了重要作用,不仅帮助本例患者实现了良好的肿瘤控制,而且避免了发热性中性粒细胞减少症等严重并发症的发生,显著改善了患者的生活质量。这一临床案例为未来该类型疾病的治疗提供了宝贵的经验和指导。
[1]. Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68 (6): 394-424.
[2]. Kato S, Ohno T, Thephamongkhol K, et al. Long-term follow-up results of a multi-institutional phase 2 study of concurrent chemoradiation therapy for locally advanced cervical cancer in east and southeast Asia[J]. Int J Radiat Oncol Biol Phys, 2013, 87 (1): 100-105.
[3]. Giavedoni ME, Staringer L, Garrido R, et al. Experience with concurrent chemoradiotherapy treatment in advanced cervical cancer: results from a hospital in Argentina[J]. Ecancermedicalscience, 2019, 13: 919.
[4]. Datta NR, Stutz E, Liu M, et al. Concurrent chemoradiotherapy vs. radiotherapy alone in locally advanced cervix cancer: A systematic review and meta-analysis[J]. Gynecol Oncol, 2017, 145 (2): 374-385.
[5]. Petereit DG, Sarkaria JN, Chappell R, et al. The adverse effect of treatment prolongation in cervical carcinoma[J]. Int J Radiat Oncol Biol Phys, 1995, 32 (5): 1301-1307.
[6]. Al-Salama ZT, Keam SJ. Mecapegfilgrastim in Chemotherapy-Induced Neutropenia: A Profile of Its Use in China[J]. Clin Drug Investig, 2019, 39 (10): 1009-1018.
[7]. 中国临床肿瘤学会(CSCO)抗肿瘤药物治疗安全管理专家委员会. 硫培非格司亭临床应用专家共识[J]. 临床肿瘤学杂志, 2020, 25 (5): 461-465.
[8]. Xu F, Zhang Y, Miao Z, et al. Efficacy and safety of mecapegfilgrastim for prophylaxis of chemotherapy-induced neutropenia in patients with breast cancer: a randomized, multicenter, active-controlled phase III trial[J]. Ann Transl Med, 2019, 7 (18): 482.
[9]. Zhou C, Huang Y, Wang D, et al. A Randomized Multicenter Phase III Study of Single Administration of Mecapegfilgrastim (HHPG-19K), a Pegfilgrastim Biosimilar, for Prophylaxis of Chemotherapy-Induced Neutropenia in Patients with Advanced Non-Small-Cell Lung Cancer (NSCLC)[J]. Clin Lung Cancer, 2016, 17 (2): 119-127.
[10]. Ma J, Huang H, Fu P, et al. Prophylaxis of neutropenia with mecapegfilgrastim in patients with non-myeloid malignancies: a real-worl
排版编辑:肿瘤资讯-momo











 苏公网安备32059002004080号
苏公网安备32059002004080号


