抗体偶联药物(ADC)因其独特的结构设计兼具“靶向递送+强效杀伤”的作用特点,被誉为“魔法子弹”。 作为HER2阳性乳腺癌治疗的关键ADC,T-DM1自临床应用以来,显著改善了患者预后,但关于其治疗过程中不良事件(AE)与疗效之间的潜在关联,仍缺乏系统性研究。对此,温州医科大学附属第一医院郭贵龙教授团队开展了一项回顾性研究,通过分析接受T-DM1治疗的HER2阳性乳腺癌患者数据,深度挖掘AE与治疗疗效的相关性。该研究成果已在今年2月重磅发表于Breast Cancer-Targets and Therapy杂志[1],引发学界广泛关注。基于此,【肿瘤资讯】特邀郭贵龙教授畅谈研究的开展初衷、核心发现,并进一步探讨研究成果对临床实践的指导意义与深远影响。
您团队开展的这项回顾性研究聚焦于中国HER2阳性乳腺癌患者使用T-DM1的情况。能否请您谈谈您团队开展这项研究的初衷?
郭贵龙教授:HER2阳性乳腺癌约占所有乳腺癌的25%,这类患者肿瘤侵袭性强、复发转移风险高[2]。但随着靶向治疗的发展,尤其是曲妥珠单抗、帕妥珠单抗及T-DM1等抗HER2靶向治疗的广泛应用,患者预后有了显著改善。
ADC是一种创新的药物形式,它结合了细胞毒性药物的强效作用和单克隆抗体的精准靶向能力。自2000年美国食品药品监督管理局(FDA)批准首个ADC药物以来,全球已有14种ADC获得销售许可。
在乳腺癌治疗领域,T-DM1是首个获批的ADC药物。2013年,基于III期EMILIA研究[3]的积极结果,FDA首次批准T-DM1用于治疗HER2阳性转移性乳腺癌。随后,在2019年,基于KATHERINE试验[4]的数据,T-DM1的适应症进一步扩展,用于HER2阳性早期乳腺癌患者在新辅助化疗后未达到病理完全缓解(non-pCR)的辅助治疗。在中国,T-DM1的适应症于2021年获得批准,并于2023年被纳入国家医保目录。这一举措覆盖了更多患者群体,显著提高了这种创新治疗的可及性。
然而临床实践中仍存在两个关键问题:一是基层医院对 T-DM1 的安全性管理经验不足,比如血小板减少、肝损伤等不良反应可能影响治疗依从性;二是临床实践中,不良反应与治疗效果之间的关联尚未被充分探索,缺乏中国患者的针对性数据。对此,我们团队发现既往研究已提供了重要启示。ATAC研究[5]曾证实,接受阿那曲唑治疗的患者中,出现较严重关节痛症状的人群反而展现出更好的生存获益;在HR+晚期乳腺癌患者使用依维莫司的研究中亦发现,口腔炎、血小板减少等AE的严重程度,与患者的无进展生存期(PFS)存在潜在正相关。这些发现共同提示AE可能是药物有效作用的伴随信号。
基于此,我们希望在T-DM1治疗领域进一步验证“AE与疗效关联”的科学假设,通过分析中国患者的真实世界数据,填补国内研究空白,为临床精准评估疗效和个体化用药提供依据。
在您的研究中,中国HER2阳性乳腺癌患者接受T-DM1治疗的整体情况是怎样的?T-DM1治疗疗效与AE之间存在怎样具体的关联?
郭贵龙教授:由于T-DM1在中国的早期适应症获批较晚,故本研究纳入了2012年1月至2023年12月期间在我院接受T-DM1治疗的晚期HER2阳性乳腺癌患者,以获得更大的样本量。研究共纳入了48例患者,中位随访时间为8.4个月。其中,大多数患者(约81%)接受的是二线或更后线的治疗。
在安全性方面,共有33例患者(占68.8%)经历了AE,包括血小板水平降低和肝功能异常。其中,14例患者(占29.2%)出现了3级或4级血小板减少,但没有患者表现出3级或4级肝损伤。3例患者(占6.3%)因血小板计数严重下降且无法恢复而停止了T-DM1治疗。
在疗效方面,有12例患者(25%)显示了客观缓解(ORR),包括2例完全缓解(4.2%)和10例部分缓解(20.8%)。9例患者(18.8%)的最佳反应为疾病稳定(SD)。疾病控制率(DCR)为43.8%。治疗线较低的患者对T-DM1的反应更好。
在疗效与AE关联方面,发生AE的患者对T-DM1的治疗反应更佳。具体而言,发生血小板减少的患者与未发生血小板减少的患者之间在ORR(35.7% vs 10.0%;p=0.043)和DCR(57.1% vs 25.0%;p=0.027)上存在统计学上的显著差异;有无肝损伤患者在ORR或DCR方面未观察到统计学上的显著差异(表1)。当然,考虑到本研究样本量相对有限,该结果或受病例数量不足的影响。未来可通过扩大样本规模进一步探究肝损伤与治疗效果之间的潜在关系。
表1 不同特征患者的DCR
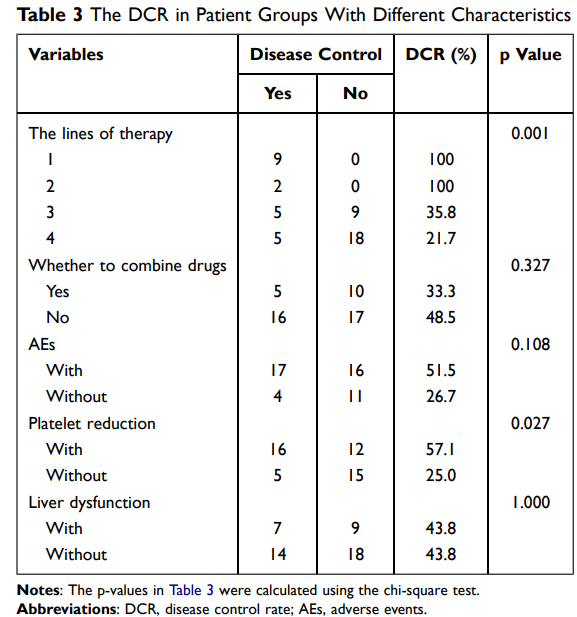
另外,研究发现,经历了AE的患者相比未经历AE的患者显示出更长的PFS(8.8个月 vs 3.4个月;p=0.012)。其中肝功能障碍和血小板减少与较长的PFS显著相关(p=0.029和p=0.014,图1),并且根据 Cox 多变量分析结果,肝功能障碍和血小板减少是延长PFS的显著独立预测因子(p=0.003和p=0.013,表2)。
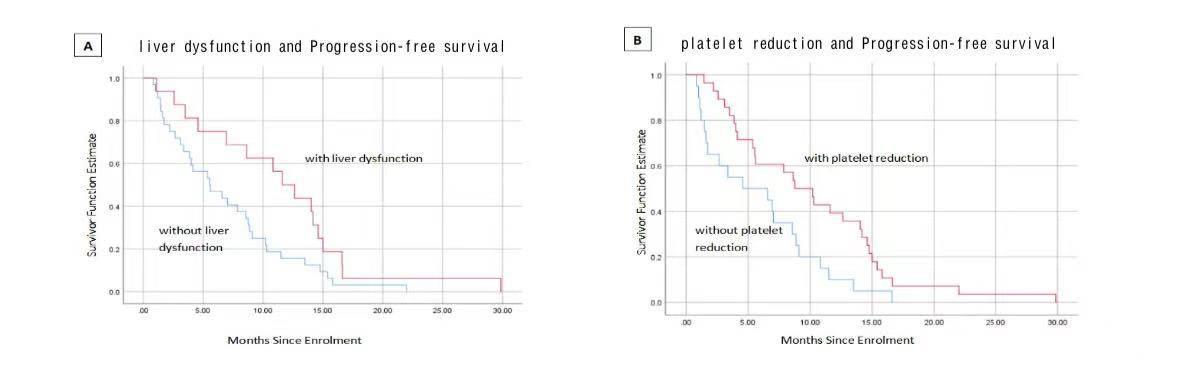
表2 使用Cox比例风险回归模型对与PFS相关的因素进行单因素和多因素分析
在探究AE与疗效关联机制的过程中,我们发现其潜在关联可能是药物浓度依赖性、靶点分布差异及肿瘤细胞敏感性共同作用的结果。首先,T-DM1作为ADC,通过HER2靶向识别,将细胞毒性药物DM1递送至肿瘤细胞,其疗效依赖于细胞内DM1及其代谢物达到有效浓度——高浓度DM1可诱导肿瘤细胞快速凋亡,而低浓度则可能导致耐药。在此机制下,AE的发生或提示体内DM1浓度较高,既增强抗肿瘤效应,也可能引发脱靶毒性,如骨髓巨核细胞和肝细胞损伤。
此外,肿瘤细胞的HER2表达水平及信号通路状态可能影响药物反应。HER2高表达或未发生耐药突变的肿瘤细胞,对T-DM1的靶向摄取更充分,不仅疗效显著,也可能因药物暴露量高而伴随更多AE;反之,若肿瘤细胞 HER2表达较低,或存在耐药突变(如PIK3CA突变激活、PTEN缺失),药物结合与DM1释放减少,毒性和疗效均会降低。尽管上述理论为 AE与疗效的关联提供了合理解释,但具体分子机制仍未完全明晰,未来亟需通过更多体内外实验进行验证,以进一步揭示其生物学本质并指导临床实践。
ADC药物的安全性管理是临床关注的重点。您认为本项研究成果对 HER2 阳性乳腺癌的临床治疗有哪些直接的指导意义?未来还有哪些方向值得我们进一步探索?
郭贵龙教授:这项研究对临床主要有两方面的指导意义:第一是疗效预判与精准用药。医生可依据患者个体特征,如基础疾病、过往治疗史等,预判使用 T-DM1 的疗效及AE风险,筛选适宜用药人群。结合临床观察,我们发现,伴有肝炎病史或经历过多线治疗的患者,其AE发生风险显著升高,这进一步凸显了患者筛选的重要性。此外,血小板减少、肝功能异常等AE或可作为早期疗效指标,例如治疗2-3周期后出现轻度血小板下降(1-2级)的患者,可能提示药物应答较好,避免因过度担忧毒性而提前停药。
第二是优化监测与干预策略,针对高危患者(如多线治疗经历、肝肾功能异常者),建议增加血常规、肝功能检测频次,以便早期介入,降低停药风险。若出现3级及以上血小板减少,可延迟给药或降低剂量(如从3.6mg/kg 降至 3.0mg/kg),同时给予血小板生长因子支持,在保证安全性的前提下尽可能维持治疗疗程。
在这方面,曾有一位患者让我印象深刻:该患者经多线治疗后胸壁肿瘤复发伴胸腔压迫、左侧迷走神经受累致声音嘶哑,首次接受标准剂量T-DM1(3.6mg/kg)治疗后,迅速出现4级血小板减少,经急诊入院升血小板治疗后恢复。后续治疗中,我们将剂量调整为3mg/kg,患者不仅平稳完成疗程,疗效还达到了部分缓解。这一案例提示,若因严重不良反应过早停药,患者将错失治疗机会。所以基于多年的临床经验,对于一般状况差或多线治疗的患者,我们可根据情况灵活调整T-DM1剂量。例如从3mg/kg起始,若耐受良好,可逐步恢复至标准剂量。这种个体化剂量调整策略尤为重要,尤其在后线治疗中,良好的不良反应管理有助于提升患者依从性,改善最终预后。
在本项研究基础上,未来可以从以下几个层面进行深入探索:首先是机制深挖与跨靶点拓展。即深入剖析AE与肿瘤疗效间关联机制,进一步验证 AE 预测价值。还可将“AE作为疗效预测因子”的理念应用于其他领域。以HR+乳腺癌为例,针对PIK3CA靶点的PI3K抑制剂阿培利司曾因严重血糖代谢异常备受临床关注,而目前新型PI3K抑制剂伊那利塞,不仅在联合CDK4/6抑制剂+内分泌一线治疗的方案中取得了超双倍的PFS获益(15.0个月 vs 7.3个月;HR=0.43,95%CI 0.32-0.59;p<0.0001),其引发的高血糖发生率从数值上看也较同类药物有所降低[6,7]。所以,今后可探索这些特殊AE(高血糖、皮疹等)是否为药物作用于PI3K通路的伴随表现,以通过规范管理AE(如血糖控制)优化患者生存获益。
其次,积极探索能预测T-DM1疗效和AE的新型生物标志物,以优化治疗决策和安全性管理。目前,我们正在进行这方面的研究,但纳入的研究对象主要是晚期患者,未来我们希望将这些研究拓展到早期患者,尤其是那些经过新辅助化疗后non-pCR的患者,深入探讨T-DM1与无病生存期(DFS)和总生存期(OS)之间的关系。此外,本次研究纳入的病例数较少,关于肝脏损伤及其与疗效的关系仍不明确。未来,我们计划扩大样本量,进一步探讨肝脏不良反应与疗效之间的客观关联。
最后,针对ADC共性毒性(如肝损伤、血小板减少),探索预防性使用肝脏保护剂或血小板生成素激动剂的效果,推动“疗效-安全性平衡”的精准治疗模式,让更多患者从T-DM1等创新药物中获益。
[1] Gu H, Zhu T, Ding J, Real-World Analysis of the Efficacy and Adverse Events of T-DM1 in Chinese Patients With HER2-Positive Breast Cancer. Breast Cancer (Dove Med Press). 2025 Feb 21;17:201-210.
[2] Howlader N, Altekruse SF, I LC, et al. US incidence of breast cancer subtypes defined by joint hormone receptor and HER2 status. J Natl Cancer Inst. 2014;106(5).
[3] Verma S, Miles D, Gianni L, et al. Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med. 2012;367(19):1783–1791.
[4] Von Minckwitz G, Huang CS, Mano MS, et al. Trastuzumab Emtansine for Residual Invasive HER2-Positive Breast Cancer. N Engl J Med. 2019;380(7):617–628.
[5] Cuzick J, Sestak I, Baum M, et al. Effect of anastrozole and tamoxifen as adjuvant treatment for early-stage breast cancer: 10-year analysis of the ATAC trial. Lancet Oncol. 2010 Dec;11(12):1135-41.
[6] André F, Ciruelos EM, Juric D, et al. Alpelisib plus fulvestrant for PIK3CA-mutated, hormone receptor-positive, human epidermal growth factor receptor-2-negative advanced breast cancer: final overall survival results from SOLAR-1. Ann Oncol. 2021 Feb;32(2):208-217.
[7] Turner NC, Im SA, Saura C, et al. Inavolisib-Based Therapy in PIK3CA-Mutated Advanced Breast Cancer. N Engl J Med. 2024 Oct 31;391(17):1584-1596.
专家简历
专家介绍
温州医科大学附属第一医院乳腺外科主任医师
中国抗癌协会癌康会乳甲专业委员会委员
中国抗癌协会癌康会乳房微创与乳房重建学组委员
中国医药教育协会乳腺癌专业委员会浙江省分会常委
浙江省数理协会循证医学专业委员会常委
温州市乳腺癌专业委员会副主任委员
浙江省免疫学学会第六届理事会理事
浙江省乳腺癌质控专家委员会委员
浙江省肿瘤外科专业委员会常委
浙江省临床免疫学专委会常委
浙江省乳腺癌专业委员会常委
《中华乳腺病杂志》编委
排版编辑:肿瘤资讯-Delia











 苏公网安备32059002004080号
苏公网安备32059002004080号


