近年来,虽然分子靶向药物和免疫疗法的飞速发展极大地丰富了结直肠癌的治疗手段,但疾病的复发和耐药仍是临床上面临的严峻挑战。在此背景下,曲氟尿苷替匹嘧啶(TAS-102)作为一种新型口服化疗药物,为转移性结直肠癌的治疗带来了新的曙光。本文旨在通过分析三例具体病例,深入探讨TAS-102在结直肠癌治疗中的实际疗效,为临床实践提供新的思路和参考。
病例一
病例汇报:
陈海婷教授 盐城市第一人民医院
病例点评:
刘惠兰教授 泰州市人民医院
汪霖教授 徐州医科大学附属医院
李成光教授 盐城市第一人民医院
中国抗癌协会多原发和不明原发肿瘤专委会委员
江苏省中医药学会肿瘤委员会青年委员
江苏省抗癌协会肿瘤营养青年委员
盐城市抗癌协会胃肠肿瘤专业委员会秘书长
盐城市抗癌协会肿瘤免疫治疗委员会秘书
擅长恶性肿瘤的综合治疗、主持省卫健委课题一项、近年发表多篇SCI及核心期刊论文
患者基本情况
一般资料:男性,60岁。
现病史:
2020年2月出现大便不成形、次数增多、排便习惯改变,偶有便血。2020年6月出现左腹部隐痛。
辅助检查:
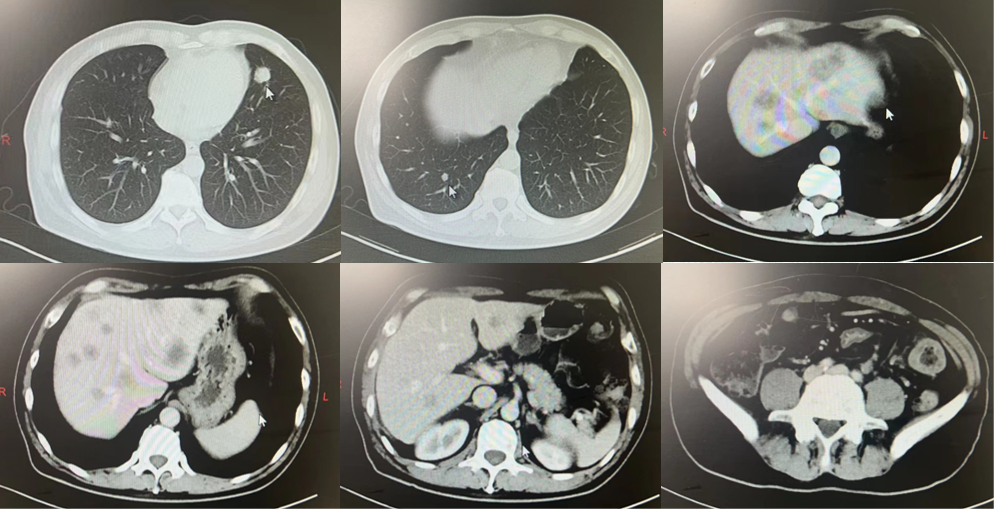
胸腹部CT(2020年6月24日):右上肺钙化灶、左下肺占位及双肺多发小结节考虑转移;肝内多发异常密度灶考虑转移;结肠及直肠占位可能;腹膜后肿大淋巴结(图1)。
肠镜(2020年6月):距肛门25cm处见肿块,活检病理示腺癌。
基因检测:KRAS、NRAS、BRAF均为野生型。
诊疗经过
转化治疗
2020年6月26日予以FOLFIRI方案化疗。
后于2020年7月10日、7月28日、8月12日、8月27日、9月10日、9月25日、10月10日、10月25日、11月9日、11月28日予以西妥昔单抗+FOLFIRI方案化疗,每四次治疗后复查CT,提示肺部及结直肠部占位较前缩小。
手术治疗
2020年12月29日于外院行结肠癌根治术。术后病理:(化疗后结肠)缩窄型腺癌,分化Ⅱ级,侵润浆膜下层,脉管内见癌栓。肠旁淋巴结1/20枚转移。KRAS、BRAF野生型。
一线治疗
患者术后予以西妥昔单抗+亚叶酸钙+5-氟尿嘧啶治疗6周期,至2021年3月31日。
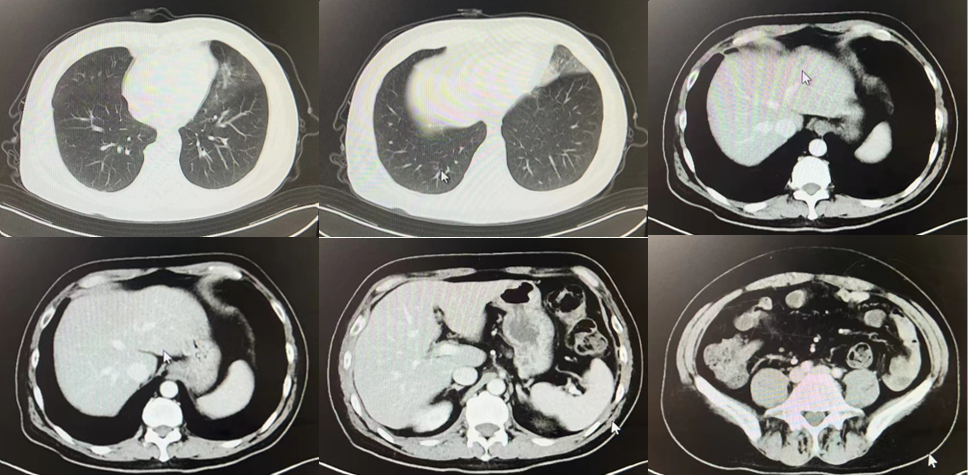
2021年3月16日复查CT提示肝内占位较前新增(图2);2021年4月20日行PET-CT检查提示肝脏多发转移瘤较前新增。
二线治疗
患者于2021年4月28日、5月12日、5月26日、6月9日予以贝伐珠单抗+FOLFOX6方案化疗4周期。后因拟行肝病灶切除,停用贝伐珠单抗,于2021年7月5日、7月21日予FOLFOX方案2周期。
2021年8月12日于外院行肝叶切除术+复杂肠粘连松解术+肝病损射频消融术。术后病理符合肠腺癌肝转移。
2021年9月9日、9月29日、10月19日、11月10日予以贝伐珠单抗+卡培他滨方案化疗4周期。
2021年11月30日复查CT提示两肺多发转移较前进展,MRI示肝右叶及尾状叶活性灶。
2021年12月8日、12月23日、2022年1月6日、2022年1月19日、2月9日、2月23日、3月8日、3月23日、4月7日予以贝伐珠单抗+FOLFIRI方案化疗。
2022年4月7日复查CT提示病灶无法对比,留取基片;改为贝伐珠单抗+伊立替康继续治疗。
2022年6月21日复查CT示病情缓慢进展;疗效评价为疾病稳定(SD)。
分别于2022年6月22日、7月29日、8月20日予以贝伐珠单抗+伊立替康治疗。
期间复诊示肝脏及双肺病灶逐渐增大,后患者诉无法耐受化疗。
三线治疗
患者于2022年9月改用瑞戈非尼靶向治疗。
复查肿瘤标志物较前明显升高,予以瑞戈非尼+恩沃利单抗治疗。
11月10日再次复查肿瘤标志物增高,CT示双肺及肝脏病灶增大,加用替吉奥口服后肿瘤标志物下降。
2023年1月30日复查CT提示病灶较前缓慢进展;疗效评价为SD,肿瘤标志物上升,用药至2023年3月15日。
2023年4月10日复查CT示提示病灶较前增大;疗效评价为疾病进展(PD)。
2023年4月13日行TACE治疗。
再次行肝脏穿刺病理提示同前,基因检测KRAS、NRAS、BRAF均为野生型,HER2(0),微卫星稳定(MSS)。
四线治疗
2023年5月8日至2023年11月3日予以西妥昔单抗+伊立替康+恩沃利单抗治疗12周期,期间CT提示SD。
2023年11月14日复查CT示结肠MT术后改变,直肠MT,侵犯周围脂肪间隙,肠周淋巴结,较前相仿。
2023年11月22日行肠镜示:(距肛缘5cm)粘膜腺上皮呈上皮内高级别瘤变(重度异型增生)。
2023年11月22日行奥沙利铂+雷替曲塞化疗1周期,后予以直肠病灶放疗21次,末次放疗时间为2024年1月15日(因放疗期间结肠吻合口大出血,放疗未完成)。
2024年2月2日至2024年4月5日继续予以奥沙利铂+雷替曲塞化疗。
病例小结
本病例为一例60岁男性晚期结肠癌患者,初诊即伴肝肺转移(Ⅳ期),KRAS/NRAS/BRAF野生型。患者经历了多线治疗,包括化疗、靶向治疗、靶向联合化疗和免疫治疗。期间接受了结肠原发灶切除术、肝脏TACE以及针对新发直肠病灶的放疗,为患者带来了良好的生存获益。
病例二
病例汇报:
李倩教授 徐州市肿瘤医院
病例点评:
陈艳教授 盐城市第一人民医院
赵阳教授 徐州医科大学附属医院
夏扬教授 扬州市中医院
徐州市肿瘤医院肿瘤内科
中国肿瘤医学会会员
徐州抗癌协会肺癌专业委员会委员
徐州抗癌协会肿瘤姑息与康复治疗专业委员会委员
徐州抗癌协会肿瘤康复专业委员会委员
获徐州市卫生健康委青年医学科技创新项目两项
患者基本情况
一般资料:女性,52岁。
现病史:2019年9月因“大便次数较多伴里急后重感及血便”就诊。
辅助检查:电子结肠镜检查:1.直肠占位待病理;2.结肠多发息肉。病理提示:“直肠”腺癌。
初步诊断:直肠腺癌。
诊疗经过
手术治疗
患者于2019年9月17日行腹腔镜直肠癌根治术(Miles术式)。
术后病理提示:“肛门+直肠+部分乙状结肠切除标本”中分化腺癌,侵及全层达周围脂肪组织,两侧切缘均未见癌,肠周淋巴结15枚均未见癌转移。免疫组化结果提示:CK7(-),CK8(+),CDX2(-),Villin(+),Ki-67(+,80%),P53(-), MSH2(+),MSH6(+),MLH1(+/-),PMS2(+)。
术后诊断:直肠腺癌pT3N0M0 ⅡB期,MSS型。
辅助治疗
2019年10月23日开始同步放化疗:放疗剂量50Gy/25f,卡培他滨1500mg bid d1-14同步化疗,后于2019年11月26日开始行6周期XELOX方案化疗,末次化疗时间为:2020年4月9日。
治疗后定期复查,未见肿瘤进展,并行结肠息肉切除术。
2021年4月复查CT提示双肺散在结节,右上肺结节稍增大(图3)。PET-CT提示右上肺结节考虑转移。
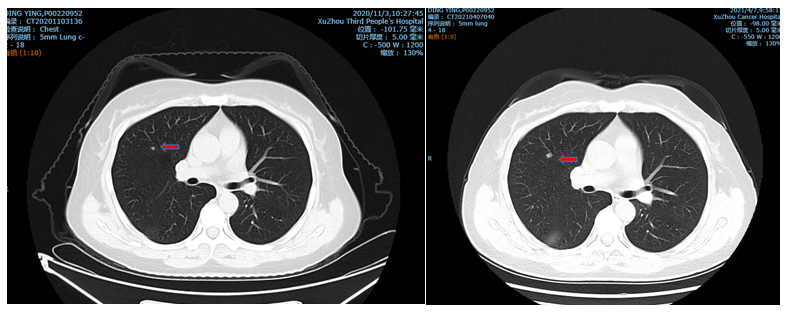
2021年4月15日行CT引导下右上肺结节穿刺活检+消融术。病理提示:“肺肿瘤”穿刺物:见少许腺癌组织,结合病史考虑直肠腺癌转移。免疫组化结果:CDX2(+),Villin(+),CK8(+),CK7(-),NapsinA(-),TTF-1(-)CK5/6(-),P40(-),Ki-67(+,40%),CK20(+)。
“肺肿瘤”穿刺物:基因检测提示PD-L1:TPS:5%,AKT-1,BRAF,KRAS,NRAS,PIK3CA,PTEN,APC,TP53未见相关突变位点。
一线治疗
2021年5月8日至2021年10月11日予以西妥昔单抗+FOLFIRI方案化疗12周期,复查提示肺部转移灶缩小。后予西妥昔单抗联合卡培他滨维持化疗7周期。
不良反应:Ⅱ度皮疹,Ⅱ度骨髓抑制。
2022年3月复查胸部CT提示右上肺团片影,两肺多发结节及斑片影,部分结节较前片有所增大。疗效评估:SD。
继续予西妥昔单抗联合卡培他滨维持化疗。
2022年6月复查胸部CT示两肺多发转移瘤,较前片(2022年3月2日有所增大。疗效评估:PD。
二线治疗
患者于2022年6月18日至2023年5月26日予以贝伐珠单抗+雷替曲塞治疗11周期。期间复查CT提示肺部结节稳定中缓慢增长。
不良反应:高血压Ⅲ级。
2023年7月5日复查胸腹部CT提示直肠MT术后改变,盆腔少量积液;两肺多发实性结节,同2023年4月26日比较,右肺上叶结节有增大,并左上肺一新发结节。疗效评估:PD。
三线治疗
患者于2023年7月开始口服TAS-102联合呋喹替尼(初始5mg QD,后因粘膜炎减量为4mg QD)治疗。
期间定期复查提示病灶稳定。
2024年1月-30日复查胸部CT示两肺多发转移瘤,较前片比较,左肺尖新增一较大结节,余变化不大。
2024年1月31日行CT引导下肺占位穿刺活检,病理示:少许肺组织少量炎细胞浸润,大部分组织坏死变性,结构不清。给予抗感染治疗(静滴10天,后改为口服药物)。定期复查提示两肺多发转移瘤,左肺尖结节较前有所退缩。
2024年4月25日复查胸部CT提示两肺多发转移瘤,左肺上叶纵隔旁结节较前增大。
患者肿瘤局部进展,继续口服TAS-102联合呋喹替尼全身治疗,并于2024年5月2日行左肺上叶纵隔旁结节粒子植入治疗,不良反应轻微。
2024年7月8日复查胸部CT提示两肺多发转移瘤,部分粒子植入术后较前缩小。
2024年8月患者出现左下肢疼痛,检查提示左股骨及L4椎体多发骨转移。
后线治疗
患者于2024年8月14日开始予以替雷利珠单抗联合吉西他滨+奥沙利铂化疗2周期。
2024年10月8日行左下肢骨转移灶放疗95% PTV PTV 50Gy/2Gy/25F。
2024年11月25日复查胸腹部CT提示:肺部病灶较前片相仿。肝右叶转移瘤,较前片新增,考虑转移。MR提示:左股骨、L4椎体多发骨质破坏、转移,右侧臀中肌、臀小肌软组织肿胀。膀胱右后侧壁稍厚。盆腔少量积液。左膝退变。左膝关节双侧半月板变性。左膝关节腔及髌上囊少量积液。
患者肿瘤再次进展,拒绝抗肿瘤治疗,给予最佳对症支持治疗。
病例小结
本病例为一例52岁女性直肠癌患者,直肠癌根治术后接受辅助治疗后19个月出现肺转移。一线使用西妥昔单抗联合FOLFIRI及维持治疗,PFS为14个月。二线使用贝伐珠单抗联合雷替曲塞,PFS为13个月。三线使用TAS-102联合呋喹替尼,期间联合局部粒子植入,PFS为13个月。四线因骨转移使用替雷利珠单抗联合化疗及放疗,PFS为3个月。最终出现肝转移,转为最佳支持治疗。患者总生存期较长,经历了规范的多线治疗。
病例三
病例汇报:
丁晓蓉教授 淮安市第一人民医院
病例点评:
孙昕教授 扬州市中医院
秦晓冰教授 徐州医科大学附属医院
余磊教授 泰州市人民医院
淮安市抗癌协会消化道肿瘤青委会委员
淮安市第一人民医院肠癌MDT团队秘书
主持南京医科大学校基金重点项目一项
参与国家自然科学面上基金一项
患者基本情况
一般资料:女性,65岁。
主诉:2021年11月因“下腹部疼痛”就诊。
既往史/家族史:否认相关病史及家族史。
辅助检查:
肠镜:距肛门15cm见环周生长新生物,肠腔狭窄。病理提示腺癌。
全腹部CT:乙状结肠占位,伴周围淋巴结肿大;肝脏多发结节,考虑转移。
盆腔MR:乙状结肠癌(T4N2Mx)考虑。
基因检测:K-RAS、N-RAS、BRAF均为野生型。
初步诊断:乙状结肠腺癌伴同时性肝转移(cT4N2M1,Ⅳ期)。
诊疗经过
转化治疗
患者于2021年11月入组重组抗EGFR人鼠嵌合单克隆抗体注射液(CMAB009)联合FOLFIRI化疗方案与FOLFIRI化疗方案单用一线治疗RAS/BRAF基因野生型、转移性结直肠癌的开放、随机对照、多中心、前瞻性Ⅲ期临床研究。
2021年11月24日、12月9日、12月24日、2022年1月8日开始行单克隆抗体注射液(CMAB009/安慰剂)联合FOLFIRI化疗方案4周期。
期间定期复查,提示结肠原发病灶较前缩小(病灶大小83mm-53mm),肝转移灶缩小(病灶大小84mm-27mm)。病情评估:部分缓解(PR)。
2022年1月23日、2月7日、2月21日、3月7日继续行单克隆抗体注射液(CMAB009/安慰剂)联合FOLFIRI化疗方案4周期。
期间定期复查,提示结肠原发病灶较前缩小(病灶大小53mm-40mm),肝转移灶稍缩小(病灶大小27mm-21mm)。
手术治疗
患者于2022年3月24日行腹腔镜乙状结肠癌切除+末端回肠造口+肠粘连松解术。术后病理提示乙状结肠中分化腺癌,侵润固有肌层外纤维组织(ypT3),淋巴结阴性(ypN0)。AJCC肿瘤退缩分级:TRG 2级。免疫组化:HER2(0),pMMR,Ki-67(约80%+)。
一线治疗
2022年5月4日至2022年6月21日继续予CMAB009/安慰剂+FOLFIRI方案4周期。
2022年6月28日至2022年9月8日继续予CMAB009/安慰剂单药维持治疗。末次影像学检查提示靶病灶及非靶病灶均为0mm,疗效评估为完全缓解(CR)。
2022年10月13日行全麻下行腹腔镜探查+回肠造口回纳+肠粘连松解术。
2023年2月9日复查腹部MRI提示肝脏多发异常信号,较大直径约20mm,考虑转移复发(图4)。
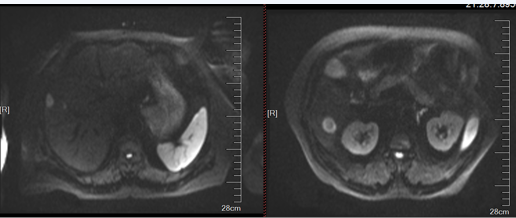
二线治疗
患者于2023年2月10日至2023年4月20日予以贝伐珠单抗+奥沙利铂+雷替曲塞治疗4周期。
期间病情评估PR。
建议行肝转移灶局部治疗,患者拒绝。
于2023年5月24日至2023年9月14日予以贝伐珠单抗+卡培他滨维持治疗。
2023年10月6日复查MRI提示肝右下叶病灶较前略增大。
2023年10月27日在全麻下行肝肿瘤切除+肠粘连松解术。术后病理提示(部分肝)腺癌,倾向肠癌转移。免疫组化:HER2(2+),pMMR,Ki-67(约40%+)。
2023年12月16日复查MRI提示肝脏多发异常信号,部分较前片明显增大。
三线治疗
患者于2023年12月18日入组TAS-102联合瑞戈非尼三线临床试验至今,期间病情评估SD。
病例小结
本病例为一例65岁女性乙状结肠癌伴同时性肝转移(Ⅳ期,RAS/BRAF野生)患者。通过入组临床试验获得PR,成功接受了腹腔镜乙状结肠癌切除+末端回肠造口+肠粘连松解术,并在维持治疗后达到CR。然而,后续出现肝脏复发。二线治疗后再次出现肝脏进展,接受了肝转移灶切除术,术后肝脏再次进展,三线入组TAS-102联合瑞戈非尼临床试验,获得SD。该病例体现了转化治疗的价值,但也提示了肝脏病灶处理时机的重要性以及疾病的持续复发风险。
总结
结直肠癌的治疗需要综合考虑患者的具体情况和疾病特点,制定个体化的治疗方案,并注重MDT和综合治疗的应用。以上三例病例展示了结直肠癌患者在不同治疗阶段面临的挑战及应对策略。一方面,随着新药的不断涌现和治疗手段的不断丰富,患者的生存期得到了显著延长;另一方面,如何优化治疗策略、提高治疗效果、降低治疗毒性以及探索新的治疗靶点仍是当前研究的热点和难点。通过MDT模式,可以整合各学科的专业优势,为患者制定更加个体化和精准的治疗方案,从而提高治疗效果和患者的生存率。
排版编辑:肿瘤资讯-jyy











 苏公网安备32059002004080号
苏公网安备32059002004080号


