神经内分泌肿瘤是一类起源于神经内分泌细胞的异质性肿瘤,常见于胃肠道和胰腺,临床表现多样。由于大多数神经内分泌肿瘤生长缓慢且初期症状不典型,确诊时往往已进展至晚期。奥曲肽作为长效生长抑素类似物,是目前治疗功能性神经内分泌肿瘤的标准药物之一,具有抑制激素分泌、缓解类癌综合征症状以及潜在抗肿瘤生长的双重作用。多项临床研究已证实其在控制病情进展方面的疗效。近年来,奥曲肽在联合靶向治疗、肝转移灌注治疗及PRRT中的角色也日益受到关注,显示出良好的耐受性与疗效前景。
本文通过分析三例神经内分泌肿瘤病例,探讨奥曲肽微球在延缓肿瘤进展、改善患者生活质量方面的疗效,以期为神经内分泌肿瘤的治疗提供新的临床借鉴。
病例一
病例汇报:
樊扬威教授 西安交通大学第一附属医院
病例点评:
周波教授 浙江大学医学院附属第二医院
谢饶英教授 温州医科大学附属第一医院
陕西省抗癌协会抗癌药物专委会委员
陕西省抗癌协会肿瘤生物治疗专委会委员
西安市癌症康复协会精准治疗专业委员会委员
发表学术论文23篇,其中以第一作者(包含共一)或通讯作者发表SCI论文12篇
4次在国内外高端学术会议进行口头汇报或壁报展示
主持和参与8项国家级、省部级、校级和院级自然科学基金
参与10余项国家抗肿瘤新药临床研究项目
1. 患者基本情况
一般资料:男,61岁。
主诉:腹泻1年余。
家族史:否认肿瘤家族史。
既往史、个人史、婚育史:无特殊。
病史简介:患者于2016年在宝鸡某医院接受胆囊切除术。后因间断腹泻1年余,于2019年在西京医院因胰腺肿瘤行胰十二指肠切除术,术后病理诊断为胰腺非功能型NET G2,术后未予进一步治疗。2020年6月,患者出现背部疼痛、腹泻症状。
辅助检查:PET/CT示:1、“胰腺神经内分泌肿瘤切除术后”,肝脏数个低密度结节,糖代谢轻度活跃,生长抑素受体显像强阳性,考虑转移;2、胰腺、胆囊、部分胃及十二指肠术后缺如;术区、腹主动脉旁及肠系膜多发小淋巴结影,糖代谢未见活跃,生长抑素受体显像阴性,考虑反应性增生,建议随访;肝内胆管少许积气;3、拟结节状甲状腺肿:双肺少许纤维增殖灶;双下胸膜增厚;右肾囊肿;前列腺稍增大;4、余所见部位PET/CT显像未见异常高代谢病灶。肝穿刺活检病理示:肝组织内肿瘤细胞呈团巢状或腺样分布,细胞大小、形态较一致,核分裂像约3个(所有肿瘤约4个HPF)。结合HE形态及免疫组化结果,病变符合肝转移性神经内分泌肿瘤,G2。
治疗经过:2020年7月起,患者开始定期行长效奥曲肽(20 mg)治疗,并在中山医院行肝脏射频消融。术后反复出现寒战、高热,伴头痛,无头晕、恶心、呕吐,亦无腹痛、腹胀等。2020年7月27日行肝脓肿穿刺活检术,脓液培养提示为“大肠埃希菌及白色假丝酵母”感染。遂予以“泰能、达托霉素、多粘菌素及两性霉素B”等抗感染治疗。2020年8月1日患者再次出现发热,体温最高达40℃,无寒战,伴轻度头痛,无恶心、呕吐及明显胸闷、气短症状。
诊断:胰腺神经内分泌肿瘤(T2N0M1,G2功能性);肝转移射频消融术后;肝脓肿。
2. 诊疗经过
2020年8月4日,患者接受肝胆外科治疗,经抗感染、营养支持及对症处理后症状逐渐缓解。自2020年9月24日起,开始使用长效奥曲肽治疗,剂量为30 mg im q4w,腹泻症状明显缓解。
2022年10月,患者出现大便次数增多,复查提示肝部肿瘤较前增大。2022年10月及11月,将长效奥曲肽剂量调整为60 mg im q4w。加量后腹泻症状明显改善。但复查提示肝部肿瘤较前增多增大,遂调整治疗方案为卡培他滨联合替莫唑胺进行两个周期化疗,期间患者腹泻次数增加明显伴有体重减轻。
2023年2月起,进一步调整治疗方案为长效奥曲肽120 mg im,联合口服索凡替尼300 mg qd po。至2023年5月复查时可见肝脏同一层面的部分病灶明显缩小,提示治疗方案有效。患者对该联合治疗方案耐受良好,腹泻症状显著缓解,基本消失。总体来看,肿瘤负荷较前明显减轻,疗效明确。
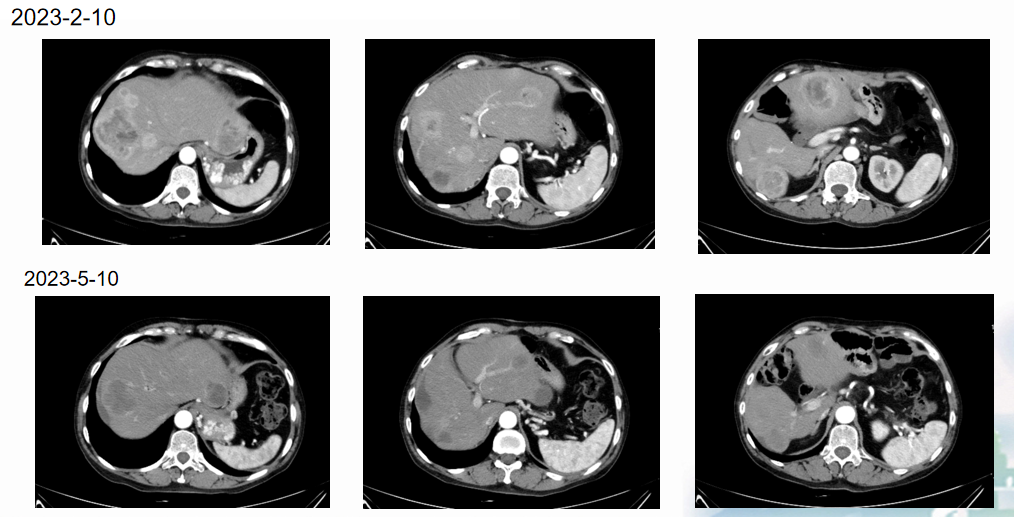
目前患者进入定期随访阶段,按照每三个月复查一次的节奏进行疾病监测。随访结果显示,肝脏病灶基本保持稳定状态。2024年2月的影像复查亦未见明显进展,血清神经元特异性烯醇化酶(NSE)水平维持在正常范围内小幅波动,提示疾病控制良好。
病例小结
患者胰十二指肠切除术后复发,后接受长效奥曲肽20 mg治疗,并在中山医院行肝脏射频消融术,术后因继发感染出现严重并发症。患者后奥曲肽治疗剂量调整至30 mg q4w,腹泻症状明显缓解。2022年复查肝转移病灶进展,10月及11月剂量升至60 mg q4w后腹泻改善,但影像提示病灶持续增多增大,故调整方案为卡培他滨联合替莫唑胺化疗,疗效不佳且腹泻加重。
2023年2月起改为奥曲肽120 mg联合索凡替尼300 mg方案,患者耐受良好,腹泻基本缓解,至5月复查部分肝转移灶明显缩小,提示治疗方案有效。此后患者按每3个月随访一次,2024年2月影像复查未见明显进展,血清NSE指标波动于正常范围,提示疾病控制良好。
病例二
病例汇报:
童舟教授 浙江大学医学院附属第一医院
病例点评:
王晶教授 华中科技大学同济医学院附属协和医院
陈心教授 武汉大学人民医院
中国医疗保健国际交流促进会消化道肿瘤多学科(MDT)分会委员
浙江省抗癌协会抗癌药物专委会青委
主持国家自然科学青年基金,参与多项国家自然科学基金及省部级基金
以第一作者及参与作者发表论文10余篇,摘要在ESMO、ENET等国际会议上汇报并收录
擅长消化道、泌尿系肿瘤的靶向与免疫治疗
1.患者基本情况
一般资料:女,31岁。
主诉:因体检发现胰腺肿物就诊。
既往史:否认高血压、乙肝、结核、呼吸系统、糖尿病等疾病。
体格检查:ECOG 0分,腹部无压痛,无反跳痛。
辅助检查:2007年6月5日腹部CT示:胰体尾部占位,富血供肿瘤考虑,请结合临床。
治疗经过:
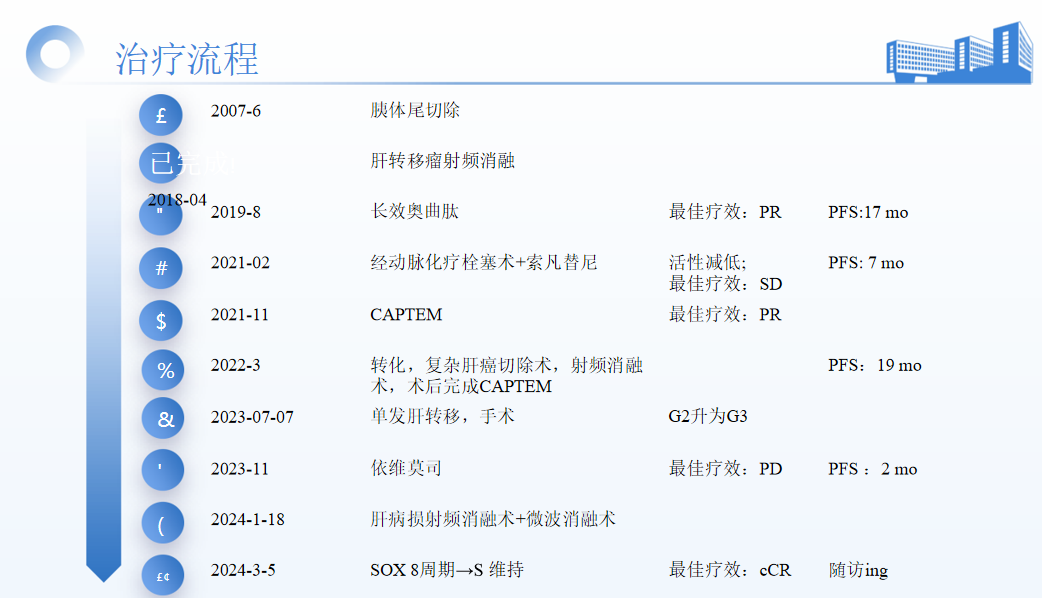
手术治疗(第一次手术):2007年6月8日行保留脾脏的胰体尾切除术。术中见肿瘤位于胰体尾交界处,3x3 cm,界清,与周围无浸润,未侵犯脾动静脉,腹腔内未见转移结节。病理:胰体尾神经内分泌肿瘤(低度恶性),免疫组化Ki67 4%,符合神经内分泌肿瘤G2。
2015年1月12日胰腺MRI示:胰体尾部部分切除术后复查。肝脏多发小结节状异常信号,转移性病灶待排,需随访复查。2018年1月10日胰腺MRI示:肝脏多发结节灶,考虑转移瘤,部分病灶增大。2018年4月23日行肝转移瘤射频消融。
2019年8月18日肝脏MRI示:1. 肝脏部分转移瘤RFA术+胰体尾部部分切除术后改变。2. 肝脏多发转移瘤,较前片(2018年8月20日CT)部分病灶有所增大。3. 胃小弯旁结节,转移瘤考虑,较前片大致相仿。4. 脂肪肝。
诊断:胰腺神经内分泌肿瘤伴肝转移(NET,G2)
2. 诊疗经过
长效奥曲肽一线系统治疗
考虑肝多发转移,先予系统治疗。2019年8月开始长效奥曲肽30 mg治疗。4个月后(2019年12月)复查示:1. 肝脏转移瘤RFA术+胰体尾部分切除术后改变。2. 肝脏多发转移瘤,右肝部分边缘强化,建议随访。3. 胃小弯淋巴结转移,较前(2019-8-28MR)缩小。 4. 脂肪肝。2021年1月复查示:肝脏多发转移瘤,对照2020年07月29日MR病灶明显增大。
进展后患者于2021年2月22日行经动脉化疗栓塞术。2021年3月30日肝脏多发转移瘤治疗后复查,对照2021年1月27日MR,肿瘤活性减低,部分病灶稍缩小。
索凡替尼二线系统治疗
患者于2021年3月29日至2021年11月10日接受索凡替尼二线系统治疗。其中,3月29日至6月2日疗效为SD;6月2日至11月10日疗效为PD(肝脏部分转移灶较前进展,肝左静脉癌栓较前增多)。
CAPTEM三线系统治疗
患者于2021年11月开始接受CAPTEM方案治疗。2022年3月11日复查示肝脏转移灶有所缩小,疗效评估为PR。转化手术治疗(第二次手术):患者于2022年3月16日接受复杂肝癌切除术(侵犯第一、第二肝门血管及下腔静脉)+肠粘连松解术,术中探查见腹腔可见明显黏连,肝脏脂肪肝表现,肝脏表面多发占位,包膜完整。结合术中超声造影,可见多发占位,较大为4×2.5 cm,位于左肝外叶。此外,患者于2022年5月4日接受肝癌射频消融术。考虑术前CAPTEM治疗有效,2022年7月术后继续CAPTEM治疗3周期。
2022年10月22日PET(18F-奥曲肽)示:肝脏前缘包膜小结节(见定位线),奥曲肽摄取稍增高,考虑转移灶可能:另腹膜后见多发淋巴结,其中一枚小淋巴结,奥曲肽摄取增高(见定位线),考虑转移可能。
CAPTEM方案用药至2023年6月。2023年6月5日肝脏MRI示:胰体尾部分切除术+肝脏多发转移瘤术后改变;肝S2异常信号灶,恶性肿瘤考虑,对比2023年2月1日MRI新增。考虑肿瘤单发,行手术切除。患者于2023年7月7日接受肝部分切除+肠粘连松解。病理示:Ki-67(+,30%)。时空异质性:G2升为G3。
2023年8月5日PET(18F-奥曲肽)示:胰腺体尾部部分切除,残余胰腺未见明显异常密度影及奥曲肽摄取增高灶,达到NED状态。
依维莫司四线系统治疗
2023年11月1日肝脏MRI示:胰体尾部分切除+肝脏术后改变,左肝术区少许积液。肝内散在多发DWI高信号结节,以肝S6、S8病灶为著,对照2023年6月14日MRI病灶进展,首先考虑转移瘤。考虑术后短期复发,暂不考虑手术,予以系统治疗。建议患者静脉化疗,患者拒绝,2023年11月给予依维莫司10mg qd治疗。PFS:2个月。患者于2024年1月18日接受肝病损射频消融术+微波消融术。
2024年3月3日肝脏MRI示:胰体尾部分切除+肝脏术后改变,左肝术区少许积液。肝S6、S8病灶治疗后改变,未见明显强化;肝内散在多发DWI高信号结节,对照2024年1月7日MRI部分新增。
SOX化疗五线系统治疗
患者接受了4个周期的SOX方案治疗(2024.3.5、2024.3.26、2024.4.16、2024.5.7)。2024年5月6日肝脏MRI示:胰体尾部分切除+肝脏术后改变。肝S6、S8病灶治疗后改变,未见明显强化;接近CR。
2024年5月8日放射阅片:末次影像2024-5-5CT、2024-5-6肝脏MR,对比前次影像:1、肝脏S5/6、S8射频治疗后,无明确肿瘤活性表现。2024.5.28、2024.6.18、2024.7.9、2024.8.9行SOX方案化疗第5-8周期。后改替吉奥维持治疗至今。
病例小结
本例患者诊断为胰腺神经内分泌肿瘤(NET G2),后出现肝转移。整个病程历经多种治疗模式,包括根治性手术、射频消融、TACE及多线系统治疗(如长效奥曲肽、索凡替尼、CAPTEM、依维莫司、SOX方案),充分体现了多学科协作(MDT)在复杂神经内分泌肿瘤管理中的价值。患者目前已生存17年,疾病控制良好,接近CR,反映出个体化综合治疗策略的长期获益。
这例病例的治疗过程中高度重视肿瘤的转化治疗机会,在可行时积极争取根治性切除,以期实现NED。同时,随着病程演进,患者病灶出现了由G2向G3的病理演变,提示肿瘤存在明显的时空异质性。这一变化进一步强调了神经内分泌肿瘤在治疗过程中进行病理重新评估的重要性。
从疗效观察来看,在G2阶段,CAPTEM方案可达到PR;而进入G3阶段后,SOX方案则带来更显著的肿瘤缓解,甚至达到CR。这一差异也印证了随着Ki-67增高,肿瘤对细胞毒性化疗的敏感性增强,化疗的获益进一步提升。
病例三
病例汇报:
施慧英教授 华中科技大学同济医学院附属协和医院
病例点评:
纪洪辰教授 空军军医大学西京医院
张琼教授 空军军医大学西京医院
擅长方向:消化道肿瘤(胃肠胰神经内分泌肿瘤)
主持国家/湖北省自然科学基金项目3项,参与国家重点研发计划项目1项
以第一/共一作者在Gastroenterology、Endoscopy、LancetDigitalHealth等杂志发表研究论文30余篇,其中神经内分泌肿瘤相关研究曾被ENETS(欧洲神经内分泌肿瘤学会)年会收录,被2023年胰腺神经内分泌肿瘤肝转移诊治中国专家共识引用
曾多次受邀在中华医学会消化年会、亚太消化疾病周、美国消化疾病周开展相关演讲报告和交流曾获中华医学科技奖青年科技奖、湖北省科技进步一等奖
中华医学会消化病学分会医工交叉协作组委员
湖北省医师协会消化病学分会青年工作组副组长
1.患者基本情况
一般资料:女,73岁。
治疗经过:22年前(2003年)体检行肝脏B超检查发现肝脏多发占位。
进一步检查提示胃小弯十二指肠肝脏占位性病变(未见资料),行肝左外叶切除术+肝右叶肿瘤切除术+胃大部十二指肠根治术,术后病理提示肝脏转移性神经内分泌肿瘤(NET G2),原发病灶为胃来源可能。
术后定期复查CT检查提示肝内外多个混合性病灶,遂于2004年3月、2008年4月、2012年5月、2013年1月、2014年4月、2015年5月多次行肝脏转移瘤栓塞及微波治疗。
2016年7月将2003年手术蜡块重新切片染色,报告提示:十二指肠及肝肿物形态基本一致,瘤细胞中等大小,胞浆丰富红染,部分核偏位,核仁不明显,核分裂不易找到,瘤细胞呈巢团样分布,肝血管内见大量的瘤栓,十二指肠内瘤细胞浸润黏膜肌层及固有肌层,免疫组化提示Syn(+),Cga(-),SSTR强阳性,Ki-67:1%。
诊断:
十二指肠NET G1并肝脏多发转移(转移灶:肝脏神经内分泌肿瘤,NET G2)。
2. 诊疗经过
2016年至2019年期间,患者接受奥曲肽微球(30 mg)治疗,疗效评估为SD。2019年7月起因疫情停用生长抑素类似物治疗,复查显示PD。
2021年9月患者行肝动脉栓塞术(TAE),术后于2021年11月起启动索凡替尼治疗。2022年3月复查评估为PR。
自2021年11月至今,患者持续接受索凡替尼治疗,病情稳定。
病例小结
本例术后患者病情呈慢性复发性进展,2004年至2015年间,先后多次接受肝转移病灶的动脉栓塞及微波消融治疗(分别于2004年3月、2008年4月、2012年5月、2013年1月、2014年4月、2015年5月实施)。
2016年7月,对2003年手术保存蜡块进行重新切片染色及免疫组化分析,结果提示原发病灶为十二指肠NET G1,转移灶为肝脏NET G2,SSTR表达强阳性,Ki-67指数为1%。
2016年至2019年,患者接受奥曲肽微球(30 mg)治疗,疗效评估为SD。2019年7月起因疫情影响中断治疗,后复查提示PD。2021年9月行TAE,术后于2021年11月起开始口服索凡替尼治疗。2022年3月影像学复查显示病灶缩小,疗效评估为PR。截至目前,患者持续接受索凡替尼治疗,病情保持稳定,整体病程长达20余年,显示出良好的长期生存和治疗获益。该病例体现了十二指肠神经内分泌肿瘤预后相对较好,即使出现肝转移,生存期仍然较长。此外,肝脏介入+内科药物治疗对于十二指肠NET多发肝转移可能有较好的疗效。
总结
奥曲肽是一种合成的生长抑素类似物,目前已广泛应用于神经内分泌肿瘤的治疗中。其通过高亲和力结合生长抑素受体,不仅能有效抑制功能性神经内分泌肿瘤激素相关症状,还具有明确的抗肿瘤增殖作用。目前,大量临床研究证实奥曲肽在控制疾病进展方面的疗效,特别适用于表达SSTR的胃肠胰神经内分泌肿瘤患者。此外,奥曲肽还可用于影像诊断和PRRT的前期评估。作为神经内分泌肿瘤长期管理的重要组成部分,奥曲肽在延缓肿瘤进展、改善生活质量方面发挥着关键作用。
排版编辑:肿瘤资讯-jj











 苏公网安备32059002004080号
苏公网安备32059002004080号


