消化道肿瘤是我国高发病率和高死亡率的恶性肿瘤类型,严重威胁着国民健康。虽然NTRK基因融合在消化道肿瘤中的发生率相对较低,但由于我国消化道肿瘤患者基数庞大,携带该基因融合的患者总数仍不容忽视1。神经营养因子受体络氨酸激酶(NTRK)基因融合已成为消化道肿瘤常规检测的重要生物标志物,其临床价值日益凸显。近期,北京大学肿瘤医院沈琳教授、齐长松教授团队在European Journal of Cancer上发表了题为"拉罗替尼治疗TRK融合胃肠道肿瘤的疗效和安全性"的研究论文,为NTRK基因融合消化道肿瘤患者带来新的治疗希望。本期特邀北京大学肿瘤医院齐长松教授对研究成果进行深度解读,为我们揭示NTRK基因融合靶向治疗的最新进展与临床应用价值。
消化道肿瘤高发,NTRK基因融合的临床价值亟待解锁
2022年,我国消化道肿瘤的新发病例高达161.7万例,其中结直肠癌(CRC)发病率最高,达51.7万例,其次是肝癌(36.8万例)和胃癌(35.9万例)。这3种肿瘤类型占我国消化道肿瘤总发病数的80%以上。到2050年,我国消化道肿瘤的发病率预计持续上升,CRC仍是发病率最高的肿瘤2。
NTRK基因(NTRK1/2/3)编码原肌球蛋白受体激酶(TRK)蛋白(TRK A/B/C),主要参与神经发育和体内平衡3。NTRK基因融合在CRC中发生率为0.2-0.4%,具有非常高的肿瘤突变负荷(中位数53 mut/MB),其中大多数为微卫星高度不稳定(MSI-H) 4,5。此外,研究发现NTRK基因融合在MSH2/MLH1突变的CRC中富集,尤其在MSI-H型CRC中发生率显著升高(MSI-H 5% vs MSS 0.4%)6-11。因此,NTRK基因融合不仅是CRC的重要生物标志物,也可能为个体化治疗提供新的方向。
拉罗替尼疗效亮眼:近半数CRC患者肿瘤缓解,生存期突破29个月
拉罗替尼作为全球首个泛癌种TRK抑制剂,已在多个国家和地区获批用于治疗患有NTRK基因融合实体瘤的成人和儿童患者。近日,拉罗替尼治疗消化道肿瘤的临床研究数据已全文载于国际期刊,进一步夯实其在NTRK基因融合实体瘤治疗中的重要地位4。
研究方法
该研究纳入在II期NAVIGATE试验中接受拉罗替尼治疗的局部晚期或转移性TRK融合胃肠道肿瘤患者,主要终点为独立审查委员会(IRC)根据RECIST v1.1评估的总缓解率(ORR),次要终点为疾病控制率(DCR)、缓解持续时间(DoR)、无进展生存期(PFS)、总生存期(OS)和安全性。
研究结果
该研究共纳入44例来自NAVIGATE试验的TRK融合胃肠道肿瘤患者,包含8种不同的肿瘤类型,其中26例患者为CRC(表1)。所有患者均在当地通过NGS进行NTRK基因融合检测,鉴定出19种不同的NTRK基因融合,TPM3::NTRK1是最常见的融合类型(表2)。
表1 患者基线特征
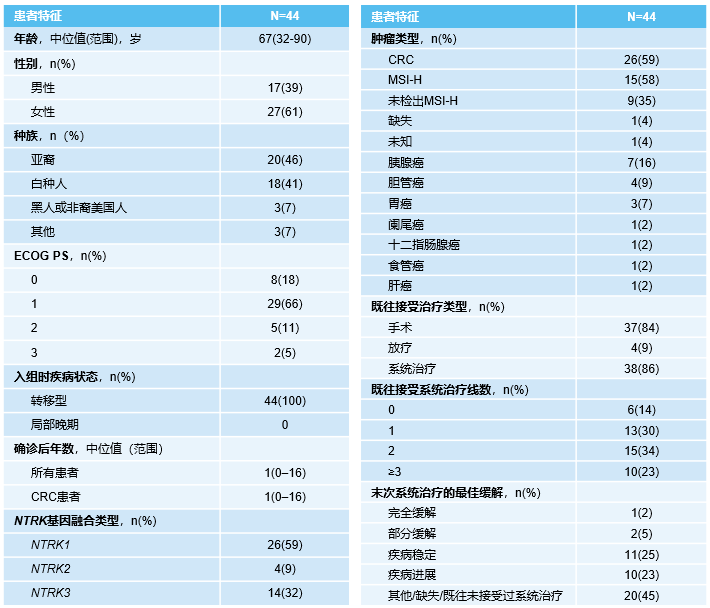
表2 不同肿瘤类型的NTRK基因及融合伴侣
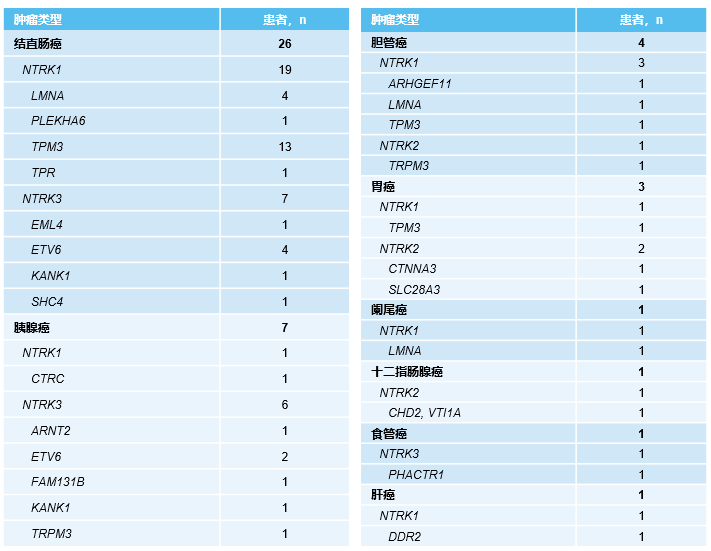
在数据截止时,35例患者有可测量病灶,其中28例患者(80%)肿瘤退缩(图1)。在所有接受拉罗替尼治疗的患者中,ORR为28%(95% CI 15-44),其中一线治疗患者的ORR最佳,高达60%(95% CI 15-95)(表3)。在CRC患者中,ORR为44%(95% CI 24-65),其中MSI-H型CRC患者的ORR为40%(95% CI 16-68),有13%的患者实现完全缓解。所有患者和CRC患者的24周DCR率分别为47%(95% CI 31-62)和56%(95% CI 35-76)。所有患者的中位至缓解时间为1.8个月,治疗持续时间从0到56+个月不等。
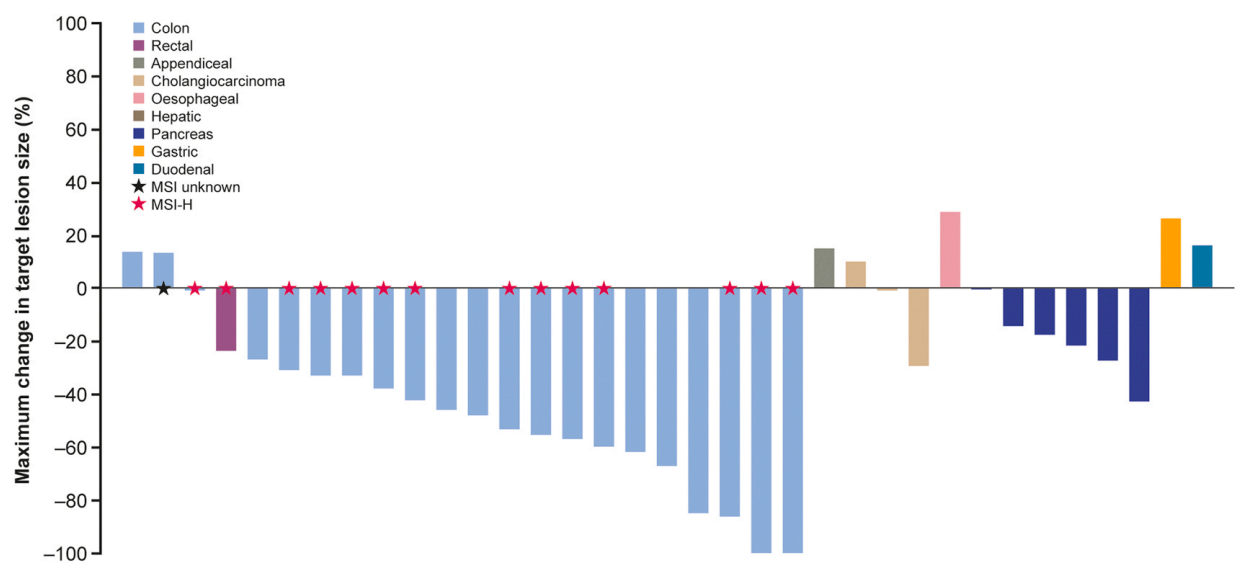
表3 拉罗替尼最佳缓解
所有患者和CRC患者的中位DoR均为27个月(95% CI 6–NE),中位PFS分别为6个月(95% CI 5-9)和7个月(95% CI 6-NE),中位OS分别为13个月(95% CI 7-29)和29个月(95% CI 7-NE)。值得注意的是,拉罗替尼在MSI-H型CRC患者中显示出卓越的疗效,中位DoR尚未达到,24个月DoR率为100%,中位PFS和中位OS均长达29个月(图2、3、4)。
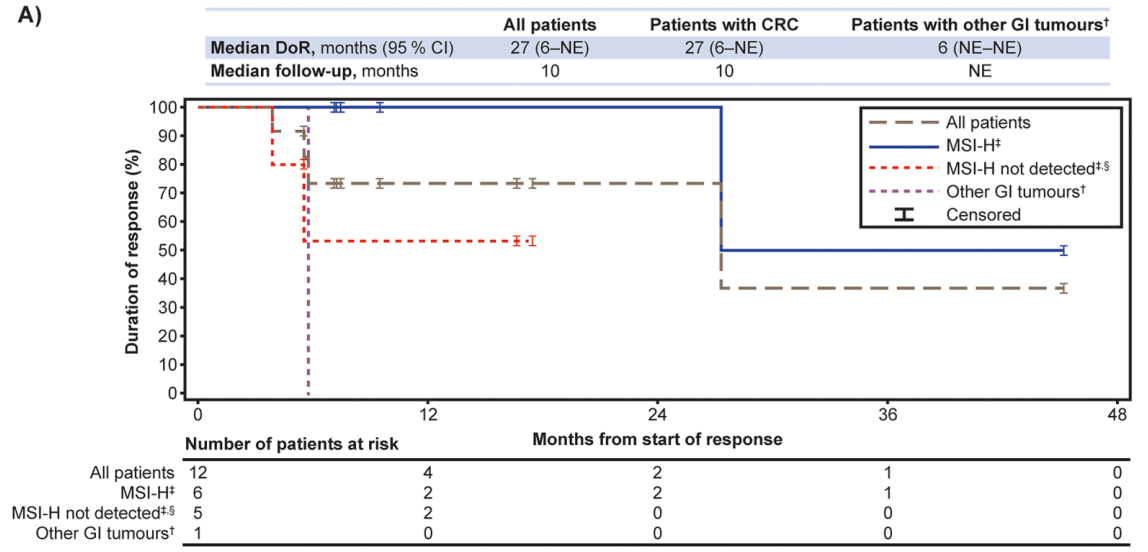
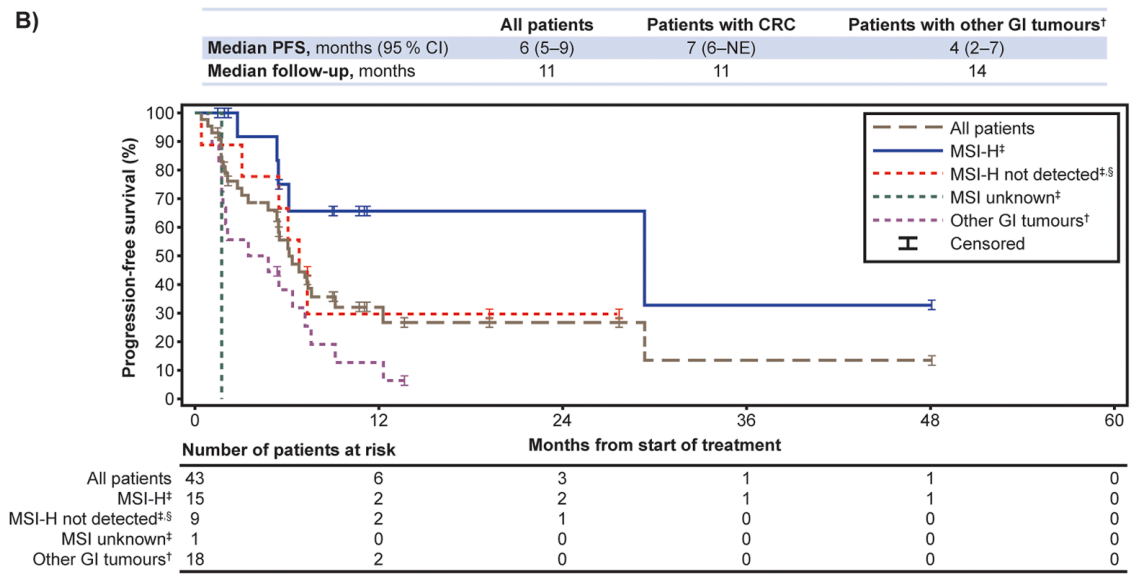
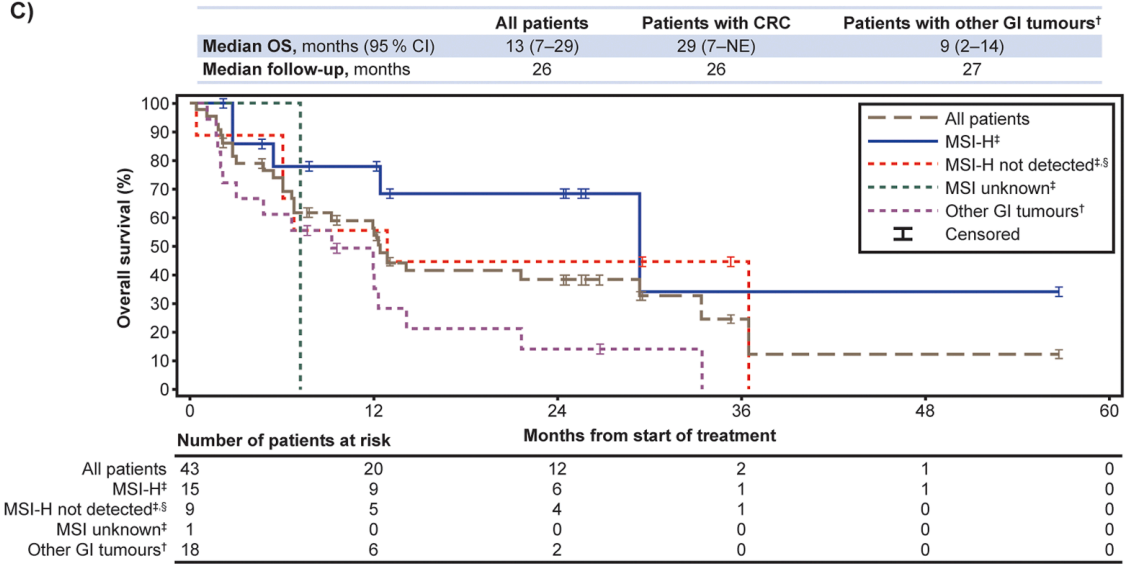
在安全性方面,16%的患者发生3/4级TRAE,主要包括ALT升高、AST升高、贫血、恶心等。无患者因TRAE停止治疗。
综上所述,研究数据进一步证实了拉罗替尼起效迅速、疗效深入且持久、耐受性良好的特点,为临床应用提供了更多参考。
国内外指南一致推荐:拉罗替尼为NTRK基因融合消化道肿瘤的重要方案
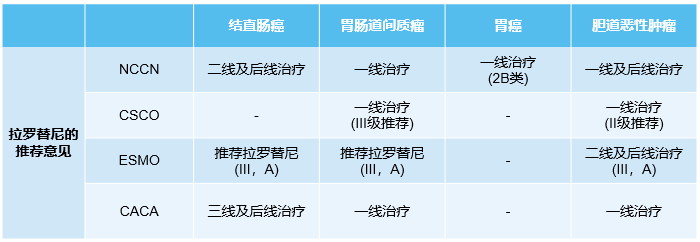
拉罗替尼在NTRK基因融合胃肠道肿瘤,尤其是CRC患者中表现出持久的缓解和可耐受的安全性,其ORR高达44%,缓解持续时间超过两年。基于其卓越的临床数据,拉罗替尼已被国内外多个权威指南推荐用于治疗消化道肿瘤患者。
表5 国内外指南对拉罗替尼治疗NTRK基因融合消化道肿瘤的推荐
精准检测先行:NGS检测助力锁定“钻石突变”
由于NTRK基因融合存在于多种肿瘤类型中,对患者进行NTRK基因融合检测具有重要的临床意义。然而,目前我国患者进行NTRK基因融合检测的比例仅为1.3%,低于日本(3.4%)、法国(3.7%)和德国(5.6%)等国家12。基于此,迫切需要大力推动NTRK基因融合检测,规范检测流程,实施精准化治疗方案。
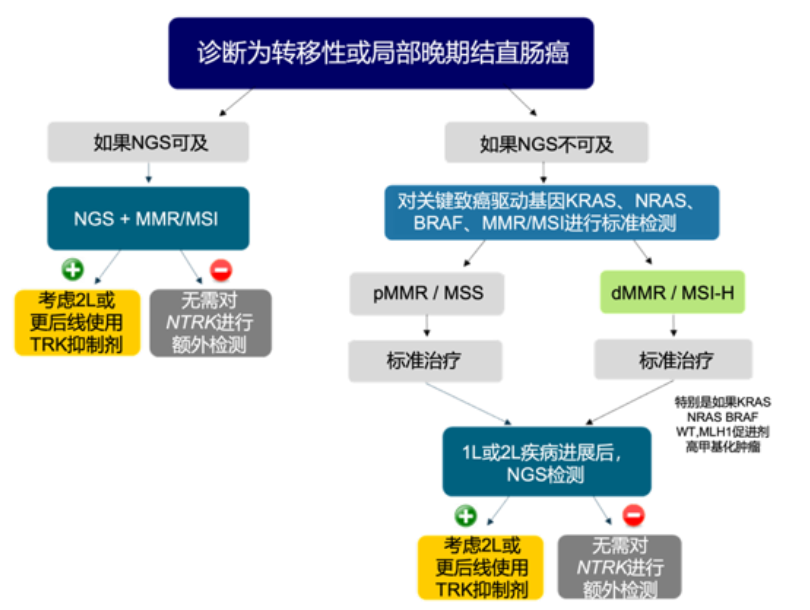
2021年新加坡工作组共识对CRC NTRK基因融合检测算法提出规范化推荐(图5)13。在CRC初始诊断中,若NGS可及,推荐使用NGS进行NTRK基因融合检测,同时评估MMR/MSI状态。如果NGS不可及,推荐进行KRAS、NRAS、BRAF基因检测和MMR/MSI状态评估,在一线或二线标准治疗进展后,推荐使用NGS进行NTRK基因融合检测。在确认NTRK基因融合后,推荐在二线或后续治疗方案中使用TRK抑制剂。此外,国际专家共识建议:对于晚期(不可切除和转移性)实体瘤患者,若未发现其他驱动基因突变/融合/扩增,或可能存在NTRK基因融合,建议进行NTRK基因融合检测,其中首选推荐NGS检测14。总而言之,全面及时的检测,不仅是精准医疗的重要组成部分,还为NTRK基因融合肿瘤患者拨开绝望迷雾,迎来崭新的治疗曙光。
专家点评
I期临床试验病房主任历任北京大学肿瘤医院副院长
北京市肿瘤防治研究所副所长
北京学者中国抗癌协会肿瘤精准治疗专业委员会主任委员
中国抗癌协会肿瘤药物临床研究专业委员会首届主任委员
中国临床肿瘤学会临床研究专家委员会主任委员
中国临床肿瘤学会胃癌专家委员会候任主任委员
中国抗癌协会大肠癌专业委员会副主任委员
北京癌症防治学会理事会轮值理事长
北京大学肿瘤医院一期临床病区 副主任医师
主要从事实体瘤细胞免疫治疗消化系统肿瘤的规范化诊疗和个体化治疗
北京市医管局“青苗”人才
北京大学优秀青年医师 临床科学家
中国临床肿瘤学会(CSCO)胃肠间质瘤专委会委员、秘书
中国临床肿瘤学会(CSCO)青年专委会委员
北京癌症防治学会胃癌防治专委会秘书长
中国老年医学学会肿瘤学分会委员
中国医促会胃肠外科学分会委员
《肿瘤综合治疗电子杂志》编委
《Health Care Science》青年编委
齐常松教授:作为本研究的研究者之一,我们观察到拉罗替尼作为全球首款获批的泛癌种NTRK基因融合靶向药物,在NAVIGATE试验中展现出令人鼓舞的临床疗效。本次在European Journal of Cancer上发表的全文数据进一步证实了拉罗替尼在NTRK基因融合胃肠道肿瘤中的显著治疗价值。研究结果尤为引人注目的是,在CRC患者中,拉罗替尼实现了44%的客观缓解率,中位总生存期超过两年,这在既往难治性晚期结直肠癌治疗中实属罕见。特别值得关注的是,在MSI-H型CRC亚组中,24个月DoR率达到100%,中位PFS和中位OS均达29个月,这一数据表明拉罗替尼可能为这部分特定患者群体带来长期生存获益。
从机制角度分析,拉罗替尼通过特异性抑制TRK融合蛋白的活性,有效阻断了下游信号通路的异常激活,从而抑制肿瘤细胞增殖和生存。与传统化疗相比,这种靶向治疗方式不仅疗效更为显著,而且安全性更佳,本研究中无患者因治疗相关不良反应而停药,这对于维持患者长期治疗依从性和生活质量具有重要意义。此外,拉罗替尼起效迅速,中位至缓解时间仅为1.8个月,这对于晚期患者症状的快速缓解尤为重要。
从临床实践角度看,拉罗替尼已获得CSCO、CACA、ESMO、NCCN等国内外权威指南的一致推荐,这不仅反映了学术界对其临床价值的高度认可,也为临床医生提供了明确的治疗指导。作为肿瘤学专家,我们认为精准医疗时代的关键在于"先检测、后治疗"。NTRK基因融合检测应成为消化道肿瘤患者,尤其是MSI-H型CRC患者的常规检测项目。尽管NTRK基因融合发生率不高,但对于那些携带此类基因改变的患者而言,拉罗替尼可能是改变疾病自然进程的关键治疗手段。
值得特别关注的是,拉罗替尼已于2025年初正式纳入国家医保目录,这一政策突破极大地减轻了患者的经济负担。在医保前,拉罗替尼的治疗费用对许多家庭而言是一笔沉重的经济负担,往往成为患者获得这一有效治疗的主要障碍。医保覆盖后,患者自付比例显著降低,这不仅提高了药物的可及性,也使更多NTRK基因融合阳性的患者能够及时接受规范化治疗。从公共卫生角度看,这一政策变化体现了国家对精准医疗的支持和对罕见基因改变患者群体的关怀,也将促进NTRK基因融合检测在临床实践中的推广应用。
我们的研究不仅为临床实践提供了有力证据,也为未来的研究方向指明了道路。基于当前研究结果,我们正在设计和开展拉罗替尼联合免疫治疗、抗血管生成药物等新型联合治疗策略的临床试验,以期进一步提高疗效。同时,我们也在探索拉罗替尼在术后辅助治疗中的应用潜力,通过早期干预可能进一步改善患者长期预后。此外,对拉罗替尼耐药机制的深入研究和耐药后治疗策略的开发也是我们关注的重点方向。
我们深知精准医疗的核心在于将合适的药物用于合适的患者。本研究结果不仅验证了拉罗替尼在NTRK基因融合消化道肿瘤中的临床价值,也为我们提供了优化患者筛选和个体化治疗方案的科学依据。我们期待通过持续的临床研究和实践,为更多消化道肿瘤患者带来长期生存的希望,共同推动精准医疗在肿瘤治疗领域的深入发展。
1. 中国抗癌协会肿瘤精准治疗专业委员会.肿瘤综合治疗电子杂志. 2024, Vol. 10 Issue (1): 69-92.
2. Zhou Y, et al. Chin Med J (Engl). 2024 Aug 20;137(16):1957-1964.
3. Gatalica Z, et al. Mod Pathol. 2019 Jan;32(1):147-153.
4. Qi C, et al. Eur J Cancer. 2025 Mar 4;220:115338.
5. Hui Wang, et al. Cancer Med. 2022 Jul;11(13):2541-2549.
6. Schraa SJ et al. Virchows Arch . 2023 Jun;482(6):983-992.
7. Chou A, et al. Mod Pathol. 2020 May;33(5):924-932.
8. Cocco E, et al. Cancer Res. 2019 Mar 15;79(6):1047-1053.
9. Deihimi S, et al. Oncotarget. 2017 Jun 20;8(25):39945-39962.
10. Pietrantonio F, et al. Natl Cancer Inst. 2017 Dec 1;109(12).
11. Marchiò C, et al. Ann Oncol. 2019 Sep 1;30(9):1417-1427.
12. Kriti Jindal, et al. 2021 ESMO. abstract 102P.
13. Lim KHT, et al. Asia Pac J Clin Oncol. 2022 Aug;18(4):394-403.
14. Maristella Bungaro, et al. Precis Cancer Med. Vol 6 (September 30, 2024).
审核码:MA-LAR-CN-0289-1
排版编辑:肿瘤资讯-jyy











 苏公网安备32059002004080号
苏公网安备32059002004080号


