骨转移是肺癌最常见的转移之一[1]。骨转移不仅影响患者的生活质量,导致病理性骨折、脊髓和神经压迫等不良事件外,还会严重缩短患者的生存期。为此,【肿瘤资讯】特邀复旦大学附属华山医院周鑫莉教授,结合《中国肺癌骨转移临床诊疗指南(2024版)》指南及骨保护药物地舒单抗临床研究数据,解读骨转移患者管理策略,分享诊疗经验,展望未来发展趋势。
复旦大学附属华山医院肿瘤科
上海市抗癌协会脑转移瘤专业委员会副主任委员
上海市抗癌协会多原发和不明原发肿瘤专业委员会副主任委员
中国宋庆龄基金会肿瘤区域医疗与产学研联盟疑难肿瘤专业委员会常委
中国医药教育协会肿瘤转移专委会常委
上海市医学会肿瘤分会委员
上海市抗癌协会胃肠肿瘤专业委员会委员
上海市女医师协会肺癌专业委员会常委
肺癌骨转移诊疗革新:精准诊断路径与多学科治疗策略的全景升级
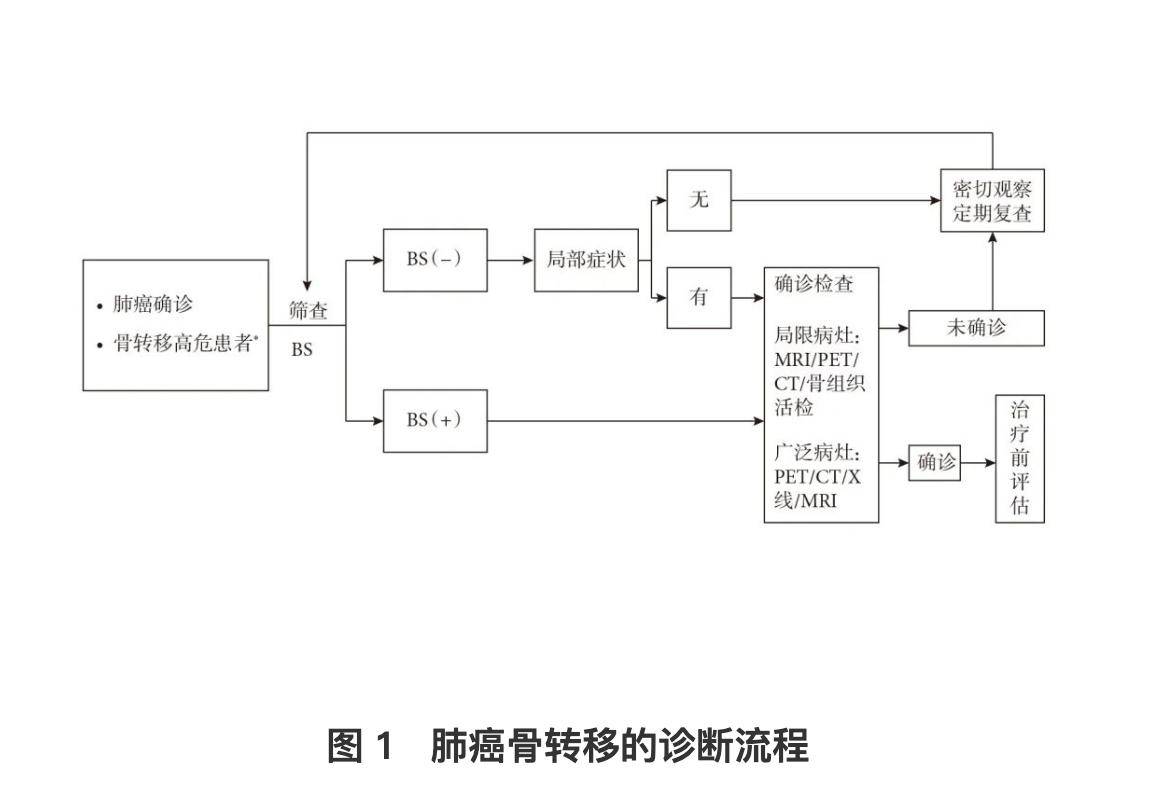
2024版指南的流程图解与关键技术(图1)[1]
在肺癌诊疗中,骨转移的检测对于准确分期和指导治疗具有关键意义。当前,医学界普遍认可的骨转移诊断标准为:临床确诊肺癌后,通过骨活检发现阳性结果,或存在明确的骨转移影像学证据。影像学检查在这一过程中发挥着重要作用,它不仅能确定骨转移的具体部位,还能评估受累部位是否存在病理性骨折或脊髓压迫,以及判断其发生风险;在需要时,还可用于引导活检操作,提高诊断的准确性和安全性。
在筛查阶段,对于具有高危因素的患者,放射性核素骨显像(BS)是首选的检查方法。这些高危因素包括高钙血症、高碱性磷酸酶以及脊髓压迫症状等。对于初筛结果呈阳性的患者,需要进一步进行影像学诊断或骨活检,以全面评估转移灶的特征和程度。然而,对于已经确诊肺癌且伴有全身多发骨破坏的患者,则无需再进行骨活检,此时的诊断重点应转向对病情的整体评估和治疗方案的制定。
值得一提的是,在众多影像学检测手段中,MRI是唯一能够直接显示骨髓腔及其组成结构的成像技术,也是检测骨髓病变的最敏感方法。这使得 MRI 在肺癌骨转移的诊断中具有不可替代的重要地位,能够为临床医生提供更为详尽和准确的病变信息,从而助力精准医疗决策的制定。
骨保护药物的精准应用
对确诊肺癌骨转移的患者,建议采用多学科团队(MDT)协作的方式,为患者量身定制综合治疗方案。肺癌骨转移的治疗涉及多个领域,包括肿瘤学、影像学、病理科、外科等,MDT可以整合各专业优势,全面评估患者病情,综合考虑患者的身体状况、肿瘤类型和分期、骨转移灶的特点等因素,制定出最适合患者的治疗策略,从而提高治疗效果和患者的生活质量。
治疗药物的使用上,骨保护药物能够有效改善骨质、减少骨相关事件(如病理性骨折、脊髓压迫等)的发生,提高患者的生活质量和生存期。具体来说,若患者无禁忌证,推荐使用双膦酸盐或核因子κ B受体活化因子配体(RANKL)抑制剂来降低肺癌骨转移患者发生骨相关事件(SREs)的风险。双膦酸盐能够抑制破骨细胞活性,减少骨吸收,从而降低病理性骨折等SREs的发生概率;RANKL抑制剂则通过靶向抑制破骨细胞的分化、活化,打破癌症骨转移的恶性循环过程,达到保护骨骼的作用。这两种药物在临床实践中均显示出显著的疗效和良好的安全性,其应用价值得到了广泛认可和充分验证,是目前降低肺癌骨转移患者SREs风险的常用治疗方案。
然而,骨保护药物可能影响颌骨的正常代谢和修复能力,口腔问题如牙周疾病、牙科手术等可能会增加颌骨坏死(ONJ)的发生几率。因此,在接受骨保护药物治疗前后,均应常规对患者进行口腔检查,保证及时发现并处理潜在的口腔问题,预防ONJ的发生,保障患者在骨保护药物治疗过程中的安全性和耐受性。
靶向RANKL的精准干预:地舒单抗在肺癌骨转移治疗中的临床实践
RANKL在人体内具有多种功能,临床前研究表明RANKL通过多种途径参与肿瘤的发生和转移,不仅通过破骨细胞依赖性途径,还通过非破骨细胞依赖性途径[2]。地舒单抗是一种具有独特作用机制的骨吸收抑制剂,它能够特异性地靶向RANKL,有效抑制破骨细胞的活化与发展,从而减少骨吸收,提升骨密度[3]。
在2024年的世界肺癌大会(WCLC)上,一项来自中国的单中心回顾性研究深入探讨了PD-1单抗联合地舒单抗作为一线治疗方案在骨转移非小细胞肺癌(NSCLC)患者中的疗效与安全性[4]。研究结果显示(图2),患者群体的中位总生存期(OS)达到了21.5个月(95%CI:17.0,NR),中位无进展生存期(PFS)为7.7个月(95%CI:6.2-12.8)。具体到不同时间点的生存率显示:6个月时的总生存率为96.9%(95%CI:92.7%-100.0%),12个月时为79.7%(95%CI:70.4%-90.2%)。进一步分析发现,接受≥6 剂地舒单抗治疗的患者中位OS达到23.3个月,显著长于接受<6剂地舒单抗治疗患者的15.3个月(p=0.023)。此外,该治疗方案的客观缓解率(ORR)为36.4% (95%CI:24.9%-49.1%),其中24 (36.4%) 例患者达到部分缓解(PR)。
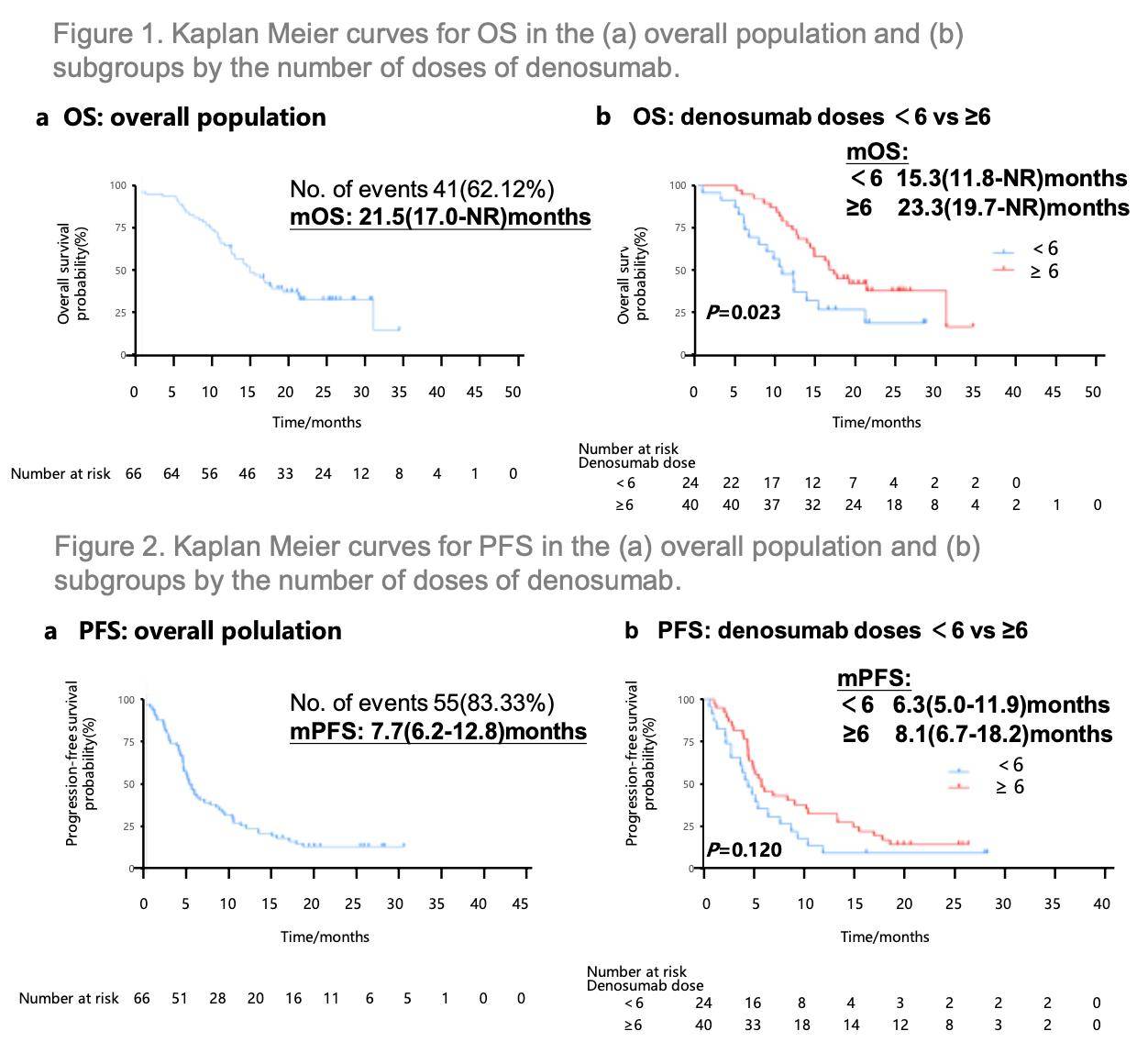
在安全性层面,共62例患者纳入安全性分析,29例(46.8%)患者出现了不良事件, 12例(19.4%)出现了≥3级不良事件。最常见的不良事件包括白细胞减少(22.6%)、发热(12.9%)、贫血(11.3%)和疲劳(6.5%)。值得注意的是,研究期间未出现颌骨坏死病例,表明该治疗方案总体安全性良好。
此前开展的Study244研究[5]纳入了1597例晚期实体瘤骨转移及多发性骨髓瘤患者,其中涵盖811例肺癌骨转移患者。研究结果显示,与唑来膦酸相比,地舒单抗显著延长实体瘤亚组患者首次出现骨相关事件(SREs)的时间达6个月(21.4个月vs.15.4个月,HR=0.81,p=0.017)。同时,在肺癌亚组中,地舒单抗相较于唑来膦酸显著延长患者生存期1.2个月(8.9个月 vs. 7.7个月,HR=0.80,p=0.01),患者死亡风险降低20%[6]。
总之,地舒单抗在肺癌骨转移治疗领域已经展现出明确的临床价值。其独特的作用机制为患者带来了显著的生存获益,并在预防骨相关事件方面发挥了重要作用,是当前肺癌骨转移治疗中不可或缺的重要选择,未来仍需不断探索以优化其应用策略。
肺癌骨转移诊疗新范式:多学科协作与精准医疗的融合创新
展望未来,肺癌骨转移诊疗领域正不断开辟新的道路,以下这些关键探索方向,值得我们更进一步深入挖掘、拓展创新:
多学科协作诊疗模式的深化与拓展:未来,MDT将发挥更大作用,肿瘤科、影像科、病理科、骨科、放疗科等多学科专家将深度参与患者的全程管理。这种协作不仅体现在诊断和治疗方案的制定上,还将延续到患者的随访和康复阶段,确保患者得到全面、精准且连续的医疗服务。
精准医疗与个性化治疗方案的制定:随着对肺癌分子机制的深入研究,我们对肿瘤的发生、发展和转移有了更深刻的认识。未来,我们有望实现更加精准的个性化治疗,根据患者的个体特征和肿瘤的分子分型,量身定制治疗方案。
新型骨保护药物及联合治疗方案的探索:目前,骨保护药物如地舒单抗在预防和治疗肺癌骨转移相关事件方面已显示出良好的效果。未来,我们将致力于开发更多高效、低毒的骨保护药物,以满足临床需求。同时,联合治疗将成为研究的热点。我们可继续探索骨保护药物与靶向治疗、免疫治疗等其他治疗方法的协同作用,以进一步提高患者的生存率和生活质量。
早期诊断标志物与检测技术的开发:早期诊断是提高肺癌骨转移患者生存率的关键。目前,研究人员正在积极寻找特异性和敏感性更高的早期诊断标志物,以实现疾病的早期发现和干预。同时,新的检测技术如液体活检、影像组学等也在不断发展中,有望为肺癌骨转移的早期发现提供更有力的工具。
康复治疗与生活质量提升的关注:除了传统的治疗手段,应更加注重肺癌骨转移患者的康复治疗和生活质量提升。包括物理治疗、心理支持、营养干预等在内的综合康复措施,将帮助患者更好地应对疾病带来的身体和心理挑战,提高其生活质量和生存信心。
[1] 支修益,王洁,刘伦旭, 等. 中国肺癌骨转移临床诊疗指南(2024版). 中国胸心血管外科临床杂志, 2024, 31(5): 643-653.
[2] Okamoto K. Role of RANKL in cancer development and metastasis. J Bone Miner Metab, 2021, 39(1): 71-81.
[3] 支修益,王洁,赵军.肺癌骨转移诊疗专家共识(2019版)[J].中国肺癌杂志, 2019(4):187-207.
[4] J. Zhou, J. Qu, N. Liu, et al. Anti-PD-1 Therapy Plus Denosumab in Advanced Non-Small Cell Lung Cancer with Bone Metastases: A Single-Centre, Retrospective Study in China. 2024 WCLC, EP.11A.03.
[5] Henry D, Vadhan-Raj S, Hirsh V, et al. Delaying skeletal-related events in a randomized phase 3 study of denosumab versus zoledronic acid in patients with advanced cancer: an analysis of data from patients with solid tumors. Support Care Cancer. 2014 Mar;22(3):679-87.
[6] Scagliotti GV, Hirsh V, Siena S, et al. Overall survival improvement in patients with lung cancer and bone metastases treated with denosumab versus zoledronic acid: subgroup analysis from a randomized phase 3 study. J Thorac Oncol. 2012 Dec;7(12):1823-1829.
排版编辑:肿瘤资讯-LBJ











 苏公网安备32059002004080号
苏公网安备32059002004080号


