非小细胞肺癌(NSCLC)是一种侵袭性疾病,预后差,脑转移(BM)的可能性高。10%-15%的NSCLC患者在初诊时即存在BM,并且40%-50%的NSCLC患者在疾病进展过程中会发展为BM,并且肺腺癌BM发生率远高于其他组织类型,尤其是驱动基因阳性的肺腺癌患者[1, 2]。患有BM的NSCLC患者的中位总生存期(OS)非常有限,仅为3至15个月[3]。然而,由于许多传统治疗药物难以有效穿透血脑屏障,加之手术并非适用于所有BM患者,导致这类患者的治疗选择极为有限。
MET外显子14(METex14)跳跃突变虽在NSCLC中发生率仅为1-6%[4],但近年来针对这一靶点有众多突破性进展。多款MET抑制剂不仅在METex 14跳跃突变NSCLC的一线和后线治疗中取得令人惊喜的成绩,并在国内外获批上市,其更在METex 14跳突NSCLC伴BM患者的治疗中展现出巨大的潜力。基于此,【肿瘤资讯】特邀上海市东方医院周斐教授对话AI新兴力量DeepSeek,深度梳理METex14跳突NSCLC伴BM的现有治疗格局和最新治疗进展。
DeepSeek“生成”治疗格局蓝图,靶向治疗占据核心地位




新思路,MET信号通路与BM的发生和迁移密切相关
METex14跳突NSCLC患者中,BM的发生率较高,约为20%-40%[5,6],并且预后较差,传统化疗和免疫治疗对这类患者的疗效有限。造成这一现象的原因之一是血脑屏障(BBB)的存在,尤其是BBB中的转运蛋白P-糖蛋白通过介导药物外排,限制了大多数药物进入颅内发挥疗效,导致颅内病灶难以得到有效控制。对于METex14跳突的NSCLC患者,BM显著加剧了疾病的复杂性,也引起了临床医生的高度重视。为了克服这一治疗障碍,临床研究正积极探索新的策略。
已有研究显示[7],在包括脑肿瘤在内的多种恶性肿瘤中,MET信号通路能促进肿瘤生长和血管生成,并且在恶性肿瘤BM发生发展中,MET信号通路也在调控肿瘤侵袭,转移,尤其在放疗抵抗中发挥重要作用。基于此,开发靶向MET信号通路的抑制剂在BM的治疗中具有重要的意义。目前,多项研究证据表明,MET酪氨酸激酶抑制剂(MET-TKI)在靶向治疗中表现出显著的疗效,这一趋势在BM患者群体中同样得到了验证。
明确CNS疗效评估“金标准”,助力BM患者锁定疗效更佳药物
由于BM的出现、进展及其治疗效果都具有独特性,建立并运用具有特异性的BM疗效评估体系,能够极大地提升BM治疗药物筛选效率,快速锁定疗效更佳的治疗药物。
在临床试验中,基线BM患者的样本量以及具有颅内可测量靶病灶的BM患者数量是评估药物对BM疗效的关键指标。然而,基线BM患者及具有颅内可测量靶病灶的BM患者在总体研究人群中的比例通常较低,导致可用于评估药物对BM疗效的数据有限,从而难以得出具有高循证医学等级的结论。因此,充足的基线BM患者样本量及具有颅内可测量靶病灶是评估临床试验中BM疗效的基础。
针对颅内靶病灶的评估标准,RECIST(Response Evaluation Criteria in Solid Tumours)是评估抗肿瘤治疗效果的主要方法之一,为临床医生提供了一种量化和标准化评估治疗效果的方法。但是考虑到颅内靶病灶的特异性,仍需将神经肿瘤学脑转移瘤反应评估标准(RANO-BM)综合纳入评估标准。RANO-BM标准经过近10年的临床实践,得到了神经肿瘤学界的认可,也成为临床试验中BM疗效评估的常用评价标准[8]。RANO-BM标准明确将可测量靶病灶定义为在放射学影像中至少一个维度上可通过对比增强准确测量的病变,其最小尺寸需≥10 mm,并且在两个或多个轴向切片上可见,切片间隔优选≤5 mm[8]。此外,基线时可测量病灶的最小尺寸应至少为切片厚度的两倍。此外,如果存在既往未接受过局部治疗的颅内病灶,则应首选这些病灶作为靶病灶。
RANO-BM标准也强调,在临床试验中进行实体瘤BM的疗效评估时,直接评价中枢神经系统(CNS)特异性终点是一种更为精准的方法。对于基线存在CNS转移的患者,仅评估客观缓解率(ORR)可能无法全面证明药物对CNS的疗效,因为ORR评估的是患者身体任何部位的病灶缓解情况,包括全身的疗效。基于此,这种方法可能无法准确反映CNS区域的治疗效果,从而导致对CNS疗效的低估或误判。相比之下,仅评估CNS特异性终点(如颅内ORR(iORR、颅内完全缓解(iCR)和颅内肿瘤缓解持续时间(iDoR)等)能够更准确地证明药物对CNS的疗效。因此,在评估CNS肿瘤治疗效果时,采用CNS特异性终点能够提供更为精准和可靠的数据,有助于更全面地了解药物在CNS区域的疗效,为临床决策提供有力支持。
MET-TKI精准狙击METex14跳突的NSCLC伴BM治疗
卡马替尼是一种口服、ATP竞争性、高亲和力和高选择性的MET抑制剂。体外实验显示,卡马替尼IC50值在同类药物中处于非常低的水平,仅为0.6nM,表明其对METex14跳突的强效抑制作用[7, 9]。此外,卡马替尼还具备优异的血脑屏障穿透能力,Kpuu,CSF值介于0.34至0.89之间,并作为P-糖蛋白抑制剂,可有效阻止药物被外排,从而在颅内维持较高的有效药物浓度[10, 11]。卡马替尼在两项关键临床研究中也展现了抑制BM进展的治疗潜力。GEOMETRY mono-1研究结果显示[12],在160例METex14跳突NSCLC患者中,有28例可评估患者(包括13例既往接受过颅内放疗和15例未接受过颅内放疗),其中有16例(57%)观察到iCR或颅内部分缓解(iPR),iCR为32%。在既往未接受过脑部放疗的患者中,10例 (67%)观察到iCR或颅内部分缓解,iCR为33%,这表明无论BM患者是否接受过局部放疗,卡马替尼均有优异的颅内病灶缓解率。值得注意的是,达到iCR的患者中有5例的颅内完全缓解持续时间超过6个月,这显示了卡马替尼颅内疗效的持久性。针对中国人群的GeoMETry-C研究结果显示[13],一线初治队列中BM患者经BIRC及RANO-BM标准评估的iCR率高达50%,颅内疾病控制(iDCR)率更高达100%。
除了卡马替尼,多款MET-TKI也在抑制BM领域进行了积极的探索。VISION是一项国际多中心、开放标签、非随机、多队列、IIb期临床研究,在这项研究中[14],基线已知存在METex14跳突NSCLC伴BM的57例患者中有15例可通过RANO-BM评估的BM患者(其中12例患者既往接受过脑部放疗),特泊替尼的iORR率为66.7%,iCR率为20%。5例基线无BM的患者在治疗期间出现了新发BM。在一项探究赛沃替尼在携带METex14跳突的肺肉瘤样癌和其他NSCLC中国患者中的多中心、单臂、开放标签、II期研究中[15],有15例基线METex14跳突NSCLC伴BM的患者,经赛沃替尼治疗后显示脑病灶稳定或减少,其中有3例患者具有可评估的颅内靶病灶,这3例患者都达到了iPR。GLORY 研究是一项探索谷美替尼单药用于伴有 METex14跳跃突变的局部晚期或转移性NSCLC患者的单臂、国际多中心 II 期关键研究。在GLORY研究中[16],基线已知存在METex14跳突NSCLC伴BM的14例患者中有5例具有可评估的BM靶病灶,经谷美替尼治疗后这5例患者都达到了iPR。KUNPENG试验是一项开展中的多中心、多队列、开放标签的单臂II期临床注究,旨在评估伯瑞替尼在携带MET ex14跳变的晚期NSCLC患者中的疗效和安全性。研究结果显示[17],基线已知存在BM的患者有5例,但是目前未公布其颅内缓解的具体数值。
临床试验之后,真实世界研究能否再次验证抑制BM疗效?
真实世界研究同样验证了卡马替尼的颅内疗效。RECAP研究是一项国际多中心的回顾性研究,旨在分析卡马替尼治疗METex14跳突晚期NSCLC患者的疗效和安全性[18]。为评估颅内缓解情况,本研究严格筛选了未经治疗或出现进展性脑部病变的患者,并在基线时限定纳入可测量脑病灶直径≥5毫米的病例。这项研究中22例患者(27%)有确诊的脑部病变,其中55%无症状。在可测量BM的11例患者中,iORR达46%,iDCR高达91%。虽然此项研究的患者基线条件更差,BM的比例更高,但卡马替尼仍表现出强势的颅内缓解效果。
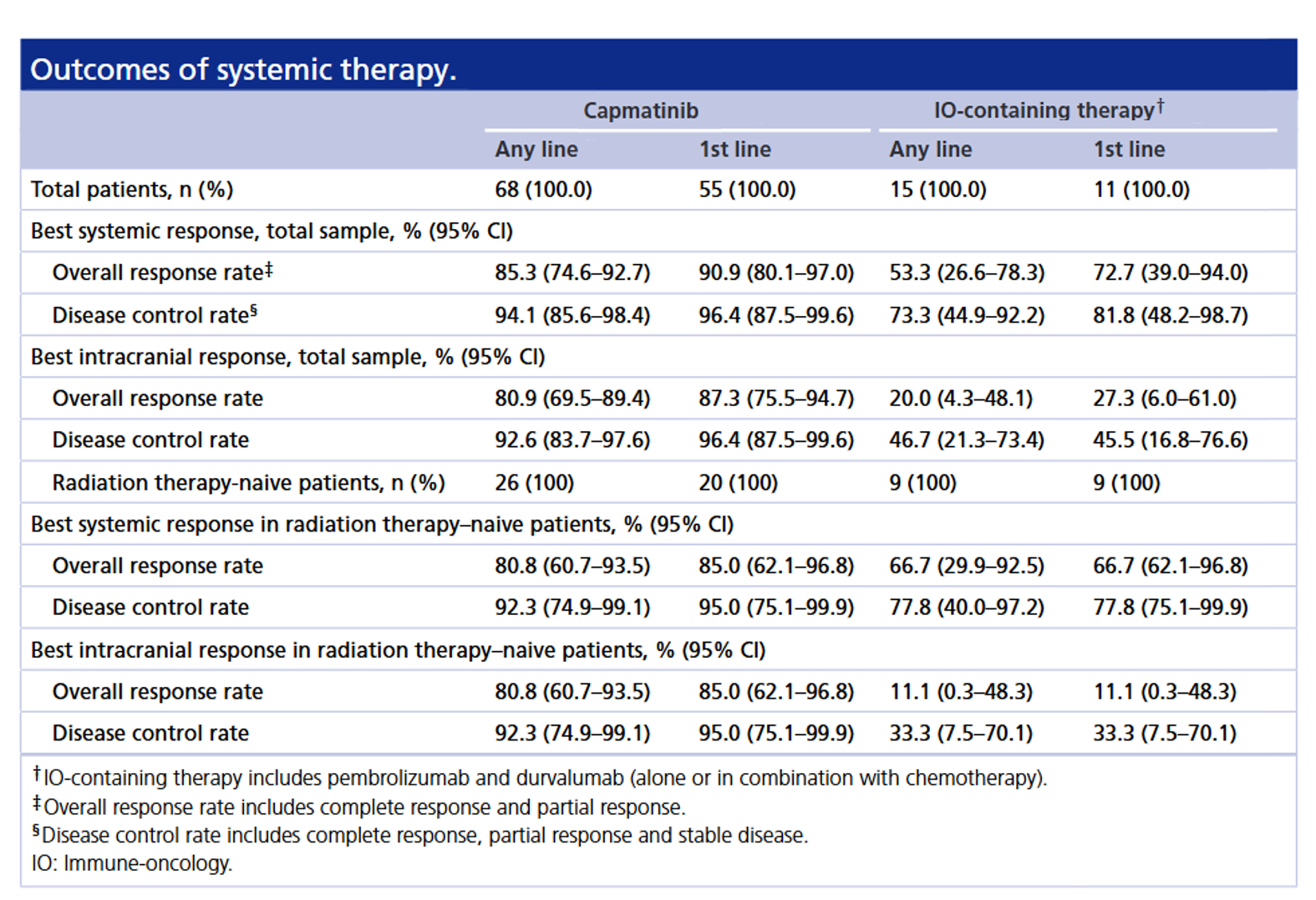
一项美国确诊为携带METex14跳突晚期NSCLC并伴有BM的患者中进行的非干预性队列研究[19],共纳入68例符合条件的患者。在首次确诊BM时,大多数患者有症状表现(n = 39,57.4%),中位可测量颅内病灶数为2。其中卡马替尼一线治疗(n = 55)的系统PFS为14.1个月,iORR为87.3%, iDCR为96.4%,颅内PFS尚未达到(NE)。在一线接受含IO方案治疗的患者(n=11)系统PFS为5.1个月,iORR 为27.3%,iDCR为45.5%,颅内PFS为7.5个月。在未经放射治疗的患者中(n=20),一线接受卡马替尼治疗的系统PFS为14.1个月,iORR为85%,iDCR为95%,颅内PFS为14.1个月,而IO治疗(n=9)的系统PFS为7.5个月,iORR 为11.1%,iDCR为33.3%,颅内PFS为11个月。此外,还观察到与出现症状BM的患者(78.8%)相比,无症状BM的患者接受卡马替尼具有更好的iORR(100%)。提示卡马替尼在真实世界中具有显著的全身和颅内疗效,对未经颅脑放射治疗的患者同样获益显著,也再次证实了卡马替尼在GEOMETRY mono-1研究中报告的卡马替尼的颅内疗效。
总结
最后,周斐教授对METex 14跳突NSCLC伴BM患者现有的治疗格局和未来方向进行了总结。他指出,尽管目前针对这类患者的治疗选择仍然有限,但随着精准医学的快速发展,以卡马替尼为代表的小分子MET抑制剂展现出显著的临床潜力。DeepSeek作为当前人工智能领域的先进代表,通过与DeepSeek的深度对话分析,进一步验证了这一观点。基于大模型的普遍认知,METex14跳突NSCLC伴BM的治疗策略正在逐步从传统化疗和免疫治疗向靶向治疗转变,而卡马替尼等MET抑制剂因其高效性和特异性,已成为这一领域的重要突破点。2024年10月,卡马替尼的关键全球研究GEOMETRY mono-1的最新数据公布于The Lancet Oncology,这一重磅研究不仅揭示了卡马替尼无论在一线还是后线治疗中均显示出了显著的抗肿瘤活性,更为BM患者的治疗提供了有力的循证医学证据。此项研究中可评估颅内靶病灶的BM患者达到了28例,iCR率高达32%,并且超过半数达到iCR的患者的颅内病灶CR持续时间超过了6个月。这一数据的公布对于临床实践具有重要的参考价值,不仅因为这项研究中BM患者的样本量和可评估颅内靶病灶的患者数均超过其他同类研究,是目前具有可评估颅内病灶的BM人群最大样本量的临床研究,其高iCR率更是展现出卡马替尼优异的颅内疗效。此外,相较于其他同类研究中多用BM患者的全身ORR率来衡量其疗效,卡马替尼基于iORR和iCR的颅内特异性指标,再次证明了其在CNS治疗中的卓越疗效。
值得一提的是,卡马替尼的真实世界研究同样验证了卡马替尼的颅内疗效。临床试验和真实世界研究的双重验证,不仅证实了卡马替尼在METex14突变NSCLC伴BM患者中表现出显著且持久的颅内缓解,也为其在真实世界中的应用提供了有力支持。展望未来,卡马替尼有望成为METex14突变NSCLC伴BM患者治疗的有力武器,精准狙击“脑转移”沉疴,为这一难治性患者群体带来更长的生存期和更好的生活质量。
上海市东方医院 肿瘤科 副主任医师
IASLC全球多学科实践标准委员会 委员
中国抗癌协会青年理事会 青年理事
中国抗癌协会非小细胞肺癌专委会 委员
上海市抗癌协会青年理事会 青年理事
上海市申康青年岗位能手
上海市青年科技英才“扬帆”计划
上海市“医苑新星”青年医学人才
浦东新区卫生英才青年人才
《中国癌症杂志》《Cancer Drug Resistance》《Cancer Advances》青年编委
以一作或通讯作者在Nat Rev Clin Oncol, Lancet Oncol, Signal Transduction Targeted Ther, J Thorac Onocl等期刊发表SCI论文20余篇
担任Ann Oncol, Cell Host & Microb, JNCC等期刊审稿人
参考文献:
[1] Mina Karimpour et al. Biomedicine&Pharmacotherapy Volume 143, Novermber 2021, 112190.
[2] Fenske Dc, et al. Clin Lung cancer. 2017:18:607-14.
[3] Khalifa J, Amini A, Popat S, Gaspar LE, Faivre-Finn C. International Association for the Study of Lung Cancer Advanced Radiation Technology C. Brain metastases from NSCLC: radiation therapy in the era of targeted therapies. J. Thorac. Oncol. 11(10), 1627–1643 (2016).
[4] Wolf J, Seto T, Han JY et al. Capmatinib in MET exon 14-mutated or MET-amplified non-small-cell lung cancer. N. Engl. J. Med. 383(10), 944–957 (2020).
[5] Lu S, et al.Lancet Respir Med. 2021 Oct;9(10):1154-1164.
[6] Vuong HG, et al. Lung Cancer. 2018 Sep;123:76-82.
[7] Int J Mol Sci. 2020 Oct 13;21(20):7546.
[8] Lin NU, Lee EQ, Aoyama H, et al; Response Assessment in Neuro-Oncology (RANO) group. Response assessment criteria for brain metastases: proposal from the RANO group. Lancet Oncol. 2015 Jun;16(6):e270-8.
[9] Awad MM, Leonardi GC, Kravets S, et al. Impact of MET inhibitors on survival among patients with non-small cell lung cancer harboring MET exon 14 mutations: a retrospective analysis. Lung Cancer. 2019;133:96-102.
[10] Grande E, et al. Br J Clin Pharmacol. 2021 Jul;87(7):2867-2878.
[11] Pan K, et al. Nat Rev Clin Oncol. 2023 Oct;20(10):716-732.
[12] Wolf, Jürgen et al. Capmatinib in MET exon 14-mutated non-small-cell lung cancer: final results from the open-label, phase 2 GEOMETRY mono-1 trial. The Lancet Oncology, Volume 25, Issue 10, 1357 - 1370.
[13] Yi-Long Wu, et al. Capmatinib in Chinese adults with EGFR wt, ALK rearrangement negative (ALK-R−), MET exon 14 skipping mutation (METex14), advanced NSCLC: Results from the phase II GEOMETRY-C study. 2022 ESMO AISA, 388P.
[14] Mazieres J, Paik PK, Garassino MC, et al. Tepotinib Treatment in Patients With MET Exon 14-Skipping Non-Small Cell Lung Cancer: Long-term Follow-up of the VISION Phase 2 Nonrandomized Clinical Trial. JAMA Oncol. 2023 Sep 1;9(9):1260-1266.Erratum in: JAMA Oncol. 2023 Sep 1;9(9):1300.
[15] Lu S, Fang J, Li X, et al. Once-daily savolitinib in Chinese patients with pulmonary sarcomatoid carcinomas and other non-small-cell lung cancers harbouring MET exon 14 skipping alterations: a multicentre, single-arm, open-label, phase 2 study. Lancet Respir Med. 2021 Oct;9(10):1154-1164.
[16] Yu Y, Zhou J, Li X, et al. Gumarontinib in patients with non-small-cell lung cancer harbouring MET exon 14 skipping mutations: a multicentre, single-arm, open-label, phase 1b/2 trial. EClinicalMedicine. 2023 Apr 6;59:101952.
[17] Yang JJ, Zhang Y, Wu L, et al. Vebreltinib for Advanced Non-Small Cell Lung Cancer Harboring c-Met Exon 14 Skipping Mutation: A Multicenter, Single-Arm, Phase II KUNPENG Study. J Clin Oncol. 2024 Nov;42(31):3680-3691.
[18] Illini O, et al. Real-world experience with capmatinib in MET exon 14-mutated non-small cell lung cancer (RECAP): a retrospective analysis from an early access program. Ther Adv Med Oncol. 2022 Jun 13;14:17588359221103206.
[19] Paik PK, Goyal RK, Cai B, Price MA, Davis KL, Ansquer VD, Caro N, Saliba TR. Real-world outcomes in non-small-cell lung cancer patients with MET Exon 14 skipping mutation and brain metastases treated with capmatinib. Future Oncol. 2023 Jan;19(3):217-228.
审批码TAB0042566-93146,有效期为2025-03-20至2026-03-19,资料过期,视同作废
排版编辑:肿瘤资讯-ZLG











 苏公网安备32059002004080号
苏公网安备32059002004080号


