
2024年6月,CROWN研究公布了5年生存随访结果,第三代ALK-TKI洛拉替尼一线治疗ALK阳性晚期非小细胞肺癌(NSCLC)患者,中位无进展生存期(mPFS)突破60个月,5年PFS率达到60%,刷新了转移性实体瘤单药靶向治疗新纪录。
2025年2月28日,由中国医药教育协会主办的TOP TALK肺越环球线上国际学术交流会成功召开。会议聚焦于ALK阳性NSCLC治疗的临床热点话题与小细胞肺癌(SCLC)基础研究最新进展,希望通过中外专家深度学术交流,共同促进NSCLC治疗模式优化,促进学科发展。本次会议特邀中国医学科学院肿瘤医院段建春教授与空军军医大学唐都医院闫小龙教授担任会议主席,哈佛医学院丹娜法伯癌症研究所Alice Shaw教授、上海市胸科医院艾星浩教授与浙江省肿瘤医院金莹教授进行学术分享,浙江大学医学院附属邵逸夫医院方勇教授、汕头大学医学院附属肿瘤医院林雯教授、厦门大学附属中山医院肖莉教授、中国医科大学附属盛京医院于莉教授、常州市肿瘤医院周彤教授、中山大学肿瘤防治中心赵媛媛教授参与讨论。
开场致辞
会议伊始,会议主席段建春教授、闫小龙教授分别作开场致辞并介绍了与会专家,致辞中指出,期待通过此次会议交流新一代ALK-TKI的最新临床进展,交流中外临床实践。

第三代ALK-TKI的前世今生
Past and Present Lives of the Third Generation ALK Inhibitor Lorlatinib

Alice Shaw教授分享了ALK阳性NSCLC患者治疗版图的演变及第三代ALK-TKI的发展和讨论。ALK-TKI应用于临床已经十余年,第二代ALK-TKI克服了第一代的耐药问题,并具有更好的颅内活性,但患者仍然可能会耐药。如今,三代ALK-TKI洛拉替尼将成为前代ALK-TKI的取代者,在一线治疗中获得更多应用。
Alice Shaw教授指出,洛拉替尼可以很好地抑制二代ALK-TKI的耐药突变,如G1202R,同时具有非常强的血脑屏障透过性。在CROWN研究的5年随访中,洛拉替尼一线治疗对比克唑替尼降低了81%的疾病进展或死亡风险,对于基线有/无脑转移的患者均可带来显著获益,对于预后更差的V3变体患者同样展示显著疗效。安全性方面,洛拉替尼治疗中的大部分不良反应无明显症状,因不良反应导致的停药比例与克唑替尼组相近,而且因不良反应导致的剂量减少并未影响疗效,不良反应如高血脂、体重增加及中枢神经系统不良反应均可管可控。
Alice Shaw教授强调,尽管临床研究之间无法直接对比,但CROWN研究中洛拉替尼的一线治疗PFS数据上远超既往二代ALK-TKI,即使采取2+3模式进行序贯用药,其总体PFS也不及洛拉替尼一线PFS数据。因此,在一线治疗中,应首选可覆盖更广泛耐药突变,疗效更强劲的第三代ALK-TKI洛拉替尼。
在总结中,Alice Shaw教授指出,洛拉替尼作为一线治疗方案具有显著优势,而且可以更好地预防脑转移。治疗中的不良反应通过提前干预和管理也可以得到有效控制。未来仍需继续探索洛拉替尼的联合方案以进一步解决耐药问题,关注治疗后微小残留病灶(MRD)的检测等问题,进一步延长患者的PFS和OS。
10年里程碑:
开启ALK阳性NSCLC治疗新时代
10-Year Milestone: A New Era in the Treatment of ALK-Positive NSCLC

艾星浩教授展望了ALK阳性NSCLC的“新时代”。通过精准分子分型指导的个体化治疗,NSCLC患者的生存时间得到显著延长,而三代ALK-TKI洛拉替尼的问世,则彻底改写了肺癌治疗的历史。在CROWN研究中,洛拉替尼一线治疗的mPFS仍未达到,5年PFS率达到60%,这一成绩已经刷新了转移性实体瘤单药靶向治疗的新高度。
艾星浩教授针对最终的PFS结果,分享三种基于不同原理的模型预测结果。Sai-Hong Ignatius Ou教授2024年文章中基于洛拉替尼PFS曲线绝对下降趋势预测,最终mPFS或达10年以上;条件PFS率预测模型中,最终mPFS将达108~120个月;Weibull分布函数预测模型中,经生存曲线走势拟合预测,洛拉替尼一线mPFS约118.6个月。三种模型显示,洛拉替尼一线治疗mPFS均接近10年或以上,将建立精准治疗时代新标准,结合PFS2数据优异表现,其最终OS结果也令人期待。
关于安全性,艾星浩教授同样表示,长期随访数据已经验证了洛拉替尼良好的耐受性,患者因TRAE导致治疗中止的事件发生率仅约为5%。
艾星浩教授总结指出,基于CROWN研究中洛拉替尼的优异表现,权威指南已经将洛拉替尼列为ALK阳性NSCLC患者的一线治疗优先选择。洛拉替尼将改变ALK阳性NSCLC的整体治疗格局,并将在未来奠定一线治疗的新标准。
Talk with Prof. Alice Shaw
巅峰对话,探讨临床热点议题
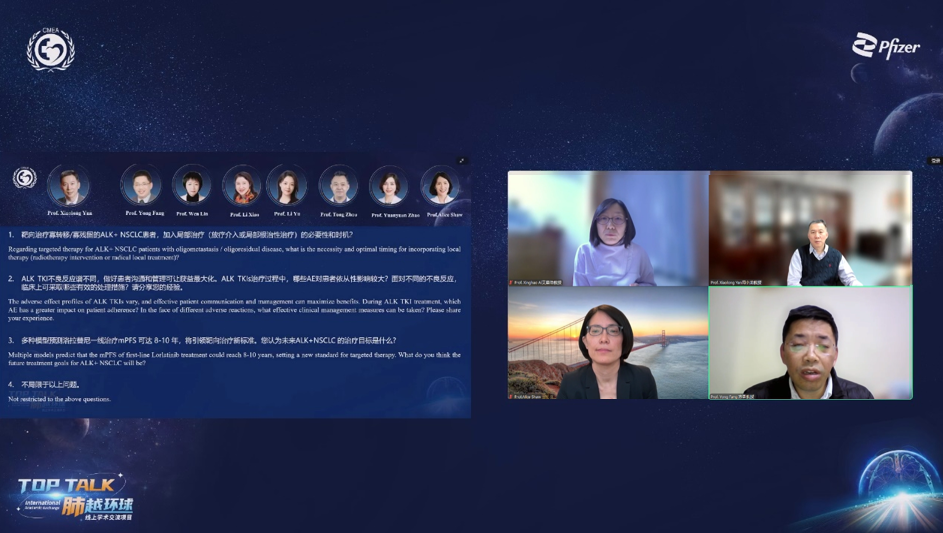
靶向治疗寡转移/寡残留的ALK阳性NSCLC患者,加入局部治疗(放疗介入或局部根治性治疗)的必要性和时机?
方勇教授:局部治疗具有重要价值,可以通过改善疾病局部控制,并通过与其他治疗手段的协同效应延长PFS和OS。这一点已经在很多病例中得到佐证。干预时机应尽量早,当靶向治疗已经实现非常显著的应答但仍有残留肿瘤时,及早介入局部治疗,可以为患者带来非常大的获益,此外对于靶向治疗后疾病稳定的患者,也可通过局部治疗巩固治疗效果。对于寡转移/寡进展的患者,可以考虑放疗或射频消融以辅助靶向治疗;局部治疗的患者选择需谨慎,可通过MDT讨论制定治疗方案,具体问题具体分析。
Alice Shaw教授:TKI治疗后寡进展的患者,应结合局部治疗控制病灶进展,尽量延长患者接受TKI治疗的时间。此外,寡残留可能提示耐药的癌细胞,考虑其后续可能会突变,导致疾病复发,应及早进行局部治疗干预,尽量将其完全清除。目前一些研究数据也同样支持这类治疗模式,可以转化为更长的PFS乃至更长的OS。
于莉教授:早期介入局部治疗具有必要性,特别是对于寡转移灶患者。局部治疗有两个最佳时机,分别是TKI治疗启动早期,缩瘤明显但仍未达完全缓解时,以及巩固加强治疗时期。局部治疗的开展需进行多学科讨论。请问Alice教授,如何平衡局部治疗的获益与过度治疗的风险?是否有相应的生物标志物可以进行指导?
Alice Shaw教授:局部治疗对于残留病灶非常重要,我们也曾考虑在TKI治疗3~4个月后联合局部治疗进行巩固和加强,特别是在洛拉替尼的治疗中。但现有循证医学证据主要为回顾性研究或II期随机对照研究,尚无法明确获益。不过洛拉替尼的治疗可以为患者带来非常大的获益,可能在10年中疾病发展都会得到控制,而局部治疗则可能具有风险,因此需要与患者进行开诚布公讨论,综合权衡风险与获益。
ALK-TKI不良反应谱不同,做好患者沟通和管理可让获益最大化。ALK-TKIs治疗过程中,哪些AE对患者依从性影响较大?面对不同的不良反应,临床上可采取哪些有效的处理措施?
林雯教授:药物的不良反应管理中最重要的是患者教育工作,不同的ALK-TKI不良反应谱不同,例如克唑替尼常见便秘、视觉障碍,阿来替尼可能导致疲乏,恩沙替尼可能导致皮疹。我们需要针对这些AE做好患者教育,使患者做好日常管理工作,例如针对皮疹,做好皮肤的日常护理;针对腹泻,指导患者饮食建议与调整策略。在我的临床经验中,洛拉替尼对患者日常生活的影响相对较少,针对高脂血症、体重增加等不良反应,我们会在患者复查时进行检验,以评估是否需干预。在我的临床经验中,几乎没有患者发生明显的体重增加或神经系统病变。在患者的长期用药中,做好安全管理,可以保障患者的生活质量。
肖莉教授:不同ALK-TKI的不良反应谱不同,用药前需要了解患者的情况,使患者了解可能发生的不良反应,并在发生后及时报告。及早发现不良反应,积极干预不良反应,有利于提高患者的治疗依从性。
亚洲人群从洛拉替尼的治疗中可获得一致获益
周彤教授:CROWN研究中洛拉替尼一线治疗亚洲患者的疗效与安全性与全球患者是否有差异?
Alice Shaw教授:亚洲人群的获益与全球人群一致。高脂血症是洛拉替尼治疗中最常见的不良反应,但通过他汀类药物等可以良好管理。根据我的临床经验,患者的高血脂都可以得到很好的控制,我会与专业的血脂管理团队共同做好患者的安全管理。
洛拉替尼一线治疗早期进展的患者,需要进一步明确耐药机制
赵媛媛教授:我们已经在一线使用洛拉替尼,也有很多患者从中获益,PFS非常长,但也有一些患者会早期进展。对于早期进展的患者,应如何选择二线治疗方案?
Alice Shaw教授:的确有一小部分患者会在早期进展,但大部分患者都可以达到很好地应答。早期患者数量较少,而且通常未进行二次活检,难以明确早期耐药机制,根据我们的临床经验,部分患者出现了MET扩增或PI3K/AKT/mTOR通路的激活,对于这些患者,可能需要联合多种药物进行治疗。但总体而言,一般不会发生ALK通路内的突变,这一点与既往的ALK-TKI不同,前代ALK-TKI无法抑制所有耐药突变,因此这些患者在耐药后需要明确耐药机制,并进行ALK-TKI或化疗的后线治疗。
一线治疗已采用二代ALK-TKI的患者,可更换至三代TKI
闫小龙教授:使用二代ALK-TKI治疗后,疗效评估为疾病稳定(SD)的患者,能否考虑转换使用洛拉替尼?
Alice Shaw教授:肯定可以。在最新的临床研究数据公布后,基于洛拉替尼的出色疗效表现,在美国,即使一些患者使用二代ALK-TKI时取得了不错的疗效,我们也会更换至洛拉替尼。因为我们认为洛拉替尼对中枢神经系统的保护效果更好,疗效也更好。所以对于二代ALK-TKI未应答或应答不佳的患者,我们肯定会及早更换至洛拉替尼。
单细胞和空间蛋白质转录组分析揭示SCLC神经内分泌特征相关的免疫浸润异质性

金莹教授分享了该课题组在SCLC免疫浸润方面的研究成果。目前,免疫联合化疗是广泛期小细胞肺癌的标准一线治疗方案,然而很大一部分患者仍无法从免疫治疗中获益。此前,基于小细胞肺癌转录因子表达水平的分类方式指出,神经内分泌特征较弱的小细胞肺癌亚型可能由于微环境特征而更容易从免疫治疗中获益。
该团队自2019年起,基于单细胞及空间蛋白转录组测序技术,对来自3例小细胞肺癌和2例大细胞神经内分泌癌的19个样本和44例手术切除的小细胞肺癌FFPE样本进行测序,并使用公共数据库进行验证。
研究团队在小细胞肺癌中总计识别了24种主要细胞类型,构成了多样化的免疫微环境,研究团队分析了肿瘤和7种关键免疫细胞的通讯机制,评估了不同亚型小细胞肺癌的免疫细胞浸润异质性及相关的基因表达差异,提示小细胞肺癌内部存在异质性较强的神经内分泌分化特征,并找寻了可预测小细胞肺癌免疫炎症型的生物标志物,并初步进行了验证,团队后续也将围绕该成果开展更多验证工作。
专家讨论
方勇教授:该研究通过单细胞测序及空间蛋白质转录组分析的整合,帮助我们进一步了解了小细胞肺癌的复杂异质性。小细胞肺癌作为临床中的难题,尽管目前已经有了一些治疗策略,但并不都对治疗敏感。本次研究揭示了小细胞肺癌、神经内分泌肿瘤与免疫微环境之间的复杂关系,提示了识别小细胞肺癌内“冷热”区域不同免疫细胞浸润情况的重要意义,也解释了部分患者对免疫治疗的耐药。研究为后续新治疗模式的研究提供了创新性思路,有望改善小细胞肺癌患者的预后。
林雯教授:大部分小细胞肺癌患者均无法从免疫治疗中获益,原因在于小细胞肺癌对比非小细胞肺癌是一种“冷肿瘤”。对于神经内分泌特征较强的患者,接受免疫治疗的效果可能更差,既往通过转录因子进行的ANPY分型在临床实践中的可操作性不强,本次研究结果则令人期待,如成功在临床中得到验证,将有望为患者带来获益。
周彤教授:小细胞肺癌患者接受免疫治疗达到长生存的比例仅有约10%,本次研究中发现了潜在的可能与免疫治疗疗效存在相关性的神经内分泌表达特征,这类标记(如REST)的比例大概为多少?我们应如何在临床中使用这样的生物标志物?
金莹教授:REST表达的比例不到20%,这也与临床中的免疫治疗获益人群比例一致。当然,生物标志物能否应用于临床,仍然有很多工作要做,我们目前除了在体外和动物体内进行验证外,也尝试在临床样本中进行验证。不久前复旦大学曹志伟教授/陈海泉教授团队发表了一篇基于单细胞空间转录组学的小细胞肺癌研究,该研究中也发现了异质性免疫微环境,并发现存在免疫细胞浸润群落的患者可能有更好的免疫应答和预后。我们也同样发现REST可能通过招募巨噬细胞和T细胞形成免疫细胞群落。当然,具体的机制仍然需要后续的更多探索工作。
总结
会议的最后,会议主席段建春教授、闫小龙教授对本次会议进行了总结。随着对肺癌认识的加深,未来将有望为患者提供更个体化的治疗模式。洛拉替尼在CROWN研究中的优异表现,奠定了其在ALK阳性NSCLC治疗中的重要地位,未来将有望在临床实践中获得更多应用。
扫描下方二维码观看回放

排版编辑:肿瘤资讯-Iris











 苏公网安备32059002004080号
苏公网安备32059002004080号


