2025年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)上,双特异性抗体在消化系统肿瘤中的创新探索/应用获得广泛关注。本文整理了大会中关于SHR-1701(PD-L1/TGF-β)、卡度尼利单抗(PD-1/CTLA-4)、Zanidatamab(HER2双表位)、Amivantamab(EGFR-MET)和BGB-B167(CEA×4-1BB)等双特异性抗体的最新研究进展。这些研究显示,双特异性抗体通过靶向多个关键分子信号通路,在胃癌、食管癌、肠癌和胆道恶性肿瘤等领域表现出良好的疗效和可控的安全性,为消化系统肿瘤的治疗提供了新的策略和希望。
1. SHR-1701:靶向PD-L1和TGF-β的双功能融合蛋白(胃癌、食管癌)
SHR-1701是我国自主原研的一种创新型双功能融合蛋白,由靶向PD-L1的单克隆抗体与TGF-β受体II的胞外域融合而成。这种独特的设计使其能够同时阻断PD-L1和TGF-β信号通路,从而增强抗肿瘤免疫反应。在此次大会上,SHR-1701在胃癌和食管癌领域的三项研究成果引人注目。
在胃癌领域,由沈琳教授牵头开展的一项多中心、随机、双盲、III期研究(NCT04950322)评估了SHR-1701联合CAPOX方案对比安慰剂联合CAPOX一线治疗HER2阴性胃/胃食管结合部腺癌患者。该研究之前已在2024 ESMO大会(LBA60)上报道了总生存期(OS)获益结果,本次会议则聚焦于SHR-1701对化疗相关骨髓抑制的作用,彭智教授口头报告了研究结果。结果显示,SHR-1701降低了任何级别的血小板计数减少、中性粒细胞计数减少和白细胞计数减少的发生率,分别减少了8.7%、10.1%和11.2%,≥3级不良反应则分别减少了9.1%、4.3%和1.6%。与安慰剂组相比,SHR-1701联合CAPOX组使用血小板生长因子和白细胞生长因子的患者比例更低。这一发现表明,SHR-1701除了具有抗肿瘤活性外,还有减轻化疗相关骨髓抑制的能力。
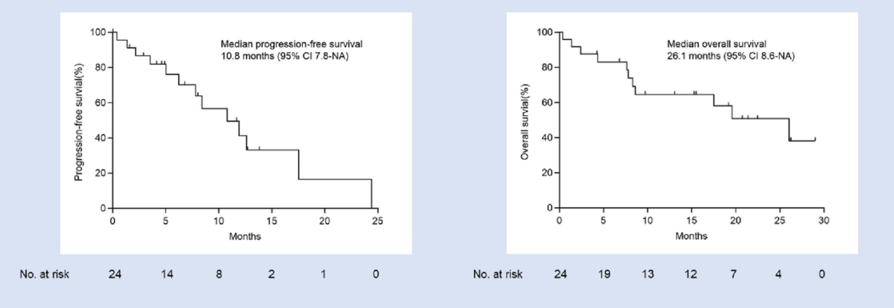
在食管鳞癌(ESCC)方面,一项II期试验评估了SHR-1701联合化疗(白蛋白结合型紫杉醇+顺铂)用于不可切除局部晚期、复发或转移性ESCC的疗效和安全性。24例患者接受SHR-1701联合化疗、随后SHR-1701维持治疗直至疾病进展或出现不可耐受的毒性。结果显示,确认的客观缓解率(ORR)高达62.5%,疾病控制率(DCR)达87.5%。中位随访20.8个月,中位缓解持续时间(mDoR)为9.1个月,中位无进展生存期(mPFS)为10.8个月,mOS达26.1个月(图1)。12个月PFS率和OS率分别为41.4%和64.8%。3级治疗相关不良事件(TRAEs)发生在45.8%的患者中,未观察到4-5级TRAEs和治疗相关死亡事件。这些数据表明SHR-1701联合化疗作为晚期ESCC的一线治疗能够提供长期、持久的生存获益。
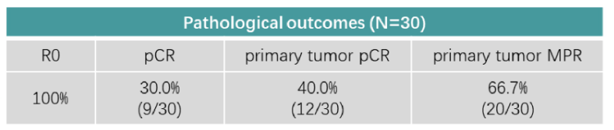
另一项针对ESCC的II期试验探索了SHR-1701联合放化疗(白蛋白紫杉醇+卡铂)新辅助治疗可切除局部晚期ESCC患者的疗效和安全性。研究结果令人鼓舞:30例接受手术的患者均达到R0切除,无院内和术后30天死亡事件;30%的患者的原发肿瘤和淋巴结中均达到pCR(ypT0N0),40%的患者的原发肿瘤中达到pCR(ypT0N+)(表1)。安全性方面,尽管所有患者均出现了TRAEs,但大多数为1-2级。这些数据表明,新辅助放化疗基础上联合SHR-1701在局部晚期ESCC中展现出令人鼓舞的疗效和可接受的安全性。
表1 SHR-1701联合放化疗新辅助治疗ESCC的疗效
2.卡度尼利单抗:靶向PD-1和CTLA-4的双特异性抗体(肠癌)
卡度尼利单抗是一种同时靶向PD-1和CTLA-4的人源化双特异性抗体。在此次大会上,卡度尼利单抗在错配修复正常/微卫星稳定(pMMR/MSS)的mCRC和局部晚期直肠癌(LARC)患者中的研究展示了其广阔的应用前景。
既往AtezoTRIBE II期试验结果显示在FOLFOXIRI+贝伐珠单抗基础上联合抗PD-L1抗体阿替利珠单抗一线治疗可改善mCRC患者的OS,但在pMMR/MSS亚组中获益有限(HR 0.80,P=0.117)。多中心、II期SYLT-026研究评估了卡度尼利单抗联合FOLFOXIRI和贝伐珠单抗一线治疗pMMR/MSS mCRC患者的疗效和安全性。在此次大会上,福建省肿瘤医院林榕波教授团队报告了该研究的初步结果。
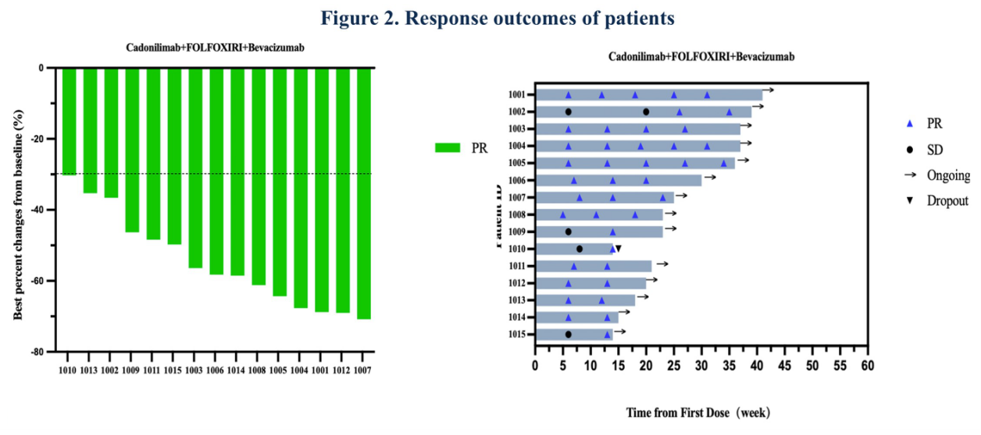
研究纳入了20例初治pMMR/MSS mCRC患者,中位年龄65.5岁,40%的患者ECOG PS为1分或2分,55%发生了3个或更多器官转移,35%携带RAS/BRAF突变。中位随访5.0个月,15例可评估疗效的患者确认的ORR和DCR均达到100%(图2),mPFS和mOS数据尚未成熟。安全性方面,所有患者均出现了TRAEs,但大多数为1-2级。最常见的3-4级不良事件包括中性粒细胞减少(55%)、白细胞减少(15%)和输注反应、皮炎、结肠炎、贫血、ALT升高和腹泻(均为5%),1例(5%)患者因免疫介导性结肠炎停止治疗,未发现新的安全性信号。这些初步结果表明,卡度尼利单抗联合FOLFOXIRI和贝伐珠单抗一线治疗pMMR/MSS mCRC患者显示出令人鼓舞的疗效和可控的安全性。值得在更大规模的试验中进一步验证。
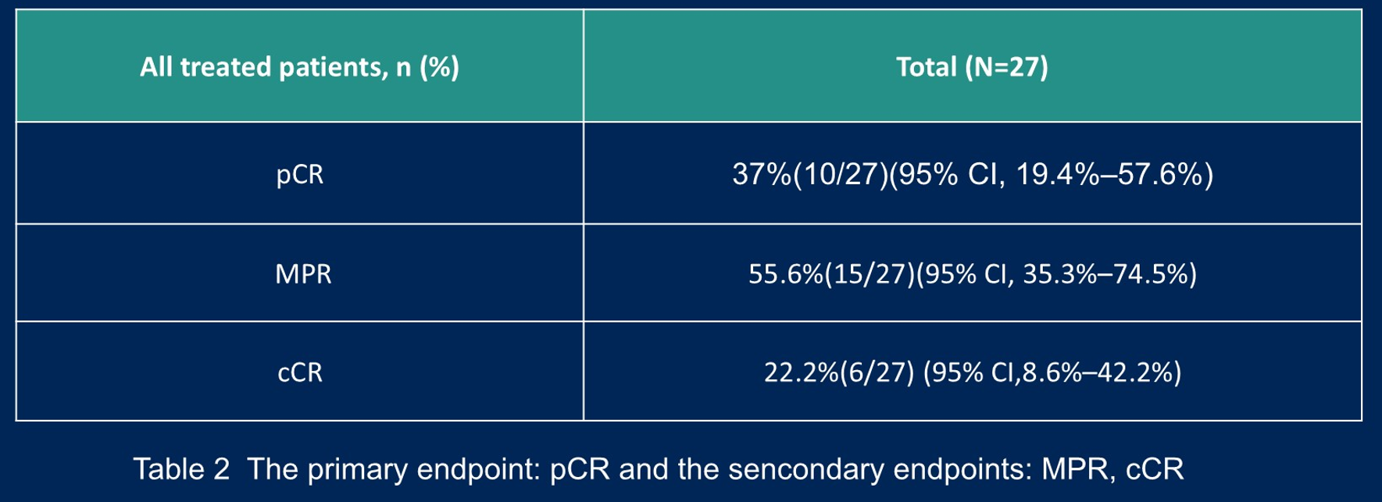
在pMMR/MSS局部晚期直肠癌的新辅助治疗中,卡度尼利单抗联合短程放疗和mFOLFOX6的多中心、单臂、II期研究(NeoCaCRT)进一步证实了其潜力。27例患者中,24例(88.9%)达到R0切除,pCR率为37%,主要病理缓解(MPR)率为55.6%,临床完全缓解(cCR)率为22.2%(表2)。此外,59.3%的患者观察到T降期,66.7%的患者观察到N降期。尽管18.5%的患者发生3-5级不良事件,但未发现新的安全性信号。这些数据支持进一步开展III期随机研究。
表2 NeoCaCRT研究的疗效结果
3. Zanidatamab:靶向HER2的双特异性抗体(胆道恶性肿瘤)
Zanidatamab是一种靶向HER2的双特异性抗体,可同时结合HER2的两个非重叠域,增强抗肿瘤活性。在此次大会上,Zanidatamab在HER2阳性胆道恶性肿瘤(BTC)中的研究展示了其显著的生存获益。
对于一线治疗后进展的BTC患者,预后通常较差,接受后续化疗的mOS仅为6~9个月。在2b期HERIZON-BTC-01研究的初步分析中,经过中位12.4个月随访,Zanidatamab在既往接受过治疗的HER2+ BTC患者中显示出令人鼓舞的抗肿瘤活性(确认的ORR为41%),迅速缓解且持久,安全性可控。此次ASCO GI大会公布了更长时间随访后的结果,包括OS数据。中位随访时间21.9个月。确认的ORR与初步分析保持不变(n=33;41%)。mDoR增加约2个月,至14.9个月。mOS为15.5个月,12个月OS率为56.2%(图3)。在所有87例患者中,21%(18例)出现了≥3级TRAEs,最常见的3级TRAEs为腹泻、贫血和射血分数降低。仅1例患者出现4级TRAE。未发生治疗相关死亡事件。
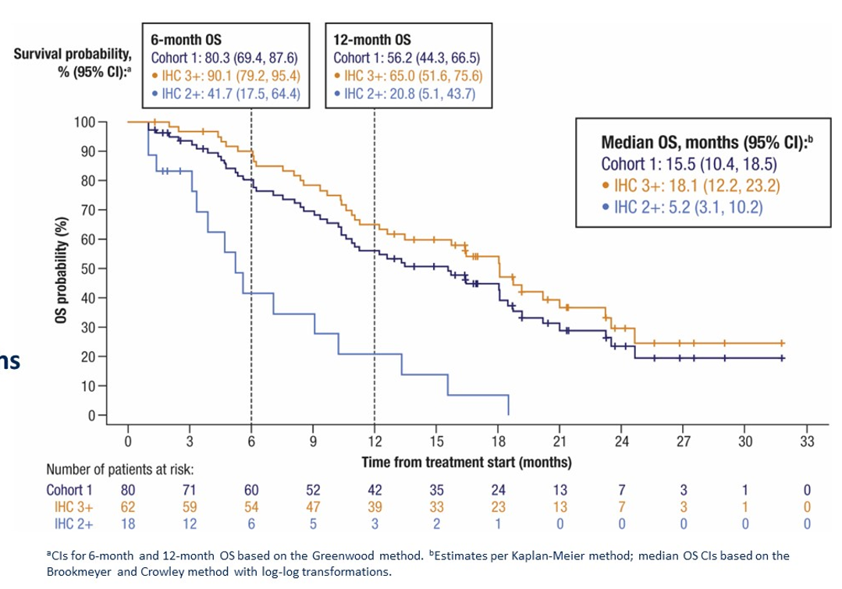
在此研究基础上,研究者启动了全球、随机、开放标签、III期试验(HERIZON-BTC-302),评估Zanidatamab联合顺铂+吉西他滨对比单独使用顺铂+吉西他滨±PD-1/L1抑制剂一线治疗HER2阳性晚期/转移性BTC的疗效和安全性。主要终点是IHC 3+ BTC患者的PFS,次要/探索性终点包括OS(IHC 3+亚组;总体人群)、PFS(总体人群)、cORR、不良事件的发生率和严重程度以及患者报告的结局。该研究目前正在全球范围内积极招募患者,未来的研究结果值得期待。
4. Amivantamab:靶向EGFR和MET的双特异性抗体(结直肠癌)
Amivantamab是一种具有免疫细胞导向活性的EGFR-MET双特异性抗体,已获FDA批准用于EGFR突变的NSCLC。在本次大会上,Amivantamab在右侧转移性结直肠癌(mCRC)患者中的研究证实了其在胃肠道肿瘤中的潜力。
约68%的mCRC患者存在MET高表达,而MET扩增在高达23%的EGFR耐药mCRC中发生,被认为是驱动对EGFR靶向抗体耐药的重要因素。此外,右侧CRC对传统的EGFR靶向药物的反应较差,预后更差,亟需新的治疗选择。在此次大会上,研究者公布了开放标签、Ib/II期OrigAMI-1研究中关于右侧mCRC患者的最新数据。该研究评估了Amivantamab单药以及联合FOLFOX/FOLFIRI化疗在mCRC中的应用。研究结果令人鼓舞:23例接受Amivantamab单药治疗的右侧mCRC患者中,ORR达22%,DCR达78%,其中1例达到完全缓解(CR),mDoR为9.8个月。7例接受Amivantamab联合FOLFOX/FOLFIRI治疗的患者中,ORR进一步提高至43%,DCR达86%,mPFS为7.4个月(表3)。安全性数据与先前报告的一致,未发现新的安全性信号,最常见的≥3级不良事件为皮疹和低白蛋白血症。这些研究数据表明,Amivantamab单药或联合FOLFOX/FOLFIRI在右侧mCRC患者中显示出持久的抗肿瘤活性。
表3 OrigAMI-1研究的疗效结果
5. BGB-B167:靶向CEA和4-1BB的双特异性抗体(在胃癌、肠癌领域的初步探索)
BGB-B167是一种潜在的first in class靶向CEA(一种在多种肿瘤中过表达的肿瘤相关抗原)和4-1BB(T细胞共刺激受体)的IgG双特异性抗体。通过同时靶向CEA和4-1BB,BGB-B167能够激活T细胞并增强抗肿瘤免疫反应。在本次大会上,BGB-B167在晚期实体瘤中的首次人体Ia期研究展示了其初步的抗肿瘤活性。
研究纳入了既往接受过标准治疗的不可切除/转移性结直肠癌(CRC)、CEA阳性胃癌(GC)或非小细胞肺癌(NSCLC)患者,接受BGB-B167±替雷利珠单抗治疗。截至2024年9月23日,共入组54例患者(单药组31例,联合组23例),大部分为CRC患者,超过60%的患者有肝转移和接受过3线或以上先前治疗。
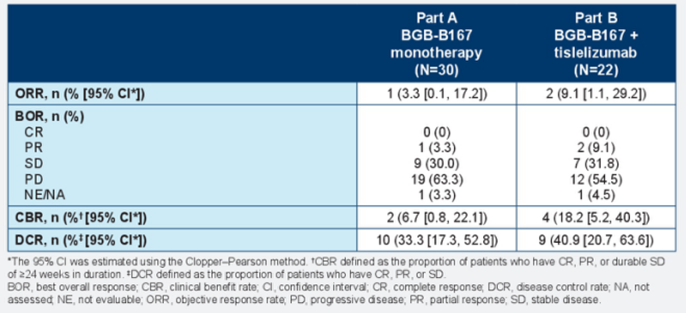
研究结果显示,BGB-B167具有良好的安全性特征,最常见的不良反应为轻中度恶心、疲劳、瘙痒和腹泻。值得注意的是,未观察到通常与T细胞激活相关的肝毒性或细胞因子释放综合征(CRS),这是相对于其他同类药物的重要优势。虽然处于早期研究阶段,但BGB-B167已在多线治疗后的实体瘤患者中显示出初步抗肿瘤活性,BGB-B167单药和联合治疗组的DCR分别为33.3%和40.9%(表4)。3例患者达到部分缓解(PR),缓解持续时间均超过5.6个月。总体而言,BGB-B167±替雷利珠单抗的耐受性良好,在晚期/转移性CEA阳性实体瘤患者中显示出一定的抗肿瘤活性,为其进一步开发奠定了基础。
表4 BGB-B167±替雷利珠单抗治疗晚期/转移性实体瘤的疗效
排版编辑:肿瘤资讯-Marie











 苏公网安备32059002004080号
苏公网安备32059002004080号


