前列腺癌是男性泌尿系统中最常见的恶性肿瘤之一,其中相当一部分患者会进展为转移性去势抵抗性前列腺癌(mCRPC)。mCRPC的发生常伴随不良预后和总生存期的显著缩短。聚ADP核糖聚合酶(PARP)抑制剂作为一类新型治疗药物,已在mCRPC的治疗中展现出重要价值[1]。
2025年美国临床肿瘤学会泌尿生殖系统肿瘤研讨会(2025 ASCO GU)已于美国旧金山当地时间2月13-15日盛大召开。作为泌尿肿瘤领域的国际盛会,每年ASCO GU会议期间均汇聚了众多国内外重磅研究成果,其中美国犹他州大学亨茨曼癌症研究所的Neeraj Agarwal教授团队的研究“在III期TALAPRO-2试验中,mCRPC患者接受他拉唑帕利+恩扎卢胺作为一线治疗的最终总生存期(OS)”以Late-Breaking Abstract的形式成功入选口头摘要,引发了全球的热烈讨论。为此,【肿瘤资讯】特邀Neeraj Agarwal教授就此项研究进行深入解读,并对mCRPC的治疗前景发表深刻见解。

犹他大学亨茨曼癌症研究所(HCI)医学教授兼任 HCI癌症研究首席讲座教授。
HCI泌尿生殖系统肿瘤项目和临床试验中心负责人。
Neeraj Agarwal 教授在新德里的全印度医学科学研究所完成医学培训后,他在爱荷华大学完成了内科住院医师培训和老年医学研究员培训,随后在HCI完成了血液肿瘤学研究员培训。
国际知名泌尿生殖系统癌症领域医师科学家;多项I/II期和III期临床试验总研究负责人以及许多其他试验指导委员会成员;曾获 SWOG 青年研究者奖、Wiliam D.Odell 青年研究者奖和国家癌症研究所癌症临床研究团队领导奖。
Neeraj Agarwal 教授撰写了385余篇经过同行评审的文章和书籍章节;美国国家综合癌症网络(NCCN)和美国临床肿瘤学会泌尿生殖系统病症指南委员会专家组成员;美国食品药品监督管理局肿瘤药物咨询委员会顾问;领导SWOG泌尿生殖系统癌症委员会的早期治疗研究。
ASCO每日新闻主编;ASCO癌症网站的专家编辑;《临床肿瘤学杂志》和《欧洲泌尿学》等期刊编委;ASCO泌尿生殖系统癌症咨询小组成员。最近,Neeraj Agarwal医生被任命为亨茨曼癌症研究所临床研究创新部高级主任,直接向该癌症中心主任汇报。
联合治疗具有潜在优势,mCRPC患者或可有更多临床获益
Q1. mCRPC是前列腺癌的终末期阶段,相较于早期局限性前列腺癌患者其预后较差,也是造成前列腺癌患者死亡的主要原因。您认为制定mCRPC治疗方案需要考虑哪些要点?
两项LBA重磅发布,TALAPRO-2研究引领mCRPC新一线标准治疗
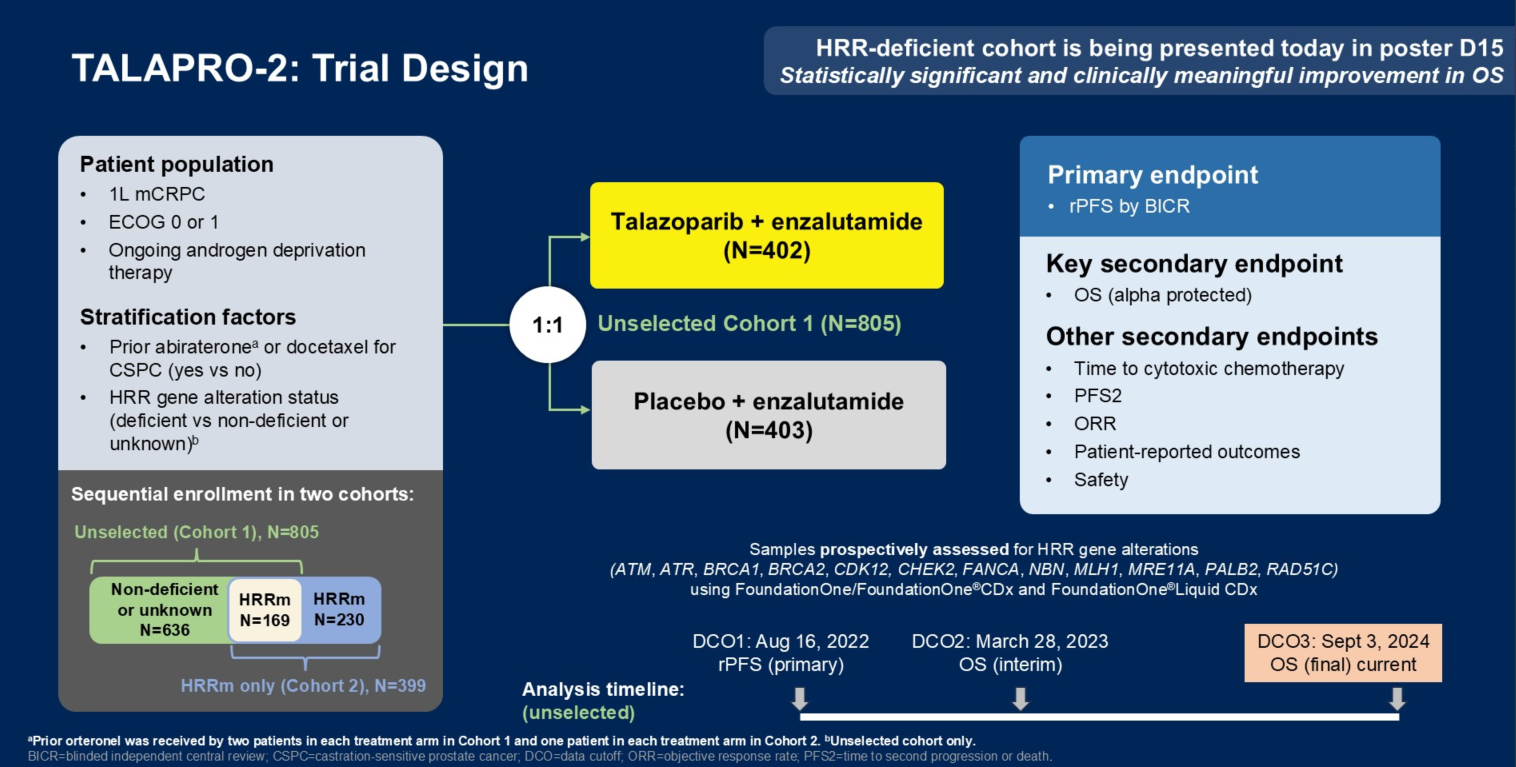
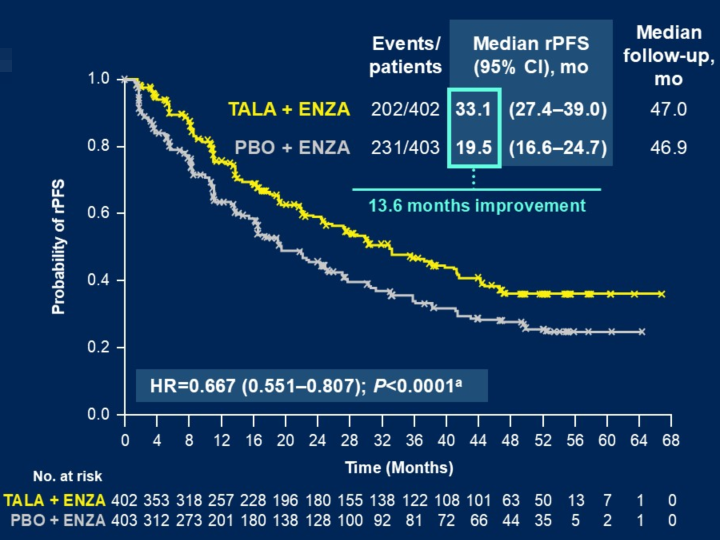
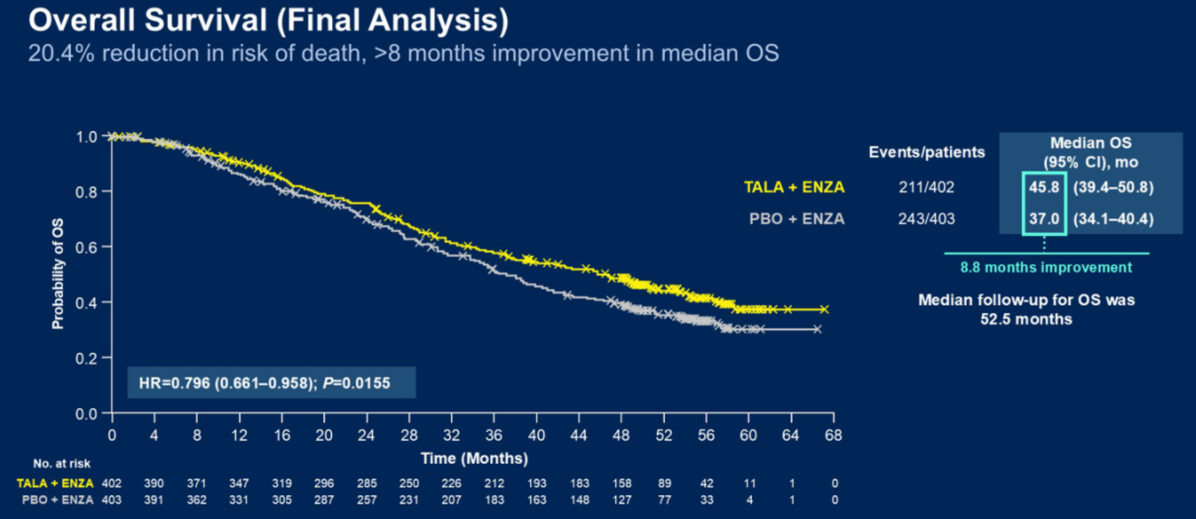
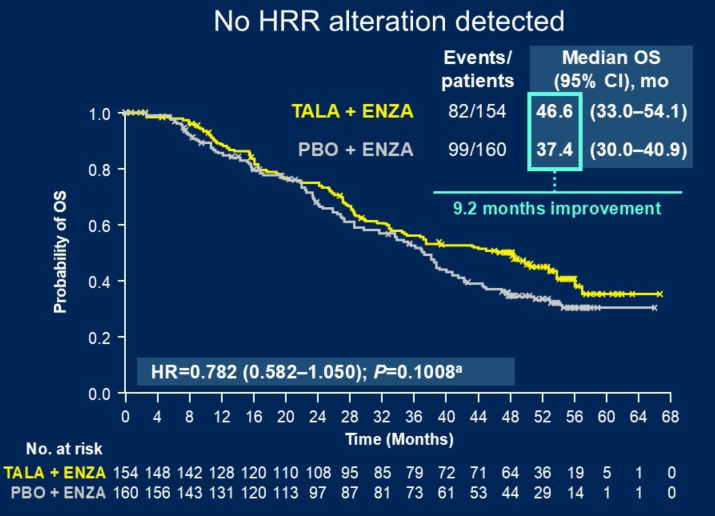
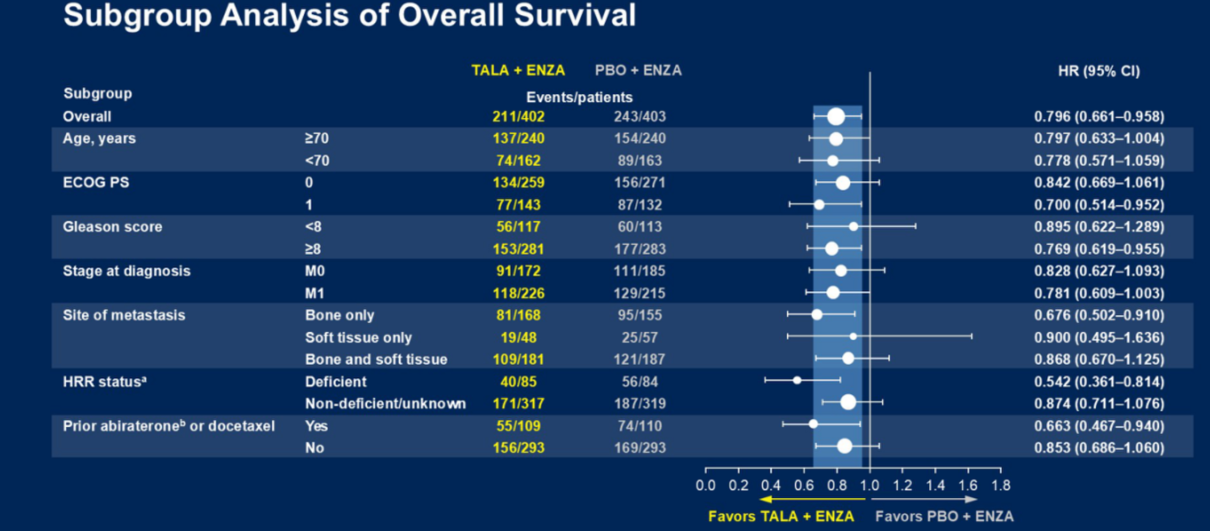
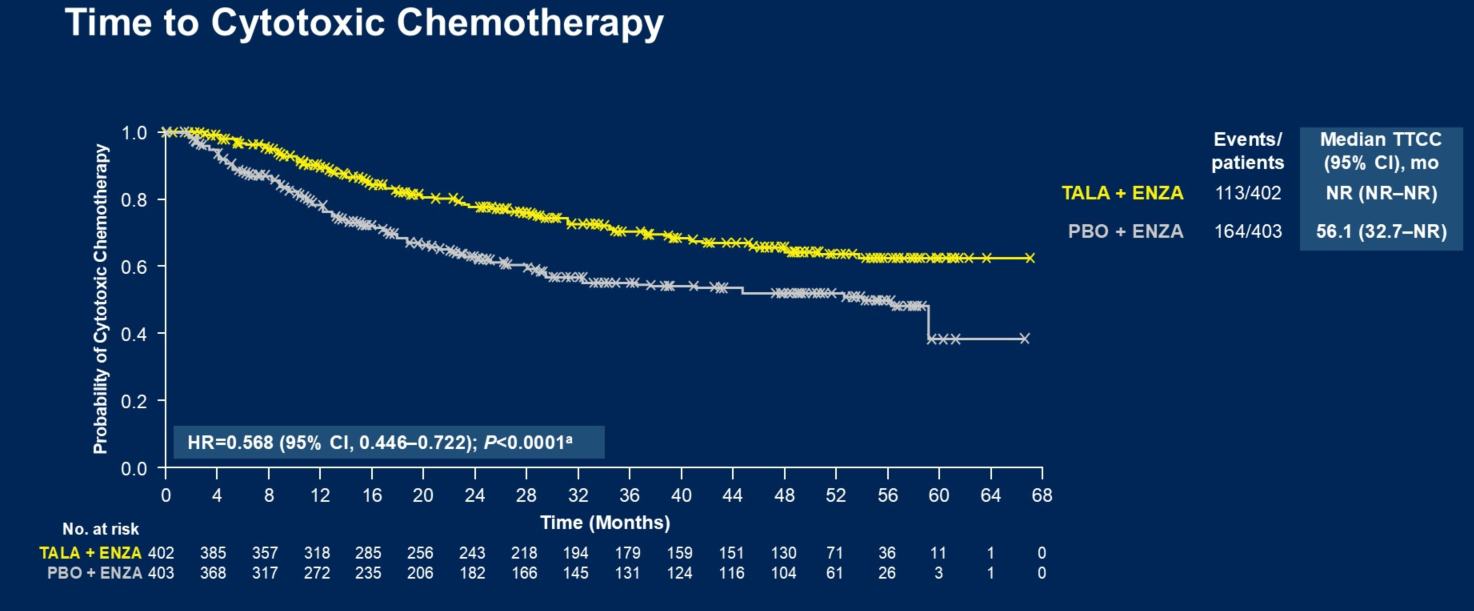
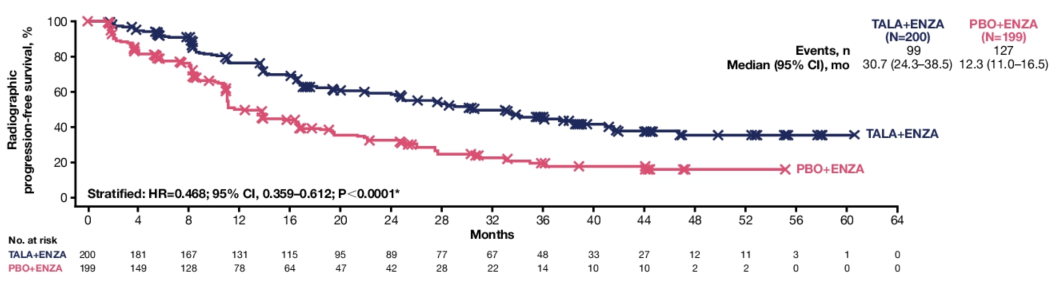
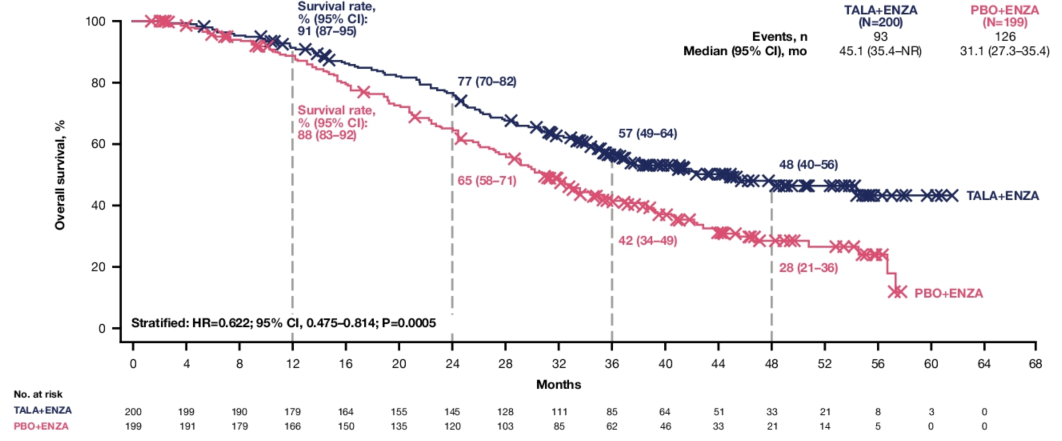
Q2. 在本次ASCO GU会议上,TALAPRO-2研究的队列1和队列2的更新数据分别以LBA18和LBA141发布,在全球范围内都引起了广泛关注,能否请您分享一下此次研究数据的更新有哪些亮点?基于当前的结果,TALAPRO-2研究对mCRPC治疗有何启示?
耐受性良好,他拉唑帕利联合治疗亦可保证患者生存质量
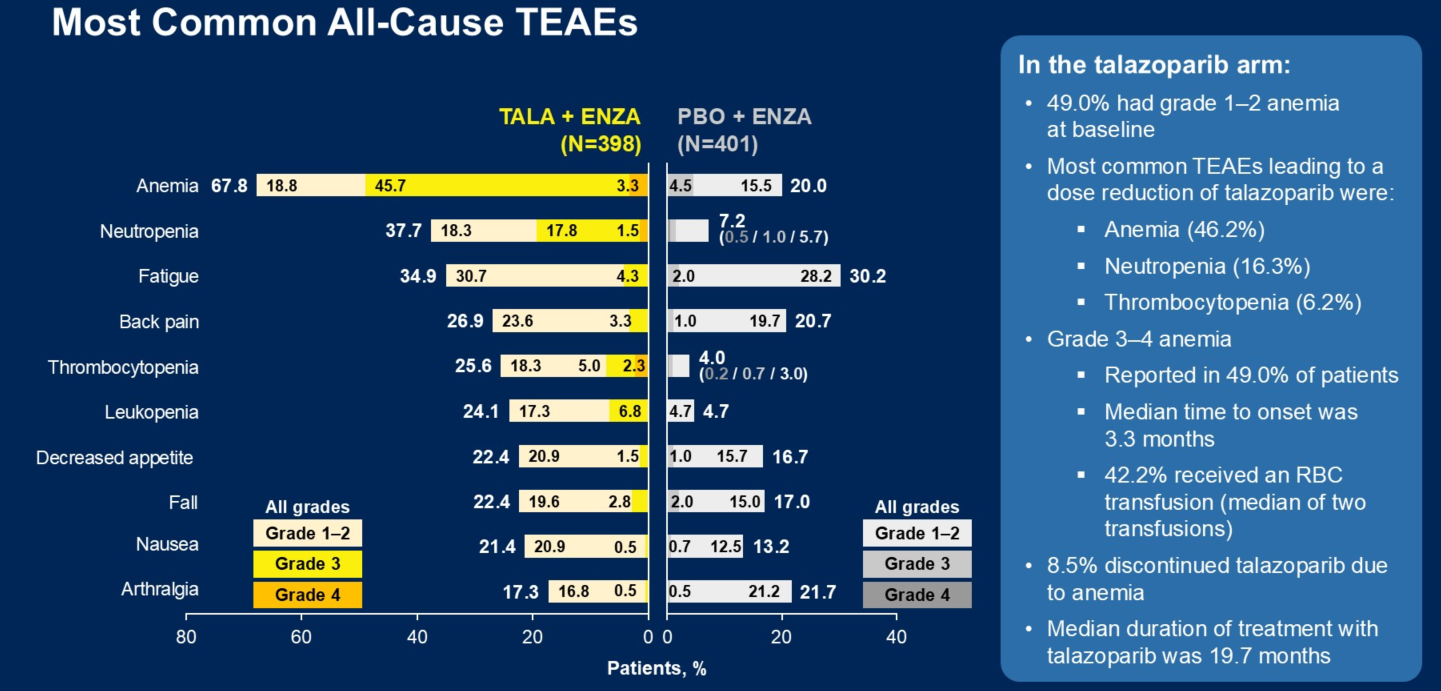
Q3. PARP抑制剂与某些特定不良事件相关,例如骨髓增生异常综合征(MDS)和急性髓系白血病(AML)。能否请您介绍一下本次TALAPRO-2研究的队列1更新了哪些安全性数据?他拉唑帕利联合疗法的安全性如何?
新兴疗法前景可期,联合疗法或可发挥更大优势
Q4. 近年来,mCRPC治疗领域出现了多种新兴疗法,例如ADC药物、PARP抑制剂,放射性配体疗法等,mCRPC的治疗有了更多的选择。您认为这些新兴疗法为mCRPC的治疗带来了哪些机遇和挑战?未来mCRPC的治疗将会有怎样的发展趋势?
[1] Taylor AK, Kosoff D, Emamekhoo H, Lang JM, Kyriakopoulos CE. PARP inhibitors in metastatic prostate cancer. Front Oncol. 2023 Apr 24;13:1159557. doi: 10.3389/fonc.2023.1159557. PMID: 37168382; PMCID: PMC10165068.
[2] Freedland SJ, et al. Prostate Cancer Prostatic Dis. 2024.27:327-333.
[3] Agarwal N, Azad AA, Carles J, et al. Talazoparib plus enzalutamide in men with first-line metastatic castration-resistant prostate cancer (TALAPRO-2): a randomised, placebo-controlled, phase 3 trial. Lancet. 2023 Jul 22;402(10398):291-303.
[4] Neeraj Agarwal, et al. Overall survival with talazoparib plusenzalutamide in unselected patients withmetastatic castration-resistant prostate cancer inthe Phase 3 TALAPRO-2 trial. 2025 ASCO GU LBA18.
[5] Karim Fizazi, et al. Final Overall Survival With TalazoparibPlus Enzalutamide as Initial Treatmentin Patients With HomologousRecombination Repair-DeficientMetastatic castration-Resistant ProstateCancer in the Phase 3 TALAPRO-2 Trial. 2025 ASCO GU LBA141.
[6] Vesna Vetma, Suzanne O'Connor, and Alessio Ciulli. Development of PROTAC Degrader Drugs for Cancer. Annual Review of Cancer Biology. 2024 Vol 9. doi.org/10.1146/annurev-cancerbio-061824-105806
[7] https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-pluvicto-metastatic-castration-resistant-prostate-cancer
[8] Sartor O, Jiang DM, M. Smoragiewicz, et al. Efficacy of 177Lu-PNT2002 in PSMA-positive mCRPC following progression on an androgen-receptor pathway inhibitor (ARPI) (SPLASH). Ann Oncol. 2024;35(suppl 2):S1254-S1255. doi:10.1016/j.annonc.2024.08.2308
[9] Chua WM, Lam WW, Tong AK, Sultana R, Kua SMY, Kanesvaran R, Wong ASC, Tay KJ, Cheng TJL, Ng DCE, Thang SP. Outcomes and prognostic predictors of Lu-177 PSMA radioligand therapy in metastatic castration-resistant prostate cancer (Asian Population Study). Asia Pac J Clin Oncol. 2024 Oct;20(5):572-581. doi: 10.1111/ajco.13944. Epub 2023 Mar 31. PMID: 36999335.
[10] Sathekge MM, Lawal IO, Bal C, Bruchertseifer F, Ballal S, Cardaci G, Davis C, Eiber M, Hekimsoy T, Knoesen O, Kratochwil C, Lenzo NP, Mahapane J, Maserumule LC, Mdlophane AH, Mokoala KMG, Ndlovu H, Pant V, Rathke H, Reed J, Sen IB, Singh A, Sood A, Tauber R, Thakral P, Yadav MP, Morgenstern A. Actinium-225-PSMA radioligand therapy of metastatic castration-resistant prostate cancer (WARMTH Act): a multicentre, retrospective study. Lancet Oncol. 2024 Feb;25(2):175-183. doi: 10.1016/S1470-2045(23)00638-1. Epub 2024 Jan 11. PMID: 38218192.
[11] Nguyen H, Hird K, Cardaci J, Smith S, Lenzo NP. Lutetium-177 Labelled Anti-PSMA Monoclonal Antibody (Lu-TLX591) Therapy for Metastatic Prostate Cancer: Treatment Toxicity and Outcomes. Mol Diagn Ther. 2024 May;28(3):291-299. doi: 10.1007/s40291-024-00699-w. Epub 2024 Mar 6. PMID: 38446353; PMCID: PMC11068829.
[12] Dorff T, Horvath LG, Autio K, Bernard-Tessier A, Rettig MB, Machiels JP, Bilen MA, Lolkema MP, Adra N, Rottey S, Greil R, Matsubara N, Tan DSW, Wong A, Uemura H, Lemech C, Meran J, Yu Y, Minocha M, McComb M, Penny HL, Gupta V, Hu X, Jurida G, Kouros-Mehr H, Janát-Amsbury MM, Eggert T, Tran B. A Phase I Study of Acapatamab, a Half-life Extended, PSMA-Targeting Bispecific T-cell Engager for Metastatic Castration-Resistant Prostate Cancer. Clin Cancer Res. 2024 Apr 15;30(8):1488-1500. doi: 10.1158/1078-0432.CCR-23-2978. PMID: 38300720; PMCID: PMC11395298.
[13] Lim EA, Schweizer MT, Chi KN, Aggarwal R, Agarwal N, Gulley J, Attiyeh E, Greger J, Wu S, Jaiprasart P, Loffredo J, Bandyopadhyay N, Xie H, Hansen AR. Phase 1 Study of Safety and Preliminary Clinical Activity of JNJ-63898081, a PSMA and CD3 Bispecific Antibody, for Metastatic Castration-Resistant Prostate Cancer. Clin Genitourin Cancer. 2023 Jun;21(3):366-375. doi: 10.1016/j.clgc.2023.02.010. Epub 2023 Feb 28. PMID: 36948922; PMCID: PMC10219845.
[14] Kelly WK, Danila DC, Lin CC, Lee JL, Matsubara N, Ward PJ, Armstrong AJ, Pook D, Kim M, Dorff TB, Fischer S, Lin YC, Horvath LG, Sumey C, Yang Z, Jurida G, Smith KM, Connarn JN, Penny HL, Stieglmaier J, Appleman LJ. Xaluritamig, a STEAP1 × CD3 XmAb 2+1 Immune Therapy for Metastatic Castration-Resistant Prostate Cancer: Results from Dose Exploration in a First-in-Human Study. Cancer Discov. 2024 Jan 12;14(1):76-89. doi: 10.1158/2159-8290.CD-23-0964. PMID: 37861461; PMCID: PMC10784743.
点击以下图片,获取更多2025 ASCO GU专栏资讯!
排版编辑:肿瘤资讯-明小丽












 苏公网安备32059002004080号
苏公网安备32059002004080号


