引用本文:
王昕, 乔蓉, 孔胜男, 等. 结直肠癌肝转移免疫治疗研究进展[J]. 中国肿瘤临床, 2024, 51(24): 1273-1279.
摘要
肝转移是评估结直肠癌(CRC)患者治疗效果和生存预后的关键影响因素。近年来,免疫疗法通过强化宿主的抗肿瘤免疫反应,已经在多种实体瘤的治疗中展现出良好的潜力,成为转移性或复发性实体瘤治疗的主流选择。基于免疫检查点抑制剂的免疫疗法在CRC治疗中显示出了安全性和有效性的积极进展,尤其是在错配修复缺陷(dMMR)型CRC中表现突出。然而,对于肝转移患者而言,其生存预后的改善尚不明显。本文回顾了免疫治疗在CRC肝转移治疗中的应用策略和疗效,并对其未来的发展方向进行探讨和展望。
前言
根据2024年国家癌症中心最新发布的数据,中国CRC居恶性肿瘤发病率第2位,死亡率居第4位[1]。CRC由于发病隐匿,大多数患者确诊时已中晚期,在疾病进展过程中约50%的患者会发生肝转移,成为CRC患者死亡的主要原因之一。肝脏是CRC患者最常见的转移部位, 15%~25%的患者发生同时性肝转移,18%~25%的患者在初诊后5年内发生异时性肝转移[2]。 对于CRC肝脏寡转移病灶,手术切除、射频消融等局部治疗是主要治疗方式,术后5年生存率约50%[3]。然而,80%~90%的肝转移灶初始无法获得根治性切除。 未经治疗的肝转移患者的中位生存期仅6.9个月,无法行手术切除的患者5年生存率低于5%。 对于CRC肝脏多发转移,目前一线治疗包括靶向治疗、化疗、抗血管生成等联合治疗模式。但肝转移患者的总生存(OS)率并未明显提高,亟需新的治疗策略来改善CRC肝转移(CRLM)患者的生存结局。作为目前预测CRC免疫治疗疗效的最佳生物标志物,微卫星稳定性(MSI)和DNA错配修复(MMR)状态将CRC患者分为两个群体:微卫星高度不稳定/错配修复缺陷(MSI-H/dMMR)型和微卫星稳定/错配修复功能完整(MSS/pMMR)型。MSI-H/dMMR型肿瘤具有较高的肿瘤突变负荷,产生更多的新抗原,从而更有可能被免疫系统识别和攻击。相反,MSS/pMMR型肿瘤突变负荷较低,肿瘤患者疗效有限。鉴于目前免疫治疗在CRC治疗中的广泛应用,本文将针对CRLM的免疫治疗策略进行整理和分析。
01
dMMR/MSI-H型CRC
目前免疫检查点抑制剂(ICIs)在多种恶性肿瘤治疗中均表现出优异的疗效,包括肾癌、黑色素瘤、淋巴瘤等[4]。转移性结直肠癌(mCRC)患者对免疫检查点阻断的反应取决于DNA微卫星不稳定性或MMR状态[5]。ICIs主要在MSI-H/dMMR mCRC患者中有效。MSI-H型CRC是最早被证实ICIs有益的肿瘤之一。 伴有dMMR/MSI-H的CRC具有较高水平的肿瘤突变负荷和淋巴细胞浸润,可诱导肿瘤特异性新抗原招募大量T细胞,对ICIs有良好的响应。
1.1 dMMR/MSI-H型CRC免疫治疗
Ⅱ期 KEYNOTE-16 4[6]研究 证实了帕博利珠单抗在既往经治的dMMR/MSI-H型mCRC患者中的抗肿瘤活性及安全性,其客观缓解率(ORR)达到33%且未发生5级免疫相关不良事件。因此,美国食品药品监督管理局(FDA)于2017年批准帕博利珠单抗用于二线及以上的dMMR/MSI-H型mCRC治疗。多队列Ⅱ期 CheckMate 142研究 评估了纳武利尤单抗单药或联合伊匹木单抗治疗dMMR/MSI-H型mCRC的疗效和安全性。结果表明,单药组ORR为31.1%,12个月OS率为73.4%[7],双药组ORR达到55%,12个月OS率提高至85%,提示在后线治疗中双免联合治疗可获得更高的应答率和生存时间[8](表1)。
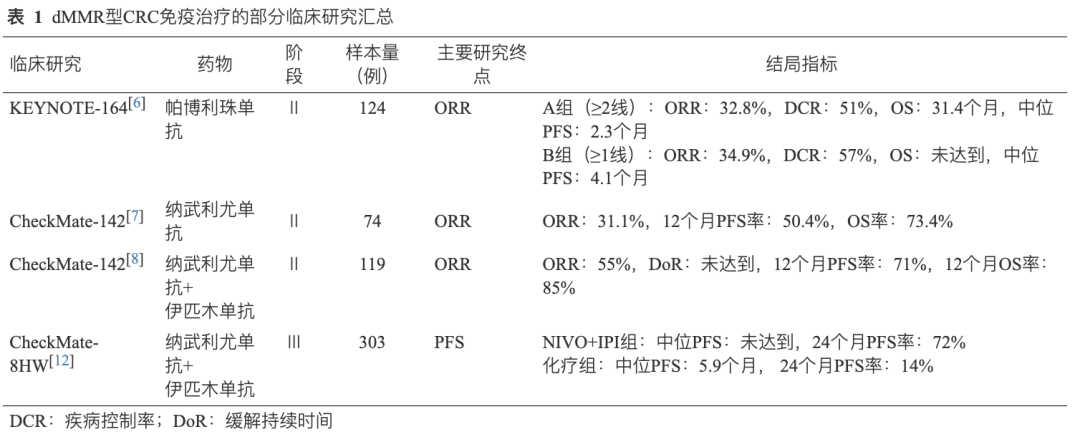
在dMMR/MSI-H 型mCRC中,免疫治疗已从后线跨入一线治疗。2023年欧洲肿瘤内科学会年会(ESMO)上, KEYNOTE-177研究 更新了全人群5年随访结果[9],帕博利珠单抗组和化疗组中位OS分别为77.5个月和36.7个月,5年OS率分别为54.8%和44.2%。帕博利珠单抗在提高疗效的同时降低了毒性,明显改善患者的生存质量[10]。因此,FDA于2021年批准帕博利珠单抗用于dMMR/MSI-H型晚期不可切除或mCRC患者的一线治疗[11]。接受帕博利珠单抗治疗的患者2年和5年无进展生存(PFS)率分别为48%和34%,但仍有大量患者不获益。且与总体研究人群相比,在RAS突变患者中,帕博利珠单抗治疗与化疗相比,PFS获益不显著,仍然存在未满足的临床需求。因此研究者们探索了双免联合策略是否能使一线患者更加获益。Ⅲ期临床研究 CheckMate 8HW 评估纳武利尤单抗联合伊匹木单抗治疗dMMR/MSI-H mCRC患者的初步结果显示[12],与标准治疗相比,双免联合治疗可显著延长PFS,随访24.3个月纳武利尤单抗+伊匹木单抗(NIVO+IPI)组的中位PFS未达到,对照组的中位PFS为5.8个月,疾病进展或死亡风险降低了79%,这一结果不仅具有统计学意义,在临床中也具有深远的积极影响。因此,免疫治疗成为MSI-H/dMMR型mCRC患者一线标准治疗方案,国内外指南也对dMMR/MSI-H型 mCRC的免疫治疗进行了推荐和更新。
1.2 dMMR/MSI-H型CRLM免疫治疗
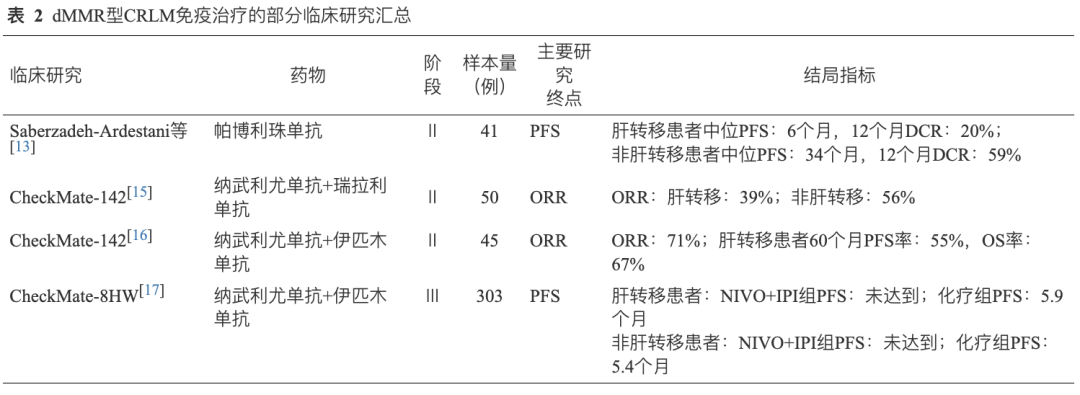
尽管免疫治疗对于dMMR/MSI-H型mCRC疗效显著,然而伴有肝转移的患者却疗效欠佳。 Saberzadeh-Ardestani等[13]研究发现, 接受帕博利珠单抗作为一线治疗的肝转移患者中位PFS为6个月,12个月疾病控制率(DCR)为20%; 而非肝转移的患者中位PFS为34个月,12个月DCR为59%。同时,另一项多中心回顾性研究[14]证实 肝脏转移作为独立因素与dMMR型mCRC免疫治疗较差的应答和生存密切相关 ,mCRC患者在使用帕博利珠单抗治疗后,1年和5年PFS率分别为73%和67%; 亚组合并分析后肝转移患者的中位PFS为6个月, 而非肝转移患者的中位PFS未达到(>72个月);在ICIs完全缓解的患者中,肝转移患者占20%;在疾病进展的患者中,肝转移患者占57%。双免治疗可能有提高肝转移患者的疗效的潜力,Ⅱ期 CheckMate-142研究 中纳武利尤单抗联合瑞拉利单抗治疗既往经治的dMMR/MSI-H型mCRC患者的亚组分析[15]显示, 双免治疗可将肝转移患者ORR提高至39% 。随访64个月[16]观察到ORR获益,包括KRAS、BRAF突变和肝转移患者中位PFS和OS仍未达到。 CheckMate 8HW研究 的扩展分析[17]中, 包括肝转移在内的所有亚组均能从双免治疗中获益 ,与化疗组(PFS为5.9个月)相比,NIVO+IPI组PFS尚未达到(表2)。由此可见,不论是一线还是后线治疗,肝转移的存在对患者生存结局和治疗效果均有影响。 双免联合治疗策略具有提高疗效的潜力,为患者提供了新的治疗选择,尤其对肝转移患者。 未来的研究应进一步探索双免联合治疗在肝转移患者中的应用,以及如何优化治疗方案以提高所有患者的疗效。
另外,本研究将不同种类ICIs对CRLM产生的疗效差异进行分析,得出如下结论 :1)不同的ICIs可能通过影响不同的信号通路来调节肿瘤微环境(TME)中的免疫反应。 如一些ICIs可能通过影响PI3K-AKT、MAPK、JAK-STAT信号通路以及转录因子c-Myc和BRD4来调控PD-L1的表达。这些信号通路的激活或抑制状态可能影响ICIs的疗效。 2)从原发部位到转移部位的免疫微环境显示出动态的细胞和空间变化。 在免疫治疗后,免疫表型在有反应的患者中经历了抗肿瘤重塑,但在无反应的患者中更多的转向免疫抑制[18]。肝转移患者原发灶样本中B细胞及其亚群活化B细胞显著减少,且B细胞及活化B细胞较多的浸润与CRLM患者较好的预后显著相关[19]。 3)肿瘤相关巨噬细胞(TAMs)和调节性T细胞(Tregs)在CRLM中起关键作用,其通过表达PD-L1/2等抑制性受体来维持免疫抑制性微环境。 综上所述,不同ICIs对CRLM的作用差异可能源于其影响的分子信号通路以及对免疫微环境动态变化的影响。这些差异反映了ICIs在分子和细胞层面上的复杂作用机制,以及其在调节肿瘤免疫微环境中的不同角色。
02
pMMR/MSS型CRC
ICIs已成为dMMR/MSI-H型CRC患者的标准治疗方案,但在mCRC中dMMR/MSI-H型患者仅占5%,绝大多数患者为pMMR/MSS。pMMR/MSS型CRC对传统免疫治疗的反应并不理想,尤其是ICIs单药治疗。与dMMR/MSI-H型CRC相比, pMMR/MSS型CRC具有不同的分子发病机制和TME,其肿瘤突变负荷显著低于MSI-H CRC。此外,TME中的免疫抑制和免疫衰竭在pMMR/MSS型CRC中表现得更为突出。
2.1 pMMR/MSS型CRC免疫治疗
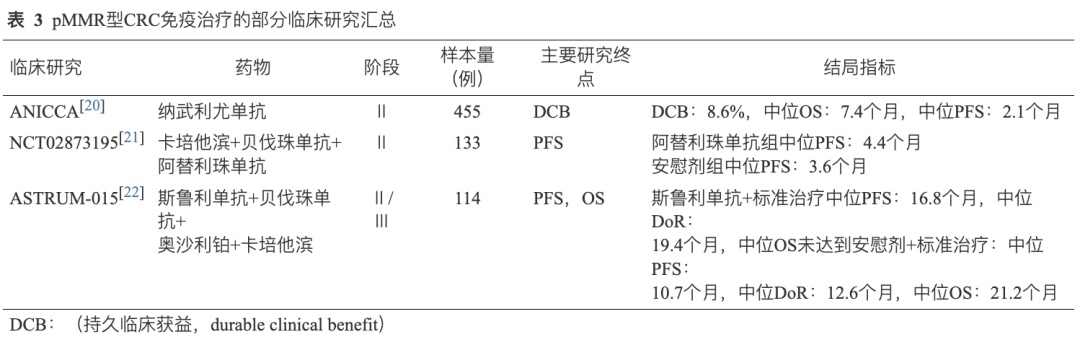
ANICCA Ⅱ期研究中[20],纳武利尤单抗单药治疗MSS型CRC,中位OS仅为7.4个月,中位PFS为2.1个月。因此研究者探索了免疫联合治疗策略在pMMR/MSS型CRC中的疗效。 卡培他滨和贝伐珠单抗联合或不联合阿替利珠单抗[21]治疗难治性mCRC的一项随机临床试验中提示,阿替利珠单抗组中位PFS达到4.4个月,安慰剂组中位PFS为3.6个月。对于MSS型mCRC,免疫联合治疗策略具有一定的治疗效果。基于既往ICIs单药或联合治疗应用于mCRC后线的治疗方案所取得的结果,国内已有研究者尝试将免疫联合标准治疗方案应用于一线治疗mCRC。2024年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)中 ASTRUM-015研究[22]显示,标准治疗联合斯鲁利单抗中位PFS可达16.8个月,中位缓解持续时间(DoR)达19.4个月,中位OS尚未达到,对照组中位PFS为10.7个月,中位DoR为12.6个月,中位OS为21.2个月(表3)。近期,有正在开展的临床研究将免疫治疗联合其他治疗方式应用于MSS型mCRC的围手术期治疗,获得了一定的阳性结果。
2.2 pMMR/MSS型CRLM的免疫治疗
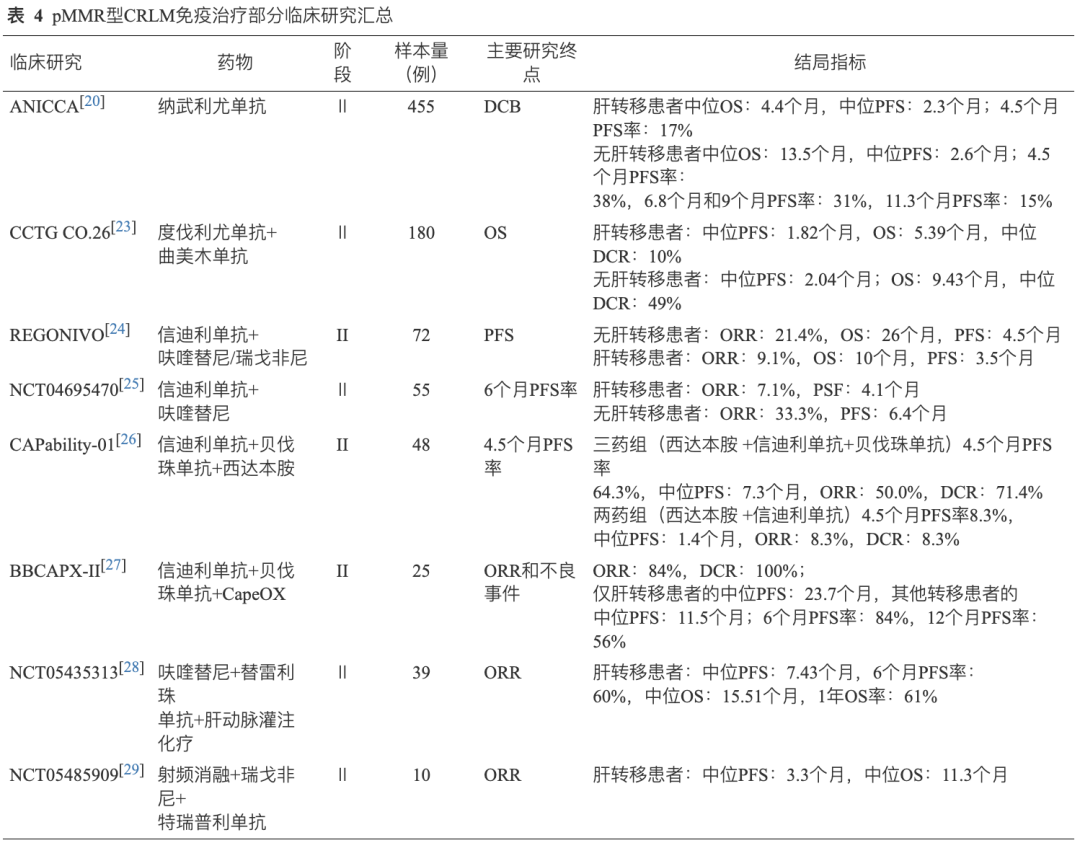
在pMMR/MSS型mCRC中,肝转移是免疫治疗疗效较差的独立预测因素。 纳武利尤单抗单药治疗MSS型mCRC的研究结果显示[20],肝转移患者和非肝转移患者的中位OS分别为4.4个月和13.5个月;4.5个月PFS率分别为17%和38%。Ⅱ期CCTG CO.26研究[23]探讨了晚期MSS型CRLM的存在与ICIs活性之间的关系,结果显示在度伐利尤单抗联合曲美木单抗组患者中,肝转移患者OS为5.39个月,DCR仅为10%;而非肝转移患者OS为9.43个月,DCR为49%。信迪利单抗联合呋喹替尼/瑞戈非尼真实世界研究中显示[24],非肝转移CRC患者ORR显著高于肝转移患者(21.4% vs. 9.1%)。一项单臂、Ⅱ期临床研究[25]探索了呋喹替尼联合信迪利单抗在难治性MSS mCRC中的疗效和有利的安全性特征,结果表明肝转移患者和非肝转移患者的ORR分别为7.1%和33.3%,中位PSF分别为4.1个月和6.4个月。2023年公布的 CAPability-01研究 中[26]肝转移亚组的分析结果显示:26例肝转移患者中,三药组(西达本胺 +信迪利单抗+贝伐珠单抗)的4.5个月PFS率(64.3% vs. 8.3%)优于两药组(西达本胺+信迪利单抗)。基于此, 2024年中国临床肿瘤学会(CSCO)结直肠癌诊疗指南鼓励MSS/pMMR型晚期CRC参加涉及“组蛋白去乙化酶抑制剂+抗VEGF+PD-1抗体”联合方案的临床研究。 2024年ASCO公布 BBCAPX-Ⅱ研究 更新生存结果,信迪利单抗联合标准治疗用于一线治疗RAS突变、MSS、不可切除mCRC显示出良好的抗肿瘤活性和可管理的毒性,与其他转移患者相比,肝转移患者的预后更好,仅肝转移患者PFS为23.7个月,其他转移的患者PFS为11.5个月[27]。目前一项Ⅲ期、随机、开放标签、多中心临床试验(NCT05171660)正在开展,旨在进一步分析该方案的疗效、安全性和预后生物标志物。此外,2024年ASCO报道了免疫+靶向联合局部治疗在CRLM中作用的研究。一项单臂、开放标签、单中心Ⅱ期研究采用呋喹替尼联合替雷利珠单抗和肝动脉灌注化疗治疗晚期CRLM[28],结果显示在35例纳入疗效分析的MSS患者中,中位随访时间为12.52个月,中位PFS为7.43个月,6个月PFS率为60%,中位OS为15.51个月,1年OS率为61%。射频消融(RFA)与免疫治疗联合使用时具有协同疗效,一项RFA联合瑞戈非尼和特瑞普利单抗治疗结CRLM[29]的Ⅱ期研究,入组的10位患者中位PFS为3.3个月,中位OS达到11.3个月,60%的患者至少接受2个周期的治疗。尽管该研究未达到预设的主要终点,但RFA联合瑞戈非尼和特瑞普利单抗可延长CRC肝转移患者的PFS和OS,且安全性特征可接受(表4)。 上述研究提示在pMMR型mCRC患者中,肝转移的存在对免疫治疗的疗效有显著的负面影响,和dMMR型mCRC相同,免疫联合治疗可能改善CRLM预后,成为主要治疗策略。
研究者们通过探索并寻找免疫治疗的最佳组合 ,以激活“冷肿瘤”的免疫效应,逆转免疫微环境的抑制状态。 Tregs、TAMs等免疫抑制细胞在TME中扮演着重要的角色,其通过不同的机制影响肿瘤的免疫逃逸和免疫治疗效果。Tregs通过分泌免疫抑制分子如转化生长因子-β(TGF-β)和白细胞介素-10(IL-10),抑制其他免疫细胞的活性。TAMs在肿瘤微环境中通常呈现M2型表型,其通过分泌Th2细胞因子促进血管生成和肿瘤侵袭,还可以通过在缺氧的微环境下募集FOXP3+Tregs来阻碍T细胞的抗肿瘤效应、促进形成免疫抑制的TME。这些机制共同构成了肿瘤免疫微环境中的免疫抑制网络,其不仅直接促进肿瘤的生长和转移,还通过抑制抗肿瘤免疫反应,降低免疫治疗的效果[30]。因此, 针对免疫抑制细胞的治疗策略,如消耗免疫抑制细胞、阻断免疫检查点途径等,是调节免疫抑制微环境、提高免疫治疗疗效的重要方向。
03
CRLM免疫治疗展望
除了ICIs治疗外,包括癌症疫苗、过继性细胞转移疗法以及溶瘤病毒等免疫治疗方式也成为CRLM的研究热点。
3.1 癌症疫苗
癌症疫苗作为一种主动免疫疗法,通过将免疫系统暴露于肿瘤特异性抗原(TSA)或肿瘤相关抗原(TAA)从而识别和破坏癌细胞,以此来触发抗肿瘤细胞毒性T细胞免疫应答[31]。大多数CRC治疗性癌症疫苗尚处于临床试验阶段。如 OBERTOⅠ/Ⅱ期临床试验评估了PolyPEPI1018在晚期CRC患者维持治疗中的安全性、耐受性和免疫原性。该研究招募11例mCRC患者,早期试验结果显示,PolyPEPI1018的安全性及耐受性良好,患者对多种TAA产生免疫应答,且多次给药能延长PFS[32]。综上所述,癌症疫苗作为一种可行且有前景的治疗方法既能诱导机体产生有效的抗肿瘤免疫反应,又具有不良反应发生概率较小等优势,为mCRC患者提供了新的治疗思路。鉴于不同患者TME具有异质性,对同种疫苗可能产生不同的抗肿瘤免疫应答,因此需要寻找个性化抗原,针对不同癌症亚型分类研发更具个体化的治疗性癌症疫苗。从治疗趋势看, 联合治疗疗效优于单药治疗,癌症疫苗结合放疗、全身化疗以及ICIs的使用可能增加患者对免疫治疗的应答能力、克服免疫抑制、降低不良反应的发生率。
3.2 过继性细胞转移疗法
过继性细胞转移(adoptive cell transfer therapy,ACT)疗法通过体外激活或基因修饰自体或异体免疫细胞,增强其抗肿瘤能力后再输回患者体内,从而提高人体自身免疫系统的抗癌能力[33]。ACT疗法包括 细胞因子诱导的杀伤细胞(CIK)和 嵌合抗原受体(CAR)细胞疗法 [34]。CIK细胞由外周血单个核细胞在体外经多种细胞因子刺激获得,部分患者接受CIK治疗后生活质量有所改善。目前正在进行的NKG 2D CAR-T临床试验(NCT05248048)旨在评估CAR疗法在既往接受过治疗的CRLM患者中的临床可行性和安全性。尽管CAR疗法具有治疗潜力, 但其不良反应如细胞因子释放综合征等仍需进一步研究以优化其在实体瘤治疗中的应用[35]。
3.3 溶瘤病毒疗法
溶瘤病毒疗法是一种新兴的肿瘤免疫疗法, 利用天然或基因修饰的病毒特异性感染和裂解肿瘤细胞,并且具有调节肿瘤免疫微环境的能力,激活抗肿瘤特异性免疫反应[36]。Zhang等[37]在一项前瞻性研究中探讨了溶瘤病毒治疗胃肠道恶性肿瘤肝转移患者的疗效和不良反应的评估,入组的47例肝转移患者经注射溶瘤病毒治疗后进行肝脏MRI检查以评估疾病状态,结果表明,5例患者处于缓解状态,30例疾病稳定,12例疾病进展。将癌胚抗原作为病情监测和疗效评价的指标发现与注射前相比,溶瘤病毒注射后癌胚抗原降低,并在正常范围内波动,术后出现的疼痛、发热、恶心、呕吐等不良反应在对症支持处理后均能在短期内得到缓解。溶瘤病毒的在肿瘤治疗中的应用有望成为继化疗、靶向治疗之后的具有突破性的免疫治疗方法。
04
结语
ICIs已经成为CRC治疗的关键手段,特别是在dMMR/ MSI-H型CRC中。免疫治疗的适应证已从晚期疾病扩展至围手术期治疗。然而,肝转移作为影响CRC患者生存预后的重要因素,也是决定免疫治疗效果的关键,尤其是在pMMR/MSS型CRC中。多种联合治疗策略,如双免疫检查点抑制剂联合、免疫治疗与小分子酪氨酸激酶抑制剂、抗血管生成药物和化疗的联合,以及免疫治疗与局部治疗的结合,已显示出提高CRLM疗效和延长患者生存时间的潜力。尽管如此,临床中仍存在许多未满足的需求,包括如何进一步增强治疗效果、扩大免疫治疗的受益人群,以及寻找能够预测疗效和预后的分子标志物。CRLM的免疫治疗正处于积极探索阶段,预计未来通过整合现有治疗手段和创新疗法,能够实现更佳的临床效果和提升患者的生存获益。
[1]郑荣寿, 陈茹, 韩冰峰, 等.2022年中国恶性肿瘤流行情况分析[J].中华肿瘤杂志,2024,46(3):221-231. DOI: 10.3760/cma.j.cn112152-20240119-00035
[2]Wang H, Li XM, Peng R, et al. Stereotactic ablative radiotherapy for colorectal cancer liver metastasis[J]. Semin Cancer Biol, 2021, 71:21-32. DOI: 10.1016/j.semcancer.2020.06.018
[3]Ma ZH, Wang YP, Zheng WH, et al. Prognostic factors and therapeutic effects of different treatment modalities for colorectal cancer liver metastases[J]. World J Gastrointest Oncol, 2020, 12(10):1177-1194. DOI: 10.4251/wjgo.v12.i10.1177
[4]Wang YX, Zhong XY, He XF, et al. Liver metastasis from colorectal cancer: pathogenetic development, immune landscape of the tumour microenvironment and therapeutic approaches[J]. J Exp Clin Cancer Res, 2023, 42(1):177. DOI: 10.1186/s13046-023-02729-7
[5]Johdi NA, Sukor NF. Colorectal cancer immunotherapy: options and strategies[J]. Front Immunol, 2020, 11:1624. DOI: 10.3389/fimmu.2020.01624
[6]Le DT, Kim TW, van Cutsem E, et al. Phase Ⅱ open-label study of pembrolizumab in treatment-refractory, microsatellite instability-high/mismatch repair-deficient metastatic colorectal cancer: keynote-164[J]. J Clin Oncol, 2020, 38(1):11-19. DOI: 10.1200/JCO.19.02107
[7]Overman MJ, McDermott R, Leach JL, et al. Nivolumab in patients with metastatic DNA mismatch repair-deficient or microsatellite instability-high colorectal cancer (CheckMate 142): an open-label, multicentre, phase 2 study[J]. Lancet Oncol, 2017, 18(9):1182-1191. DOI: 10.1016/S1470-2045(17)30422-9
[8]André T, Lonardi S, Wong KYM, et al. Nivolumab plus low-dose ipilimumab in previously treated patients with microsatellite instability-high/mismatch repair-deficient metastatic colorectal cancer: 4-year follow-up from CheckMate 142[J]. Ann Oncol, 2022, 33(10):1052-1060. DOI: 10.1016/j.annonc.2022.06.008
[9]Yoshino T, André T, Kim TW, et al. LBA7 Pembrolizumab versus chemotherapy in microsatellite instability-high (MSI-H)/mismatch repair-deficient (dMMR) metastatic colorectal cancer (mCRC):5-year follow-up of the KEYNOTE-177 study Asia subgroup[J]. Ann Oncol, 2023, 34:S1502-S1503. DOI: 10.1016/j.annonc.2023.10.223
[10]Diaz LA Jr, Shiu KK, Kim TW, et al. Pembrolizumab versus chemotherapy for microsatellite instability-high or mismatch repair-deficient metastatic colorectal cancer (KEYNOTE-177): final analysis of a randomised, open-label, phase 3 study[J]. Lancet Oncol, 2022, 23(5):659-670. DOI: 10.1016/S1470-2045(22)00197-8
[11]Casak SJ, Marcus L, Fashoyin-Aje L, et al. Fda approval summary: pembrolizumab for the first-line treatment of patients with MSI-H/dMMR advanced unresectable or metastatic colorectal carcinoma[J]. Clin Cancer Res, 2021, 27(17):4680-4684. DOI: 10.1158/1078-0432.CCR-21-0557
[12]Andre T, Elez E, Van Cutsem E, et al. Nivolumab (NIVO) plus ipilimumab (IPI) vs chemotherapy (chemo) as first-line (1L) treatment for microsatellite instability-high/mismatch repair-deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC): First results of the CheckMate 8HW study[J]. J Clin Oncol, 2024, 42(suppl_3):LBA768.
[13]Saberzadeh-Ardestani B, Jones JC, Hubbard JM, et al. Association between survival and metastatic site in mismatch repair-deficient metastatic colorectal cancer treated with first-line pembrolizumab[J]. JAMA Netw Open, 2023, 6(2):e230400. DOI: 10.1001/jamanetworkopen.2023.0400
[14]Saberzadeh-Ardestani B, Jones JC, McWilliams RR, et al. Metastatic site and clinical outcome of patients with deficient mismatch repair metastatic colorectal cancer treated with an immune checkpoint inhibitor in the first-line setting[J]. Eur J Cancer, 2024, 196:113433. DOI: 10.1016/j.ejca.2023.113433
[15]Overman MJ, Gelsomino F, Aglietta M, et al. Nivolumab plus relatlimab in patients with previously treated microsatellite instability-high/mismatch repair-deficient metastatic colorectal cancer: the phase Ⅱ CheckMate 142 study[J]. J Immunother Cancer, 2024, 12(5):e008689. DOI: 10.1136/jitc-2023-008689
[16]Overman MJ, Lenz HJ, Van Cutsem E, et al. Nivolumab (NIVO) ± ipilimumab (IPI) in patients (pts) with microsatellite instability-high/mismatch repair-deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC): Five-year follow-up from CheckMate 142[J]. J Clin Oncol, 2022, 40(suppl_16):3510-3510.
[17]Lenz HJ, Lonardi S, Elez E, et al. Nivolumab (NIVO) plus ipilimumab (IPI) vs chemotherapy (chemo) as first-line (1L) treatment for microsatellite instability-high/mismatch repair-deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC): Expanded efficacy analysis from CheckMate 8HW[J]. J Clin Oncol, 2024, 42(suppl_16):3503.
[18]Wu YC, Yang SX, Ma JQ, et al. Spatiotemporal immune landscape of colorectal cancer liver metastasis at single-cell level[J]. Cancer Discov, 2022, 12(1):134-153. DOI: 10.1158/2159-8290.CD-21-0316
[19]Xu YQ, Wei Z, Feng M, et al. Tumor-infiltrated activated B cells suppress liver metastasis of colorectal cancers[J]. Cell Rep, 2022, 40(9):111295. DOI: 10.1016/j.celrep.2022.111295
[20]Middleton G, Liu W, Savage J, et al. 426P Assessing nivolumab in class Ⅱ expressing microsatellite stable (pMMR) colorectal cancer (CRC): Results of the ANICCA-Class Ⅱ trial[J]. Ann Oncol, 2022, 33:S729-S730.
[21]Mettu NB, Ou FS, Zemla TJ, et al. Assessment of capecitabine and bevacizumab with or without atezolizumab for the treatment of refractory metastatic colorectal cancer: a randomized clinical trial[J]. JAMA Netw Open, 2022, 5(2):e2149040. DOI: 10.1001/jamanetworkopen.2021.49040
[22]Xu RH, Wang F, Peng JJ, et al. First-line serplulimab plus HLX04 and XELOX versus placebo plus bevacizumab and XELOX in metastatic colorectal cancer: a phase 2/3 study[J]. J Clin Oncol, 2024, 42(suppl_3):124.
[23]Chen EX, Jonker DJ, Loree JM, et al. Effect of combined immune checkpoint inhibition vs best supportive care alone in patients with advanced colorectal cancer: the Canadian cancer trials group CO.26 study[J]. JAMA Oncol, 2020, 6(6):831-838. DOI: 10.1001/jamaoncol.2020.0910
[24]Nie CY, Lv HF, Chen BB, et al. Microsatellite stable metastatic colorectal cancer without liver metastasis may be preferred population for regorafenib or fruquintinib plus sintilimab as third-line or above therapy: a real-world study[J]. Front Oncol, 2022, 12:917353. DOI: 10.3389/fonc.2022.917353
[25]Zhang W, Sun Y, Jiang Z, et al. 423P Fruquintinib plus sintilimab in refractory repair-proficient (pMMR)/microsatellite stable (MSS) metastatic colorectal cancer (mCRC): Preliminary clinical results and biomarker analyses from a phase Ⅱ study[J]. Ann Oncol, 2022, 33:S728.
[26]Wang F, Jin Y, Wang M, et al. Combined anti-PD-1, HDAC inhibitor and anti-VEGF for MSS/pMMR colorectal cancer: a randomized phase 2 trial[J]. Nat Med, 2024, 30(4):1035-1043. DOI: 10.1038/s41591-024-02813-1
[27]Yuan Y, Zhu N, Fang XF, et al. Updated survival results of BBCAPX-II: Sintilimab combined with bevacizumab and CapeOx as first-line treatment in patients with RAS-mutant, microsatellite stable, unresectable metastatic colorectal cancer[J]. J Clin Oncol, 2024, 42(suppl_16):3563.
[28]Wang L, Zhang T, Pan Q, et al. A phase II study to evaluate the efficacy and safety of fruquintinib combined with tislelizumab and hepatic artery infusion chemotherapy (HAIC) for advanced colorectal cancer liver metastases: an updated analysis of survival[J]. J Clin Oncol, 2024, 42(suppl_16):3543.
[29]Wang ZQ, Ouyang H, Luo HY, et al. A phase II clinical evaluation of radiofrequency ablation (RFA) combined with regorafenib and toripalimab in patients with colorectal cancer with liver metastases[J]. J Clin Oncol, 2024, 42(suppl_16):3566.
[30]张烨晟,杨易静,黄依雯,等.肿瘤微环境免疫细胞调节肿瘤细胞耐药性的研究进展[J].上海交通大学学报(医学版),2024,44(7):830-838.
[31]Liu N, Xiao XY, Zhang ZQ, et al. Advances in cancer vaccine research[J]. ACS Biomater Sci Eng, 2023, 9(11):5999-6023. DOI: 10.1021/acsbiomaterials.3c01154
[32]Hubbard JM, Tőke ER, Moretto R, et al. Safety and activity of PolyPEPI1018 combined with maintenance therapy in metastatic colorectal cancer: an open-label, multicenter, phase Ⅰb study[J]. Clin Cancer Res, 2022, 28(13):2818-2829. DOI: 10.1158/1078-0432.CCR-22-0112
[33]Yu I, Dakwar A, Takabe K. Immunotherapy: recent advances and its future as a neoadjuvant, adjuvant, and primary treatment in colorectal cancer[J]. Cells, 2023, 12(2):258. DOI: 10.3390/cells12020258
[34]Sumransub N, Vantanasiri K, Prakash A, et al. Advances and new frontiers for immunotherapy in colorectal cancer: Setting the stage for neoadjuvant success[J]? Mol Ther Oncolytics, 2021, 22:1-12. DOI: 10.1016/j.omto.2021.05.001
[35]Adkins S. CAR T-cell therapy: adverse events and management[J]. J Adv Pract Oncol, 2019, 10(Suppl 3):21-28.
[36]Zeng JY, Li XX, Sander M, et al. Oncolytic viro-immunotherapy: an emerging option in the treatment of gliomas[J]. Front Immunol, 2021, 12:721830. DOI: 10.3389/fimmu.2021.721830
[37]Zhang J, He QY, Mao DL, et al. Efficacy and adverse reaction management of oncolytic viral intervention combined with chemotherapy in patients with liver metastasis of gastrointestinal malignancy[J]. Front Oncol, 2023, 13:1159802. DOI: 10.3389/fonc.2023.1159802
排版编辑:肿瘤资讯-古木











 苏公网安备32059002004080号
苏公网安备32059002004080号


