摘要
胃癌是消化系统最常见的恶性肿瘤之一。人表皮生长因子受体2(HER2)是胃癌治疗的重要靶点。近年来,抗HER2治疗药物在胃癌治疗中取得突破性进展,为胃癌患者提供了更多的治疗选择。为了更好地指导临床合理、有效、安全地应用抗HER2治疗药物,中国抗癌协会胃癌专业委员会组织国内胃癌领域专家进行多轮讨论,系统汇总国内外循证医学证据,并结合中国临床实际,从晚期治疗、围术期治疗、转化治疗和治疗期间需重点关注的问题等方面制订了《胃癌抗HER2治疗中国专家共识(2024年版)》,旨在进一步规范和指导胃癌抗HER2治疗临床实践。
前言
胃癌是全球最常见的消化道恶性肿瘤之一,根据2022年最新数据统计,胃癌新发病与死亡病例数在全球恶性肿瘤中均居第5位[1];中国胃癌年新发病例约36万例,年死亡病例约26万例,分别位居国内恶性肿瘤发病率和死亡率的第5位和第3位[2]。我国胃癌早期筛查尚未全面普及,大多数胃癌患者在发现时已是进展期,整体预后较差,5年生存率仅35.2%[3]。HER2是胃癌治疗的重要靶点。大型国际多中心HER-EAGLE研究显示,胃癌全球HER2阳性[免疫组织化学(IHC)3+或IHC2+且原位杂交(ISH)阳性]率约为10%~20%[4]。中国胃癌HER2阳性率约为12%~13%[5-6]。另一项国内多中心回顾性研究(HERGC研究)[7],对40 842例胃腺癌样本检测,结果显示HER2阳性率为8.8%(ISH送检率低)。《中国抗癌协会(CACA)胃癌整合诊治指南》[8]《中国临床肿瘤学会(CSCO)胃癌诊疗指南》[9]《胃癌HER2检测指南》[10]等均推荐所有经病理诊断证实为胃腺癌的病例均有必要进行HER2检测,这对于筛选潜在抗HER2治疗获益人群具有重要的临床意义。
HER2表达状态能否作为胃癌的独立预后因素仍存在争议。多项研究结果显示,HER2阳性是可手术胃癌人群不良预后因素。日本一项多中心研究显示对于可手术的胃癌患者(n=1 148),HER2阳性是独立预后不良因素[11]。国内一项回顾性研究纳入218例接受根治性胃癌切除术(R0)的患者,结果显示HER2阳性与胃癌患者总生存呈负相关[12]。国内另一项回顾性研究,纳入678例接受根治性手术的胃癌患者,HER2表达患者总生存显著低于HER2未表达患者[13]。一项Meta分析结果显示,针对可手术胃癌人群,HER2阳性是不良生存预后因素[14]。此外,国内一项回顾性研究表明HER2阴性肠型胃癌患者生存预后最佳,HER2阳性弥漫型胃癌患者生存预后最差,HER2状态联合Lauren分型可作为胃癌的独立预后因素[15]。日本的一项回顾性研究纳入734例晚期胃癌患者,发现HER2阳性晚期胃癌患者生存预后明显好于HER2表达阴性(IHC 0)患者,HER2低表达(IHC1+或2+/ISH-)晚期胃癌患者生存预后与HER2表达阴性(IHC 0)患者相似[16]。因此,尚不能确立HER2表达状态能否作为胃癌的独立预后因素,不同HER2表达状态对不同分期和组织学分型患者的预后可能存在不同的影响。
2010年,ToGA研究在HER2阳性晚期胃癌中获得成功,开启胃癌靶向治疗时代[17],曲妥珠单抗联合化疗成为HER2阳性晚期胃癌的标准一线治疗方案。然而,此后针对HER2阳性胃癌的药物如帕妥珠单抗、小分子酪氨酸激酶抑制剂(TKI)拉帕替尼、抗体偶联药物(ADC)恩美曲妥珠单抗等均以失败告终[18],亟需进一步探索新型治疗模式。近年来,随着抗肿瘤新药临床研究的不断推进,维迪西妥单抗[19]、德曲妥珠单抗[20]等新型ADC药物上市以及KEYNOTE-811研究[21]的成功,为晚期胃癌的治疗带来了新的治疗选择。此外,国内首个自主研发的ADC药物维迪西妥单抗拓展了晚期胃癌抗HER2治疗获益人群,由传统的HER2阳性(IHC3+或IHC2+/ISH+)人群,拓展为HER2阳性(IHC3+或2+/ISH+)及IHC2+/ISH-人群[19]。针对局部进展期胃癌的围手术期抗HER2治疗探索也初步呈现良好的应用前景。随着胃癌抗HER2治疗新的研究数据不断积累和充实,新的循证证据需要进一步总结,临床面临的争议及难点问题仍需指导意见。为此,中国抗癌协会胃癌专业委员会组织国内胃癌领域专家进行多轮深入讨论,基于现有循证医学证据,并结合国内实际,从晚期治疗、围术期治疗、转化治疗以及治疗期间需重点关注的问题等方面制订了《胃癌抗HER2治疗中国专家共识(2024年版)》(以下简称“共识”),以期进一步规范和指导胃癌抗HER2治疗临床实践。
本共识采用定量系统评价证据分级工具(GRADE)标准对证据进行分级(表1)。采用国际通行的Delphi方法组织专家投票,达成相关推荐意见。投票表决分为6级:完全同意(100%)、基本同意(80%)、部分同意(60%)、部分反对(40%)、较多反对(20%)和完全反对(0),经专家投票表决,修订达成相关推荐意见。推荐等级根据专家投票分为强推荐和弱推荐两个级别:投票表决为“完全同意(100%)”的票数超过80%,为强推荐;“完全同意(100%)”+“基本同意(80%)”票数超过80%,为弱推荐。

01
晚期胃癌一线抗HER2治疗
自ToGA研究以后,曲妥珠单抗联合化疗成为HER2阳性晚期胃癌一线标准治疗。近年来,随着KEYNOTE-811研究的成功,靶向、免疫和化疗的联合治疗成为细胞程序性死亡-配体1 (PD-L1)综合阳性评分(CPS)≥1分的HER2阳性晚期胃癌治疗的标准治疗。基于此,国内胃癌指南对HER2阳性晚期胃癌一线治疗人群分层及方案进行更新优化。对于PD-L1 CPS≥1分的患者,治疗推荐为帕博利珠单抗+曲妥珠单抗+化疗;对于PD-L1 CPS<1分的患者,治疗推荐为曲妥珠单抗+化疗。此外,靶向HER2的新型药物如ADC、双抗、单抗等在一线治疗中不断探索,初步显示出较好的疗效,有望进一步丰富晚期胃癌一线抗HER2治疗选择。
推荐意见1:基于KEYNOTE-811研究,对于PD-L1 CPS≥1分的HER2阳性(IHC3+或2+/ISH+)晚期胃癌患者,一线治疗优先推荐帕博利珠单抗联合曲妥珠单抗和化疗方案(证据等级:高;推荐级别:强推荐;专家组赞同率:完全同意90%,基本同意8%)
既往韩国一项单臂、多中心Ib/Ⅱ期PANTHERA研究结果显示,帕博利珠单抗联合曲妥珠单抗和化疗一线治疗HER2阳性晚期胃癌的中位总生存期(OS)和中位无进展生存期(PFS)分别为19.3个月和8.6个月,客观缓解率(ORR)为76.7%[22]。另一项由美国发起的开放标签、单臂、Ⅱ期研究结果显示,帕博利珠单抗联合曲妥珠单抗和化疗一线治疗HER2阳性转移性胃食管癌(胃癌、食管癌和胃食管结合部癌)的中位OS和中位PFS分别为27.3个月和13.0个月,ORR为91%[23]。2024年欧洲肿瘤内科学会(ESMO)年会报道了Ⅲ期KEYNOTE-811研究的更新结果,该研究纳入698例未经治疗的HER2阳性不可切除或转移性胃癌和胃食管结合部癌(G/GEJC)患者,中位随访时间为50.2个月后,在最终分析中,与曲妥珠单抗联合化疗组相比,帕博利珠单抗联合曲妥珠单抗和化疗组可显著延长患者中位OS(20.0个月vs. 16.8个月,HR=0.80,95%CI:0.67~0.94,P=0.004),差异具有统计学意义。对于PD-L1 CPS ≥1分的患者,帕博利珠单抗联合曲妥珠单抗和化疗组中位OS延长(20.1个月vs. 15.7个月,HR=0.79,95%CI:0.66~0.95)。在最终分析时,更新的两组中位PFS分别为为10.0个月和8.1个月(HR=0.73,95%CI:0.61~0.87),对于PD-L1 CPS ≥1分的患者两组中位PFS分别为10.9个月和7.3个月(HR=0.72,95%CI:0.60~0.87)。整体人群ORR提高了12.5%(72.6% vs. 60.1%),对于PD-L1 CPS ≥1分的患者两组ORR分别为73.2%和58.4%[24]。但是对于PD-L1 CPS<1分的患者,难以从帕博利珠单抗联合曲妥珠单抗和化疗中获益,分析结果显示,两组中位OS分别为18.2个月和20.4个月(HR=1.10,95%CI:0.72~1.68),反而劣于对照组;两组中位PFS分别为9.5个月和9.5个月(HR=0.99,95%CI:0.62~1.56),两组ORR分别为69.2%和69.2%,均无显著性差异[21]。国内一项回顾性真实世界队列研究[25]纳入106例HER2阳性、PD-L1 CPS<1分的晚期胃癌患者,一组接受抗HER2治疗联合化疗治疗,另一组接受抗HER2治疗联合化疗及免疫治疗。结果显示,两组间中位PFS及OS无显著性差异,联合免疫后未能改善生存,与KEYNOTE-811研究报道结果相一致。基于此,2024年6月中国国家药品监督管理局(NMPA)批准帕博利珠单抗联合曲妥珠单抗、含氟尿嘧啶类和铂类药物化疗,用于经充分验证的检测评估肿瘤表达PD-L1(CPS≥1分)的局部晚期不可切除或转移性HER2阳性G/GEJC患者的一线治疗。
推荐意见2:对于PD-L1 CPS<1分的HER2阳性(IHC3+或2+/ISH+)晚期胃癌患者,一线治疗优先推荐曲妥珠单抗联合化疗(证据等级:高;推荐级别:强推荐;专家组赞同率:完全同意90%,基本同意10%)
推荐意见3:曲妥珠单抗生物类似药于国内已获批多款,在临床实践中可以替代使用(证据等级:高;推荐级别:弱推荐;专家组赞同率:完全同意56%,基本同意36%)
ToGA研究是首个评估曲妥珠单抗一线治疗HER2阳性胃癌的大型Ⅲ期临床研究。该研究结果显示,与单纯化疗相比,曲妥珠单抗联合5-氟尿嘧啶(5-FU)/卡培他滨+顺铂可显著延长HER2 IHC3+或荧光原位杂交阳性(FISH+)的晚期转移性胃癌患者的中位OS(13.8个月vs. 11.1个月,HR=0.74,95%CI:0.60~0.91,P=0.004 6)和中位PFS(6.7个月vs. 5.5个月,HR=0.71,95%CI:0.59~0.85,P=0.000 2),改善ORR(47% vs. 35%,P=0.001 7)[17]。亚组分析结果显示,在HER2阳性(IHC3+或2+/FISH+)亚组,曲妥珠单抗联合化疗组的中位OS为16.0个月,单纯化疗组为11.8个月(HR=0.65,95%CI:0.51~0.83)。此外,一项国内多中心、前瞻性、非干预性真实世界登记研究(EVIDENCE)结果进一步证实中国人群接受曲妥珠单抗治疗的疗效与安全性。在倾向评分匹配后,与未接受曲妥珠单抗治疗的HER2阳性胃癌患者相比,接受曲妥珠单抗治疗HER2阳性胃癌患者的中位OS显著延长(24.1个月 vs. 17.2个月,P=0.0248),中位PFS也显著延长(7.5个月vs. 6.9个月,P=0.013 6)[26]。
生物类似药是指质量、安全性和疗效方面与已获批的原研药具有相似性的治疗用生物制品。2020年国内已有共识[27]明确认可生物类似药的临床替代。目前,曲妥珠单抗生物类似药国内已获批多款(如汉曲优、安赛汀、赛妥、安瑞泽、安曲妥等),并经过Ⅲ期临床研究验证与原研药曲妥珠单抗具有相似疗效及安全性。因此,曲妥珠单抗生物类似药可按照获批的说明书用于HER2阳性胃癌治疗,在一定程度上可提高药品的可及性。
推荐意见4:对于HER2阳性(IHC3+或2+/ISH+)或IHC2+/ISH-的晚期一线胃癌患者,在临床研究的背景下,可以考虑使用新型ADC药物联合免疫和化疗治疗方案(证据等级:低;推荐级别:弱推荐;专家组赞同率:完全同意40%,基本同意46%)
维迪西妥单抗作为一种新型ADC药物,通过抗体将细胞毒素靶向递送至肿瘤细胞,从而发挥抗肿瘤作用。既往研究发现ADC联合免疫检查点抑制剂存在协同作用机制:ADC药物可诱导免疫原性细胞死亡(ICD),促进树突状细胞成熟,上调MHC-1表达,增加免疫细胞浸润,抑制免疫负调控调节性T细胞(Tregs)细胞活性,引起抗体依赖的细胞介导的细胞毒性作用和促进免疫记忆形成等[28-29]。2024年美国临床肿瘤学会(ASCO)大会上口头报道了一项维迪西妥单抗联合替雷利珠单抗和S-1一线治疗HER2过表达(IHC3+或IHC2+)晚期胃癌的单臂、多中心、Ⅱ期研究(RCTS研究)结果,该研究纳入国内9家分中心的53例HER2过表达的晚期胃癌患者,其中58.5%的患者CPS<1分。结果发现,维迪西妥单抗联合替雷利珠单抗和S-1一线治疗研究者评估的ORR为94.3%,疾病控制率(DCR)为98.1%;确认的ORR为90.9%、DCR为97.7%。中位随访6.7个月,中位PFS和中位OS尚未成熟,1年PFS率为71.8%,1年OS率为97.6%。亚组分析结果显示IHC2+/ISH-亚组或PD-L1低表达(CPS<1分)人群同样获益,IHC2+/ISH-亚组和HER2阳性亚组ORR分别为83.3%和95.7%,9个月PFS率分别为55.6%和70.9%;PD-L1 CPS<1分亚组和 CPS≥1分亚组ORR分别为93.5%和95.2%,1年PFS率分别为65.8%和75.0%。3级及以上不良事件(AE)发生率为52.8%,整体安全性良好,可防可控[30]。此外,维迪西妥单抗联合特瑞普利单抗及化疗或曲妥珠单抗一线治疗HER2表达局部晚期或转移性胃癌的Ⅱ/Ⅲ期注册临床研究(RC48-C027)正在开展中[31]。2024年ESMO报道了德曲妥珠单抗(T-DXd)在胃癌一线探索性Ib/Ⅱ期DESTINY-Gastric03研究结果[32],显示对照组曲妥珠单抗联合化疗ORR为76%,中位PFS为12个月,中位OS为18个月;T-DXd单药组ORR为49%,中位PFS为9个月,中位OS为18个月;T-DXd联合5-FU或卡培他滨组ORR为78%,中位PFS为20个月,中位OS为23个月;T-DXd联合帕博利珠单抗组ORR为63%,中位PFS为8个月,中位OS为16个月;T-DXd联合氟尿嘧啶类(5-FU或卡培他滨)及帕博利珠单抗一线治疗HER2阳性晚期胃癌初步呈现出良好的疗效,ORR为58%,中位PFS为10个月,中位OS为23个月,CPS≥1分组获益更为明显,但是T-DXd 6.4mg/kg剂量下存在较高的毒性,3级以上AE发生率为91%,间质性肺病(ILD)/肺炎发生率为19%,导致停药AE发生率为51%。T-DXd 5.4 mg/kg联合减量氟尿嘧啶和帕博利珠单抗队列仍在探索中。
随着新药研发的不断加快,靶向HER2双特异性抗体以及新型单抗在晚期胃癌一线探索中均显示出较大的潜力。ZW25是一种双特异性抗体,可以同时靶向HER2的胞外结构域(ECD)4和ECD2两个表位。一项Ib/Ⅱ期研究结果显示,ZW25联合替雷利珠单抗和CAPOX(卡培他滨+奥沙利铂)一线治疗HER2阳性晚期胃癌的确认的ORR为75.8%,DCR为100%,中位PFS为16.7个月[33]。KN026是另一种新型靶向HER2双特异性抗体,KN046是一种新型的PD-L1/CTLA-4双特异性抗体。Ⅱ期KN026-203研究结果显示,KN026联合KN046一线治疗HER2阳性胃癌患者的ORR为77.8%,DCR为92.6%[34],提示HER2阳性晚期胃癌一线“去化疗”的可能性。HLX22是一种靶向HER2的新型单克隆抗体,其与HER2的ECD4结合,但与曲妥珠单抗结合的表位不同,HLX02为曲妥珠单抗生物类似药。2024年欧洲肿瘤内科学会胃肠肿瘤年会(ESMO GI)大会报道了其Ⅱ期研究结果,该研究显示,与HLX02+XELOX组相比,HLX22(25 mg/kg)+HLX02+XELOX组以及HLX22(15mg/kg)+HLX02+和XELOX组一线治疗的中位PFS延长,分别为13.7个月、尚未达到和8.2个月,ORR分别为77.8%、82.4%和88.9%[35]。研究结果表明HLX22联合HLX02和XELOX一线治疗HER2阳性胃癌有效,且安全性可控。但上述药物仍需进一步的证据支持,目前未在中国获批。晚期胃癌一线抗HER2治疗临床研究及其主要数据汇总见表2。
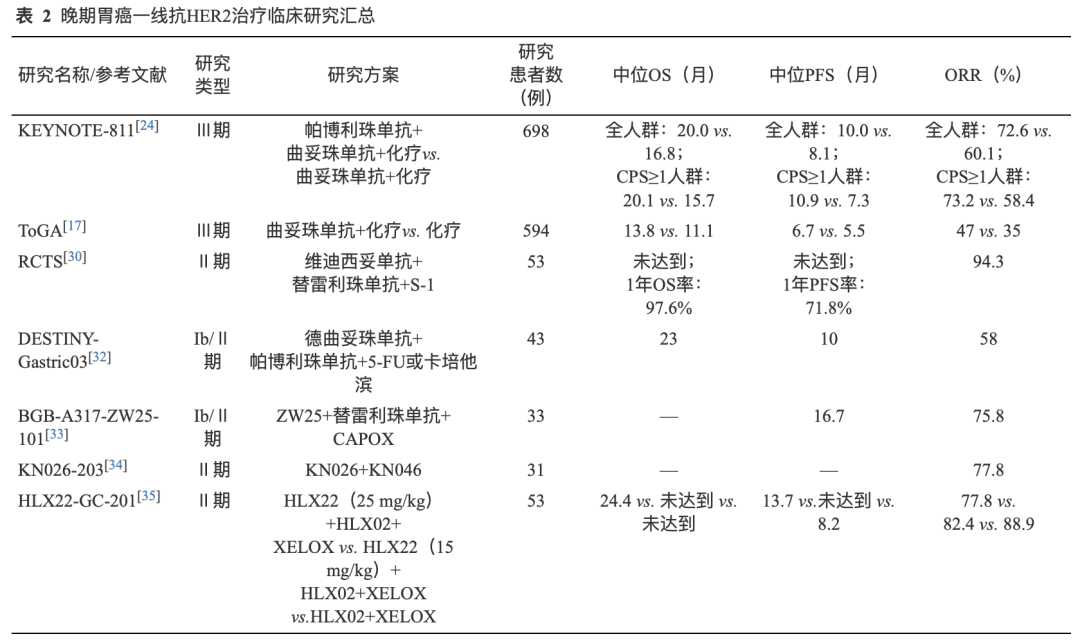
02
晚期胃癌二线抗HER2治疗
一线抗HER2治疗后进展的晚期胃癌患者缺乏有效的二线抗HER2标准治疗方案。曲妥珠单抗一线抗HER2治疗疗效较佳,但出现疾病进展后,二线曲妥珠单抗跨线治疗存在争议,缺乏高级别循证医学证据。曲妥珠单抗治疗后耐药机制复杂,可能包括:PI3K/AKT信号通路及其相关基因或蛋白的激活;其他通路或轴的激活;酪氨酸激酶家族成员过表达与突变;代谢重编程;miRs(一类小型的非编码RNA分子)过表达;HER2过表达的丢失和某些蛋白质的过表达等[36]。因此,亟需新的解决策略以克服曲妥珠单抗耐药。近年来,新一代抗HER2 ADC药物凭借其独特精准靶向作用机制,在晚期胃癌二线治疗领域积极探索,有望成为晚期胃癌二线治疗新标准。其他新型的双特异性抗体和小分子TKI药物也在HER2阳性胃癌二线治疗中显示出较好的初步疗效,尚需进一步探索。
推荐意见5:对于HER2阳性(IHC3+或2+/ISH+)的晚期胃癌患者,一线应用曲妥珠单抗进展后的二线治疗,不推荐继续跨线给予曲妥珠单抗治疗,建议重新活检明确HER2状态,以决定后续治疗策略(证据等级:中;推荐级别:弱推荐;专家组赞同率:完全同意74%,基本同意24%)
在HER2阳性晚期胃癌的一线化疗基础上联合曲妥珠单抗可显著改善缓解率和生存。然而,二线治疗是否可以继续给予曲妥珠单抗跨线治疗仍存在争议,缺乏高级别循证医学证据。法国一项回顾性研究[37],纳入104例经过一线曲妥珠单抗联合化疗治疗进展后的HER2阳性胃癌患者,二线治疗结果显示,与化疗相比,曲妥珠单抗跨线治疗组ORR(16.7% vs. 5.4%,P=0.08)、PFS(4.4个月vs. 2.3个月,P=0.002)和OS(12.6个月vs. 6.1个月,P=0.001)均有改善。国内一项单中心回顾性研究[38]分析了56例HER2阳性晚期胃癌一线含曲妥珠单抗治疗进展后的患者二线治疗疗效,结果发现,曲妥珠单抗跨线治疗组与未跨线治疗组相比,PFS(6.0个月vs. 3.5个月,P=0.038)和OS(12.3个月vs. 9.0个月,P=0.008)显著延长,两组ORR无显著性差异(23.3% vs. 15.4%)。韩国一项多中心Ib/Ⅱ期研究(HER-RAM研究)探索曲妥珠单抗+雷莫西尤单抗+紫杉醇二线治疗HER2阳性晚期GC/GEJC疗效及安全性[39],纳入50例既往曲妥珠单抗经治的患者,结果发现ORR为54%,中位PFS为7.1个月,中位OS为13.6个月,3/4级治疗相关不良事件发生率(TRAEs)发生率为70%,提示联合抗血管生成药物雷莫西尤单抗和紫杉醇进行曲妥珠单抗跨线治疗可能存在临床获益,但仍需进一步的前瞻性随机对照研究证实。T-ACT研究(WJOG7112G)是由日本发起的一项开放标签、随机Ⅱ期研究,该研究旨在评估HER2阳性晚期G/GEJC进展后持续使用曲妥珠单抗的疗效。结果显示,与单纯化疗组相比,曲妥珠单抗联合化疗组并未延长中位PFS(3.7个月vs. 3.2个月,HR=0.91,80%CI:0.67~1.22;P=0.33)、中位OS(10.2个月vs. 10.0个月,HR=1.23,95%CI:0.76~1.99;P=0.20),亦未能提高ORR(33% vs. 32%,P=1.00)和DCR(62% vs. 71%,P=0.47)[40]。日本一项回顾性分析结果显示,曲妥珠单抗联合化疗一线治疗HER2阳性晚期胃癌患者出现疾病进展后,继续接受曲妥珠单抗相较于停止使用曲妥珠单抗治疗的中位OS(10.8个月vs. 9.5个月,HR=1.06;P=0.88)、中位PFS(4.0个月vs. 2.3个月,HR=0.63;P=0.14)和ORR(18.2% vs. 15.8%,P=1.00)无显著性差异[41]。日本另一项回顾性研究结果同样证实曲妥珠单抗跨线治疗HER2阳性胃癌无显著临床获益,曲妥珠单抗联合紫杉醇相较于单用紫杉醇的中位OS分别为10.8个月和6.1个月(P=0.268)、中位PFS分别为5.0个月和2.8个月(P=0.244)、ORR分别为25%和12.5%(P=0.466)[42]。国内一项多中心回顾性研究将HER2阳性晚期胃癌一线曲妥珠单抗联合化疗进展后的患者分成曲妥珠单抗跨线治疗组和单纯化疗组[43],结果发现,与单纯化疗组相比,曲妥珠单抗跨线治疗后的中位PFS延长(3.1个月vs. 2.0个月,P=0.008),但是两组中位OS显著性差异(10.5个月vs. 6.5个月,P=0.172)。上述研究多以回顾性研究为主,数据有限且不一致,目前不足以支持曲妥珠单抗跨线治疗。
推荐意见6:对于HER2阳性(IHC3+或2+/ISH+)或IHC2+/ISH-的晚期胃癌患者,在临床研究的背景下,二线治疗可以考虑新型ADC药物治疗(证据等级:低;推荐级别:弱推荐;专家组赞同率:完全同意58%,基本同意34%)
ADC药物作为二线治疗可能会为HER2阳性的晚期胃癌患者带来生存获益。2024年一项多中心、开放标签、剂量递增和扩展I期C013研究结果发表。该研究是目前发表的首个针对HER2阳性和HER2低表达(IHC2+/ISH-或1+)晚期胃癌的ADC药物联合免疫的临床研究,纳入了来自中国三家中心的56例HER2阳性和HER2低表达的G/GEJC和其他实体瘤患者,既往未接受过PD-1/PD-L1单抗治疗,旨在评估维迪西妥单抗联合特瑞普利单抗二线及以上治疗的疗效和安全性。结果显示,在HER2阳性G/GEJC人群中,中位PFS为7.8个月,ORR为56%,中位OS的数据尚未成熟,进一步证实了靶向HER2-ADC与PD-1抑制剂之间潜在的协同作用[44]。2024年ESMO GI公布的一项多中心、真实世界研究纳入了36例维迪西妥单抗联合PD-1抑制剂治疗经治的HER2过表达(IHC3+或2+)晚期G/GEJC患者,其中联合治疗组83%的患者既往前线治疗接受过免疫治疗。结果显示,维迪西妥单抗联合PD-1抑制剂组的中位OS为13.2个月,中位PFS为5.8个月,ORR为41.7%[45]。亚组分析显示既往接受过免疫治疗后维迪西妥单抗联合免疫二线及以上治疗仍然有效(既往接受免疫治疗相较于未接受免疫治疗的ORR分别为40%和50%)。因此,真实临床实践中,维迪西妥单抗联合免疫二线及以上治疗疗效及安全性得到进一步验证。一项单臂、Ⅱ期DESTINY-Gastric02研究旨在进一步探索德曲妥珠单抗在欧美人群HER2阳性晚期G/GEJC患者中的疗效和安全性[46],纳入79例既往一线接受过曲妥珠单抗治疗的HER2阳性晚期胃癌患者,结果显示,德曲妥珠单抗二线治疗的中位OS为12.1个月,中位PFS为5.6个月,确认的ORR为42%。但是目前德曲妥珠单抗尚缺乏中国人群二线治疗数据,全球Ⅲ期注册研究正在开展中。
近年来,HER2低表达乳腺癌作为全新的治疗亚型被临床所重视,同时也激发了胃癌领域针对HER2低表达人群的思考和探索。针对HER2低表达胃癌患者,难以从传统抗HER2单抗类药物治疗中获益[17],既往这类患者若晚期二线接受过化疗或抗血管生成联合化疗标准治疗,其生存获益也并不理想。有回顾性研究表明HER2低表达晚期胃癌人群的生存结果与HER2阴性(IHC 0)人群相似,但比HER2阳性人群更差[47]。因此,需要开发针对HER2低表达胃癌新治疗策略。研究发现ADC可能在HER2低表达胃癌中具有潜在的抗肿瘤活性,这可能与部分ADC药物的旁观者效应有关。旁观者效应,即一个小分子毒素杀伤一个肿瘤细胞后从该死亡细胞中释放出来后,继续对周围的(肿瘤)细胞造成杀伤的现象,有助于杀伤HER2低表达细胞,这对治疗异质性高的肿瘤尤为重要[48]。有基础研究表明RC48对于HER2低表达的肿瘤也具有抑瘤作用,体外RC48在HER2低表达的胃癌PDX(移植瘤)小鼠模型抑瘤率显著高于曲妥珠单抗[49],ARX788、MRG002等ADC也被发现在HER2低表达PDX模型中具有抗肿瘤活性[50-51]。C013研究证实了维迪西妥单抗联合特瑞普利单抗二线及以上治疗在HER2低表达(IHC2+/ISH-或IHC1+)的G/GEJC患者群体中的获益,ORR为46%,中位PFS为5.1个月,中位OS为14.0个月[44]。目前尚未确立HER2低表达能否成为胃癌独立治疗亚型,仍需大样本量随机对照临床研究进一步证实。
ARX788、SHR-A1811等新型HER2靶向ADC和KN026、ZW25等双特异性抗体及图卡替尼等小分子TKI二线治疗HER2阳性胃癌的临床试验目前仍处于探索阶段。ARX788是我国自主研发的新型HER2靶向ADC药物,其主要临床研究ACE-Gastric-01是一项针对曲妥珠单抗经治HER2阳性晚期G/GEJ腺癌患者的Ⅰ期剂量扩展试验,经ARX788治疗的中位PFS和OS分别为4.1个月和10.7个月,确认的ORR为37.9%[52]。SHR-A1811是一种新型ADC,由人源化抗HER2单克隆抗体通过可切割的四肽连接子与DNA拓扑异构酶I抑制剂结合组成。一项多中心、开放标签的Ⅰ期研究结果显示,SHR-A1811二线及以上治疗局部晚期或转移性HER2阳性G/GEJC患者,临床Ⅱ期推荐剂量(RP2D)下的ORR为43.8%,6个月的PFS率为74.1%[53]。一项开放标签、多中心、Ⅱ期KN026-202研究数据显示,KN026在既往接受过治疗的晚期HER2阳性的G/GEJC患者中的中位OS为16.3个月,中位PFS为8.3个月,ORR为56%[54]。另一项KN026联合化疗(紫杉醇或伊立替康)二线及以上治疗HER2阳性转移性G/GEJC的Ⅱ期研究[55]显示,中位OS为13.2个月,中位PFS为8.6个月,ORR为40%,显示出良好的抗肿瘤活性。此外KN026联合化疗二线治疗的注册性Ⅲ期临床研究正在开展中。图卡替尼是一种高选择性HER2靶向小分子TKI,其Ⅱ期MOUNTAINEER-02研究在雷莫西尤单抗联合紫杉醇的基础上增加图卡替尼与曲妥珠单抗二线治疗HER2阳性G/GEJC,入组17例患者,结果显示ORR为70.6%,中位PFS为10.4个月,3级及以上AE发生率为88.2%[56]。随着新药的研发,双特异性抗体、单克隆抗体、小分子TKI药物和ADC药物等在晚期胃癌中均显示出较大的潜力,将有望进一步提高HER2阳性晚期胃癌疗效。
03
晚期胃癌三线及以上抗HER2治疗
晚期胃癌后线患者进展快,体能状态较差,预后极差。近几十年来,晚期胃癌三线治疗选择仍然有限。维迪西妥单抗和德曲妥珠单抗作为新型的抗HER2治疗药物填补了晚期胃癌后线抗HER2治疗空白。
推荐意见7:对于HER2阳性(IHC3+或2+/ISH+)晚期胃癌患者,三线治疗推荐新型ADC药物(维迪西妥单抗、德曲妥珠单抗);对于HER2 IHC2+/ISH-晚期胃癌患者可推荐新型ADC药物(维迪西妥单抗)(证据等级:中;推荐级别:弱推荐;专家组赞同率:完全同意64%,基本同意36%)
一项多中心、开放标签、单臂Ⅱ期C008研究,纳入125例既往至少接受二线治疗HER2过表达(IHC3+或2+)局部晚期或转移性G/GEJC患者。结果显示,维迪西妥单抗治疗后中位OS和中位PFS分别为7.9个月和4.1个月,ORR为24.8%[19]。C008研究证实,IHC2+患者,不论ISH状态,均可从维迪西妥单抗治疗中获益,因此进一步拓展了晚期胃癌抗HER2治疗获益人群。3级及以上TRAE为32%,整体安全性良好。基于C008研究,NMPA批准维迪西妥单抗上市,用于至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌(包括GEJC)患者的治疗。《CSCO胃癌诊疗指南-2024版》将维迪西妥单抗作为HER2过表达(IHC3+或2+)晚期胃癌三线治疗I级推荐[9]。
Ⅱ期DESTINY-Gastric01研究是德曲妥珠单抗在胃癌领域的首个随机对照研究,旨在探索德曲妥珠单抗在日本和韩国人群HER2阳性胃癌患者三线治疗中的疗效和安全性。结果显示,与医生选择的化疗组相比,德曲妥珠单抗组的中位OS(12.5个月vs. 8.9个月,HR=0.60;95%CI:0.42~0.86)和中位PFS(5.6个月vs. 3.5个月,HR=0.47;95%CI:0.31~0.71;P=0.000 5)显著延长、确认的ORR(42.0% vs. 12.5%)明显提高。3级及以上AE发生率为85.6%和56.5%[57]。亚组分析结果提示IHC3+亚组获益更为明显(ORR:58.2% vs. 11.4%;OS HR:0.47),IHC2+/ISH-亚组获益可能有限(ORR:28.6% vs. 25.0%;OS HR:1.14)[20]。DESTINY-Gastric01研究探索性队列结果显示德曲妥珠单抗对于IHC2+/ISH-人群ORR为26.3%,对于IHC1+人群ORR为9.5%[58]。DESTINY-Gastric06研究为中国桥接注册性试验,2023年欧洲肿瘤内科学会亚洲年会(ESMO Asia)上公布了其研究结果,在73例既往接受过二线及以上治疗的HER2阳性局部晚期/转移性晚期GC/GEJC患者中,德曲妥珠单抗治疗的独立中心审查(ICR)评估的确认ORR为28.8%,中位OS和中位PFS分别为10.2个月和5.7个月,3级及以上TRAE发生率为65.3%[59]。基于上述研究,2024年8月NMPA批准德曲妥珠单抗用于HER2阳性(IHC3+或2+/ISH+)晚期胃癌三线治疗适应证。晚期胃癌二线及以上抗HER2治疗临床研究及其主要数据汇总见表3。
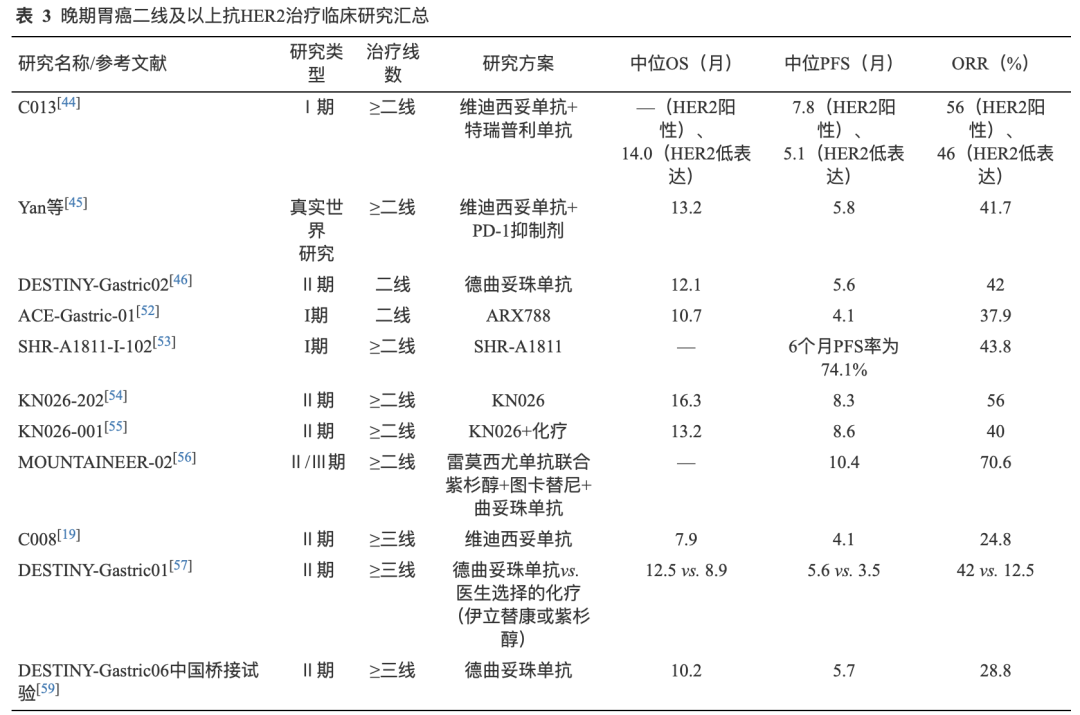
04
局部进展期胃癌围手术期抗HER2治疗
手术是局部进展期胃癌唯一的可根治手段,但是由于术后较高的局部复发与转移风险,单纯手术无法达到满意的效果,以手术为核心的围术期综合治疗已成为局部进展期胃癌的标准治疗。随着晚期胃癌抗HER2治疗的成功,精准胃癌外科诊疗理念的发展,在传统化疗无法进一步突破疗效的背景下,局部进展期胃癌围手术期抗HER2治疗积极探索,以曲妥珠单抗为基础的联合方案以及ADC药物如维迪西妥单抗等,在局部进展期胃癌的围术期抗HER2治疗中展现了良好的近期疗效和安全性。尽管这些研究样本量小,证据力度不强,但也初步看到围手术期抗HER2靶向治疗价值。
推荐意见8:对于行围手术期治疗的局部进展期胃癌患者,推荐术前常规进行HER2检测,胃镜活检标本取材及HER2检测流程可遵循《胃癌胃镜活检标本HER-2检测中国专家共识(2023版)》(证据等级:高;推荐级别:强推荐;专家组赞同率:完全同意92%,基本同意8%)
规范、准确的胃镜活检标本HER2表达状态检测对于胃癌分子分型与筛选抗HER2靶向治疗潜在获益人群具有重要意义。《胃癌胃镜活检标本HER-2检测中国专家共识(2023版)》对胃镜活检的适用人群、操作规范、标本前期处理、检测方法、检测质量控制与多学科合作等做出了相关推荐[60],活检操作应严格遵循相关规范,多点取材,并注意选取活检部位以提高检测的准确性。活检标本应妥善固定、包埋、切片和脱蜡,以确保HER2检测的质量。检测方法应依据《胃癌HER2检测指南 (2016 版)》[10]进行IHC/ISH检测和结果判读。最后,胃镜活检标本的HER2检测需要临床科室、内镜科、病理科等多学科团队的紧密合作,以确保检测的及时性、规范性和准确性。
推荐意见9:对于行新辅助治疗的HER2阳性(IHC3+或2+/ISH+)局部进展期胃癌患者,在临床研究的背景下,围手术期可以考虑联合抗HER2治疗,治疗方案可选曲妥珠单抗+化疗±免疫(证据等级:低;推荐级别:弱推荐;专家组赞同率:完全同意42%,基本同意48%)
西班牙一项评估曲妥珠单抗联合化疗围手术期治疗局部进展期可切除胃癌的多中心、开放标签Ⅱ期NEOHX研究结果显示,曲妥珠单抗联合奥沙利铂和卡培他滨治疗HER2阳性可切除G/GEJC患者,病理学完全缓解(pCR)率为9.6%,90%的患者实现R0切除,18个月无病生存(DFS)率为71%,24个月DFS为60%,中位OS为79.9个月,5年OS率为58%[61]。德国的一项多中心Ⅱ期HER‑FLOT试验结果显示,围手术期曲妥珠单抗联合FLOT方案治疗局部进展期可切除食管胃腺癌(EGA)患者的pCR率为21.4%,R0切除率为92.9%,中位DFS为42.5个月,3年OS率为82.1%[62]。日本的一项随机Ⅱ期Trigger研究结果显示,与化疗相比,曲妥珠单抗联合化疗的ORR(84% vs. 50%,P=0.065)、病理缓解率(≤2/3残留肿瘤细胞)(50% vs. 23%,P=0.072)均有提高[63]。一项主要在欧洲开展的Ⅱ期围手术期研究INNOVATION研究结果显示,在化疗组、曲妥珠单抗联合化疗组以及曲妥珠单抗联合帕妥珠单抗和化疗组中,R0切除率分别为83.9%、90.3%、85.9%,主要病理学缓解率(MPR)分别为23.3%、37.0%、26.4%。曲妥珠单抗联合帕妥珠单抗和化疗组相比单纯化疗组的MPR增加了3.1%,无显著性差异(P=0.378),提示帕妥珠单抗的加入并未提高疗效,反而增加了不良反应;而曲妥珠单抗联合化疗组相比单纯化疗组的MPR增加了13.7%(P=0.099),表明曲妥珠单抗联合化疗围手术期治疗有改善病理缓解率的趋势[64]。
此外,随着曲妥珠单抗联合免疫及化疗在晚期阶段取得成功,这种靶向治疗+免疫治疗+化疗治疗模式也在围手术期展开探索。国内的一项单臂Ⅱ期研究纳入22例HER2阳性G/GEJC患者,旨在评估卡瑞利珠单抗+曲妥珠单抗+CAPOX新辅助治疗HER2阳性G/GEJC患者的疗效和安全性。结果显示,ORR为81%,pCR率为31.3%,R0切除率为100%[65]。2024年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)上报道了一项国内开展的多中心、开放标签Ⅱ期研究结果,试验组与对照组分别纳入21例cT3/T4a/T4b或N+,M0的胃癌患者,与仅接受曲妥珠单抗联合XELOX相比,接受阿替利珠单抗联合曲妥珠单抗和XELOX治疗HER2阳性局部进展期可切除G/GEJC的患者pCR率有所提高(38.1% vs. 14.3%,P=0.079),R0切除率分别为95.2%和90.5%[66]。
推荐意见10:对于行新辅助治疗的HER2阳性(IHC3+或2+/ISH+)或IHC2+/ISH-的局部进展期胃癌患者,可在临床研究的背景下,考虑新型ADC药物联合免疫和化疗进行新辅助治疗(证据等级:低;推荐级别:弱推荐;专家组赞同率:完全同意38%,基本同意50%)
日本一项多中心Ⅱ期研究EPOC2003研究结果显示,德曲妥珠单抗新辅助治疗HER2阳性G/GEJC的MPR率为14.8%,未超过预设目标;pCR率仅为3.7%。该研究提示,在局部进展期HER2阳性G/GEJC患者中,ADC单药新辅助治疗疗效有限[67]。中国发起的一项前瞻性、单臂Ⅱ期研究纳入27例HER2过表达局部进展期可切除G/GEJC,旨在评估维迪西妥单抗联合卡瑞利珠单抗与S-1方案新辅助治疗HER2过表达可切除局部进展期G/GEJC中的疗效和安全性。结果显示,在20例接受手术的患者中,R0切除率100%;其中6例患者达到pCR(30.0%),10例患者达到MPR(50.0%),维迪西妥单抗联合卡瑞利珠单抗与S-1新辅助治疗后,T分期和N分期发生明显降期,安全性良好。上述结果提示,维迪西妥单抗联合卡瑞利珠单抗与S-1为HER2过表达可切除的局部进展期G/GEJC提供了一种潜在安全有效的新辅助治疗方案[68]。针对该治疗模式的随机对照Ⅱ期临床研究正在探索阶段。
推荐意见11:对于局部进展期HER2阳性(IHC3+或2+/ISH+)胃癌患者,若影像学或病理显示术前新辅助抗HER2治疗有效,在患者术后体力状况允许和耐受的条件下,经多学科协作讨论,术后辅助治疗可以继续使用原抗HER2治疗方案(证据等级:低;推荐级别:弱推荐;专家组赞同率:完全同意44%,基本同意48%)
对于新辅助抗HER2治疗后,影像学评估达到缓解或病理显示达到pCR或MPR的患者,由于患者经新辅助治疗后无肿瘤细胞残留或少量癌细胞残留,仍有一定复发风险,且目前尚缺乏研究证实术后改变原方案对患者预后的影响。因此,可考虑术后辅助治疗仍按照原抗HER2治疗方案进行[69]。相关回顾性研究显示[70-71],术前曲妥珠单抗新辅助治疗可能会影响胃癌HER2表达状态,发现经过曲妥珠单抗新辅助治疗后手术标本检测HER2阳性丢失率为27%~38%,并发现术前、术后持续HER2阳性可能与较差的中位DFS(19个月vs. 30个月)、中位OS(36个月vs. 46个月)有关。因此,建议曲妥珠单抗新辅助治疗后重新检测手术标本HER2状态。
推荐意见12:对于未经术前治疗的胃癌患者,术后病理若提示HER2阳性(IHC3+或2+/ISH+),原则上不推荐术后辅助化疗联合抗HER2治疗,但对于术后病理分期为Ⅲ期及以上具有高复发风险因素的胃癌患者,在多学科协作讨论的情况下,可以考虑术后辅助化疗联合抗HER2治疗(证据等级:极低;推荐级别:弱推荐;专家组赞同率:完全同意36%,基本同意44%)
当前关于HER2阳性胃癌辅助抗HER2治疗缺乏前瞻性、大样本量循证医学证据。国内一项回顾性研究纳入208例HER2阳性局部进展期接受D2切除的胃癌患者[70],其中辅助治疗队列135例,分为两组:化疗辅助治疗组(n=104)和曲妥珠单抗联合化疗辅助治疗组(n=31),结果发现经逆概率加权调整(inverse probability of treatment weighting,IPTW)后,与化疗辅助治疗组相比,曲妥珠单抗联合化疗辅助治疗组3年OS率(87.6% vs. 71.7%)、5年OS率(84.1% vs. 58.7%,加权HR=0.24;P=0.023)显著提高。此外,土耳其的一项单臂、多中心、开放标签、Ⅱ期研究,探索CAPOX+曲妥珠单抗及放化疗辅助治疗HER2阳性胃癌安全性和耐受性[72]。结果发现90.3%的患者耐受该治疗方案,2年DFS率为55.0%,2年OS率为58.0%。既往多项研究显示HER2阳性可手术切除的胃癌人群无复发生存期和OS明显差于HER2阴性人群,HER2阳性状态为不良预后因素[12,14,73]。并有研究发现对于HER2表达的Ⅲ期胃癌患者难以从单纯术后辅助化疗中获益,接受辅助化疗的手术患者与仅接受手术的患者OS无显著性差异(37.1个月 vs. 33.9个月,P=0.67)[13]。因此,对于术后病理分期为Ⅲ期及以上具有高复发风险因素的胃癌患者,在多学科协作讨论的情况下,可以考虑术后辅助化疗联合抗HER2治疗。局部进展期胃癌围手术期抗HER2治疗临床研究及主要数据见表4。
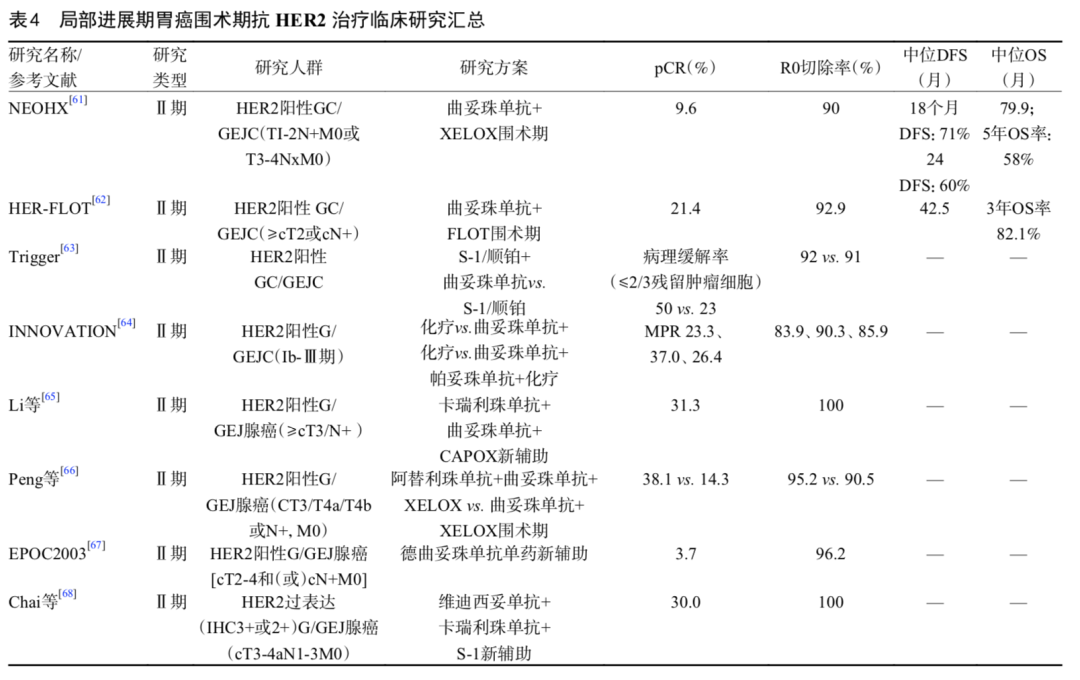
05
晚期胃癌转化抗HER2治疗
推荐意见13:对于初始评估难以根治性切除的HER2阳性(IHC3+或2+/ISH+)晚期胃癌转化治疗方案可以参考晚期胃癌一线抗HER2治疗方案进行选择,治疗期间定期进行影像学疗效评估,密切关注患者营养、体力状态变化,强烈推荐经多学科协作讨论,如有手术指征,选择最佳手术时机,以争取实行根治性手术,转化成功术后辅助治疗方案需结合患者体力状态及病理缓解情况等进行个体化选择(证据等级:极低;推荐级别:弱推荐;专家组赞同率:完全同意66%,基本同意34%)
转化治疗主要针对因手术技术或肿瘤学因素等已无法切除或勉强可切除的晚期肿瘤,通过术前治疗等,在疗效取得最佳缓解时争取使肿瘤能达到R0切除,以达到延长患者生存时间和改善生存质量的目的。随着治疗理念与方案的进步,晚期胃癌的转化治疗取得了一些进展,但目前对于HER2阳性的晚期胃癌转化治疗方案选择尚无定论。Mitsui等[74]开展了一项多中心、非随机、开放标签的研究,评估了16例不可切除的HER2阳性转移性胃癌患者使用曲妥珠单抗联合DCS(多西他赛+顺铂+S-1)治疗的疗效。结果显示治疗后总体缓解率为93.8%,R0切除率达到100%。与未手术组相比,手术组患者中位PFS和中位OS有所延长。一项回顾性研究纳入了33例HER2阳性晚期胃癌患者,并接受曲妥珠单抗联合化疗治疗。其中12例(36.4%)治疗后可进行手术,且R0切除率为100%,与未手术组相比,手术组5年OS率显著提高(68.6% vs. 5.6%,P=0.000 2)[75]。目前晚期胃癌转化抗HER2治疗尚缺乏前瞻性随机对照研究数据支持,HER2阳性晚期胃癌的转化治疗选择可以参考晚期胃癌一线抗HER2治疗方案。
在维迪西妥单抗联合替雷利珠单抗及S-1一线治疗HER2过表达晚期胃癌的Ⅱ期研究RCTS研究中[30],展现出较高的肿瘤缓解(ORR:94.3%)和良好的安全性。由于患者意愿,研究入组的53例患者中有3例患者接受手术治疗,并达到R0切除,其中2例患者达到pCR,这为HER2过表达晚期胃癌患者转化治疗方案选择提供了一个参考方向。此外,我国学者在2024年ASCO GI大会公布了一项单臂、多中心、Ⅱ期研究设计(NCT05627414),以评估维迪西妥单抗联合信迪利单抗和S-1治疗HER2过表达不可切除胃癌转化治疗的疗效和安全性[76]。研究的主要终点为R0切除率,次要终点包括确认的ORR、OS、无复发生存期和安全性,目前研究仍在进行中。
总体而言,晚期胃癌转化抗HER2治疗模式尚处于探索阶段,目前多数结论来源于小样本研究或回顾性研究,仍然面临较多挑战和争议:如何选择转化治疗适宜人群,转化治疗方案如何选择,手术时机如何把握,手术切除范围如何界定,有待后续多中心前瞻性试验探索与验证。
06
抗HER2治疗期间需要关注的问题
6.1 抗HER2治疗重点关注的不良反应及管理
随着抗HER2靶向治疗药物在胃癌中的广泛应用,不同类型的抗HER2药物毒性谱也存在明显差异,对于需要特别关注的不良反应的区分和管理应予以重视。如接受曲妥珠单抗治疗过程中需要密切关注发生心脏毒性的风险;维迪西妥单抗治疗期间应关注周围神经毒性不良反应的发生;使用德曲妥珠单抗治疗期间则应加强对ILD/肺炎不良事件的监测。通过加强对抗HER2不良事件的认识,规范抗HER2治疗的临床管理路径,指导临床用药,改善患者用药体验,提高患者的用药依从性,从而使抗HER2药物的抗肿瘤疗效最大化,为患者带来更充分的临床获益。
6.1.1 心脏毒性
多项临床研究结果显示曲妥珠单抗具有一定的心脏毒性,其高风险因素包括高龄、既往心脏病史、曾经使用蒽环类药物等。曲妥珠单抗的心脏毒性可能表现为无症状性左室射血分数降低、心动过速、心悸、呼吸困难以及胸痛,并可发展成充血性心力衰竭。而在已获批胃癌适应证的ADC药物中发生相关心脏不良事件的发生率较低,多数为无症状。临床实践中要对既往史、体格检查、心电图、超声心动图左心射血分数(LVEF)基线评估后再开始应用曲妥珠单抗,使用期间应该每3个月监测心功能。若患者有无症状性心功能不全,监测频率应更高(如每6~8周1次)。当出现LVEF较治疗前绝对数值下降≥16%,或LVEF低于该检测中心正常范围并且LVEF较治疗前绝对数值下降≥10%时,应暂停曲妥珠单抗治疗至少4周,并每4周检测1次LVEF,4~8周内LVEF回升至正常范围,或LVEF较治疗前绝对数值下降≤15%,可恢复使用曲妥珠单抗。但LVEF持续下降超过8周,或者3次以上因心脏问题而中断曲妥珠单抗治疗,应永久停止使用曲妥珠单抗(图1)[77]。具体心脏毒性不良反应管理措施可参考国内相关指南[78-79]。
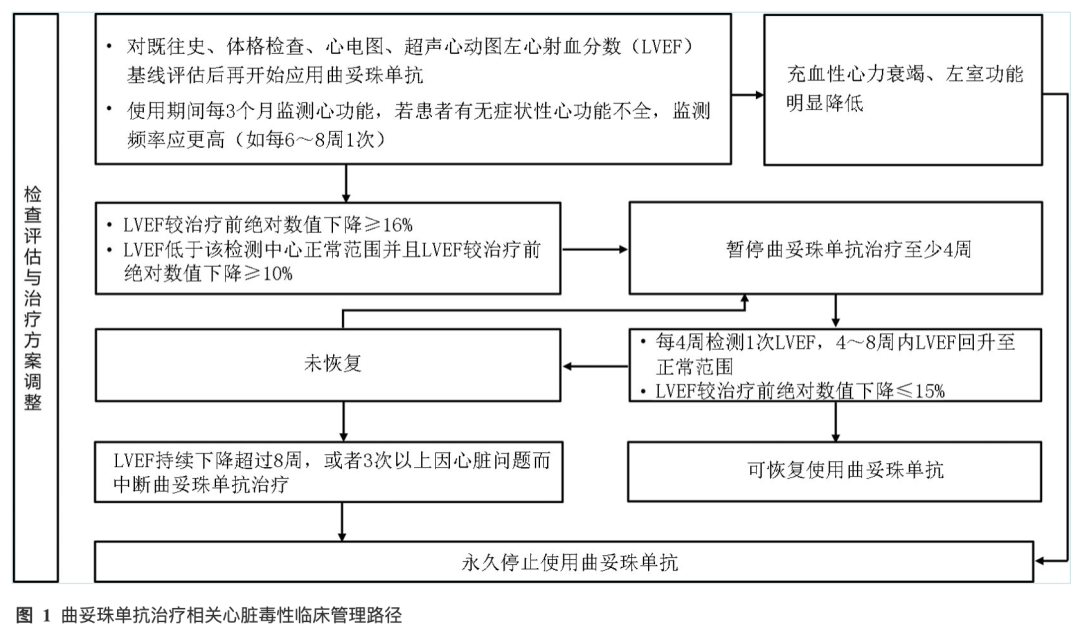
6.1.2 周围神经病变
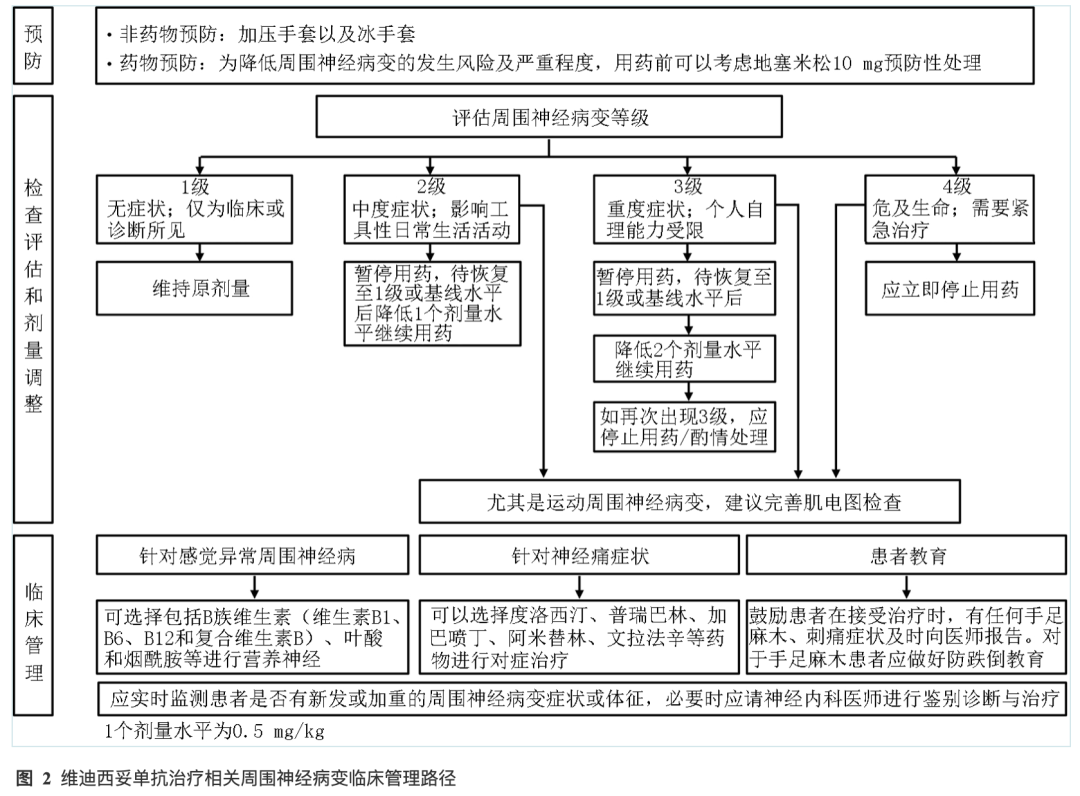
ADC药物中,尤其是以单甲基澳瑞他汀E(MMAE)为载荷的药物,常引发神经毒性问题,包括周围神经病变、感觉减退等。在C008研究中,接受维迪西妥单抗治疗的胃癌患者中有32.8%的患者出现感觉减退,其中3级及以上比例为3.2%[19]。在接受维迪西妥单抗治疗的多种实体瘤患者报告的不良反应中,感觉减退发生率为41.9%,3级及以上发生率为8.9%;周围神经病变发生率为11.4%。感觉异常首先出现于足部和手部,表现为部分感觉异常,如麻木、刺痛、振动觉受损和触觉改变等[80]。治疗期间应当监测患者是否有新发或加重的感觉异常症状和体征[81]。若发生2级或者3级新发或加重的感觉异常,考虑暂停给药、降低剂量或终止维迪西妥单抗治疗,并给予对症治疗,必要时应当请神经内科医生进行鉴别诊断和治疗。ADC类药物的周围神经病变管理可参考《紫杉类药物相关周围神经病变规范化管理专家共识》[82]《化疗诱导的周围神经病变诊治中国专家共识(2022版)》[83]。建议在接受治疗前进行预防性处理,如在用药前30~60 min静脉滴注地塞米松10 mg。当患者出现较为严重的周围神经病变(如3级)时,应暂缓治疗。若症状改善且患者能够自理,可以考虑在降低2个剂量水平的情况下重新开始治疗。若发生更为严重的神经性病变(4级),应立即终止治疗。当患者出现2级及以上周围神经病变,尤其是运动周围神经病变时,建议完善肌电图检查[84]。感觉异常周围神经病可使用的药物包括B族维生素(维生素B1、B6、B12和复合维生素B)、叶酸和烟酰胺等进行营养神经。对于神经痛的症状,可以选择度洛西汀、普瑞巴林、加巴喷丁、阿米替林、文拉法辛等药物进行对症治疗(图2)[84]。
6.1.3 肺毒性
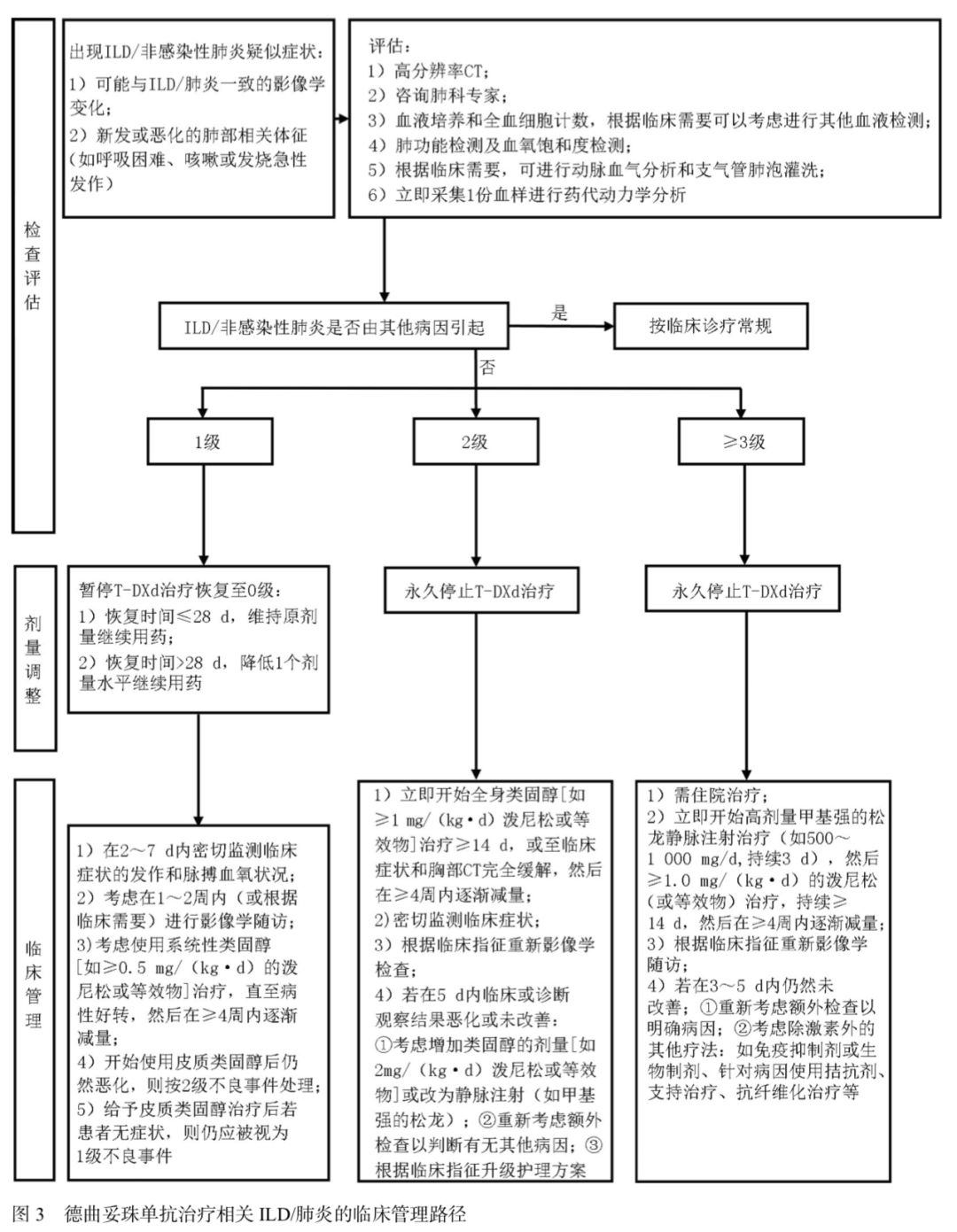
ADC药物引起的肺毒性主要表现为ILD或肺炎。当发生ILD时,轻症时无明显的临床特征,但随着病情发展,患者可能会出现呼吸困难、干咳、发热等全身症状。在DESTINY-Gastric01研究中报道的德曲妥珠单抗治疗相关的ILD/肺炎发生率为12.8%[57]。治疗期间应加强对ILD/肺炎不良事件的监测,教育患者及时报告相关症状。1级ILD/肺炎不良事件应暂停给药至恢复为0级,恢复时间≤28天(d)可维持原剂量继续用药,恢复时间>28 d则应降低1个剂量水平继续用药。≥2级ILD/肺炎不良事件应永久停用药物。发生2级ILD/肺炎不良事件时应立即开始皮质类固醇治疗,持续治疗≥14 d,若5d内未改善应加强皮质类固醇剂量或改为静脉注射甲泼尼龙。发生≥3级ILD/肺炎不良事件时应立即开始高剂量甲泼尼龙静脉注射治疗,然后服用泼尼松龙(或等效药物),持续治疗≥14 d,若5 d内仍未缓解,可考虑除激素外的其他疗法(图3)。抗HER2治疗期间ILD/肺炎的具体管理方法可参考《德曲妥珠单抗临床管理路径及不良反应处理中国专家共识(2024版)》[85]。
6.2 晚期胃癌二线及后线是否需要重新检测HER2状态
推荐意见14:因胃癌HER2表达的高度时空异质性,只要有可能获取肿瘤组织,建议一线疾病进展后对原发灶或转移灶积极进行再次活检确认HER2状态。对于ADC药物,若无法再次检测或患者拒绝,既往HER2检测结果仍然可以指导二线及后线抗HER2治疗(证据等级:低;推荐级别:弱推荐;专家组赞同率:完全同意52%,基本同意48%)
因胃癌的高度时空异质性,一线曲妥珠单抗治疗后患者HER2状态可能会发生改变。韩国一项前瞻性研究(GASTHER3研究)评估曲妥珠单抗治疗对HER2表达状态的影响,将一线治疗前及进展后活检HER2检测结果配对,发现HER2表达丢失率为29.1%[86]。美国一项前瞻性研究将44例晚期胃食管癌(胃癌、食管癌和胃食管结合部癌)患者一线曲妥珠单抗治疗前后的HER2检测结果进行配对,发现其中7例(16%)患者曲妥珠单抗治疗后HER2表达丢失[87]。因此,有条件进行活检的情况下,建议一线疾病进展后对原发灶或转移灶进行再次活检确认HER2状态。目前维迪西妥单抗的胃癌三线C008研究以及德曲妥珠单抗胃癌三线DESTINY-Gastric01和DESTINY-Gastric06研究入组标准对是否需要重新活检检测HER2状态并不作要求。此外,DESTINY-Gastric01探索性分析结果显示无论是一线曲妥珠单抗治疗前取样确认HER2阳性人群,还是一线曲妥珠单抗治疗期间/治疗后取样确认HER2阳性的人群均能从德曲妥珠单抗治疗中获益,ORR分别为48.8%和56.8%[88]。因此,对于ADC药物,后线治疗若能进行HER2状态检测,建议重新确认HER2状态。若无法再次检测或患者拒绝,既往HER2检测结果仍然可以指导二线及后线抗HER2治疗。
6.3 通过ctDNA检测HER2状态是有效的补充手段
推荐意见15:对于无法取得活检组织的胃癌患者,可通过ctDNA检测(液体活检)HER2扩增状态,有助于指导抗HER2靶向治疗(证据等级:低;推荐级别:弱推荐;专家组赞同率:完全同意46%,基本同意46%)
胃癌HER2检测依然面临肿瘤异质性和组织可及性的难题:HER2表达存在时空异质性,肿瘤组织的取样可能造成检测结果可能无法反映肿瘤全貌;部分晚期患者肿瘤组织不可用、无法获取活检组织。当晚期患者肿瘤组织不可用、存在样本采集技术性挑战、采取紧急治疗的患者延迟获取组织活检可能限制治疗选择时,ctDNA检测可作为一种补充的技术手段,有助于指导抗HER2靶向治疗[89]。ctDNA检测HER2扩增与组织检测HER2阳性的一致性较高(约为91.07%)[90],DESTINY-Gastric01生物标志物分析结果显示血浆ctDNA检测HER2扩增与组织检测的HER2表达结果高度一致,主队列中ctDNA检测HER2扩增或高基因拷贝数人群ORR获益越高。日本一项开放标签、单臂、多中心Ⅱ期研究(HERALD/EPOC1806研究)[91],评估德曲妥珠单抗治疗cfDNA(细胞游离DNA)检测HER2扩增的标准治疗失败或无标准治疗的晚期实体瘤患者疗效,纳入62例患者,确认的ORR为56.5%,中位PFS为7.0个月。其中有2例组织学检测HER2阴性的胃癌患者中有1例患者达到缓解。此外,ctDNA检测可用于抗HER2治疗疗效监测、耐药原因分析。国内一项研究报道了基于血液ctDNA液体活检可用于揭示HER2阳性胃癌患者对曲妥珠单抗耐药机制[92]。《胃癌高通量测序临床应用中国专家共识》推荐对无法取得活检组织的患者,可通过高通量测序ctDNA进行基因分型,检测ERBB2扩增作为参考[89]。《CSCO胃癌诊疗指南-2024》指出,基于血液中ctDNA靶向测序的HER2基因体细胞拷贝数结果与荧光原位杂交数据高度一致,对于无法取得活检组织的患者,液体活检HER2扩增情况是一种可能的有效补充手段[9]。
07
结语
随着精准医学时代的到来,胃癌抗HER2治疗取得了长足的发展。抗HER2新药的研发及临床研究的不断推进,为胃癌患者提供了更多治疗选择并延长了患者生存。本共识综合国内外胃癌抗HER2治疗的重要循证医学证据,结合国内临床实践,对于不同临床分期的HER2表达胃癌患者如何合理、安全有效地应用靶向抗HER2药物提出意见和建议,为临床医生提供用药指导。随着胃癌分子精准诊疗的进步和高质量循证医学证据的积累,本共识仍有待同行的不断更新和补充。
[1] Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2024, 74(3):229-263. DOI: 10.3322/caac.21834
[2] Han BF, Zheng RS, Zeng HM, et al. Cancer incidence and mortality in China, 2022[J]. J Natl Cancer Cent, 2024, 4(1):47-53. DOI: 10.1016/j.jncc.2024.01.006
[3] Zeng HM, Zheng RS, Sun KX, et al. Cancer survival statistics in China 2019-2021: a multicenter, population-based study[J]. J Natl Cancer Cent, 2024, 4(3):203-213. DOI: 10.1016/j.jncc.2024.06.005
[4] Kim WH, Gomez-Izquierdo L, Vilardell F, et al. HER2 status in gastric and gastroesophageal junction cancer: results of the large, multinational HER-EAGLE study[J]. Appl Immunohistochem Mol Morphol, 2018, 26(4):239-245. DOI: 10.1097/PAI.0000000000000423
[5] Huang D, Lu N, Fan QH, et al. HER2 status in gastric and gastroesophageal junction cancer assessed by local and central laboratories: Chinese results of the HER-EAGLE study[J]. PLoS One, 2013, 8(11):e80290. DOI: 10.1371/journal.pone.0080290
[6] Sheng WQ, Huang D, Ying JM, et al. HER2 status in gastric cancers: a retrospective analysis from four Chinese representative clinical centers and assessment of its prognostic significance[J]. Ann Oncol, 2013, 24(9):2360-2364. DOI: 10.1093/annonc/mdt232
[7] 黄丹,李增山,樊祥山,等.中国人40842例胃腺癌HER2多中心检测结果分析[J].中华病理学杂志,2018,47(11):822-826. DOI: 10.3760/cma.j.issn.0529-5807.2018.11.002
[8] 中国抗癌协会胃癌专业委员会.2024版CACA胃癌整合诊治指南(精简版)[J].中国肿瘤临床,2024,51(13):650-657.
[9] 中国临床肿瘤学会指南工作委员会组织.中国临床肿瘤学会(CSCO)胃癌诊疗指南-2024[M].北京:人民卫生出版社,2024.
[10] 《胃癌HER2检测指南(2016版)》专家组.胃癌HER2检测指南(2016版)[J].中华病理学杂志,2016,45(8):528-532.
[11] Kurokawa Y, Matsuura N, Kimura Y, et al. Multicenter large-scale study of prognostic impact of HER2 expression in patients with resectable gastric cancer[J]. Gastric Cancer, 2015, 18(4):691-697. DOI: 10.1007/s10120-014-0430-7
[12] Xie SD, Xu CY, Shen JG, et al. HER 2/neu protein expression in gastric cancer is associated with poor survival[J]. Mol Med Rep, 2009, 2(6):943-946.
[13] Liu XC, Xu PF, Qiu HB, et al. Clinical utility of HER2 assessed by immunohistochemistry in patients undergoing curative resection for gastric cancer[J]. Onco Targets Ther, 2016, 9:949-958.
[14] Cheng J, Cai M, Wang GB, et al. HER2 becomes a novel survival biomarker for gastric cancer patients: a pooled analysis[J]. Ther Adv Med Oncol, 2024, 16:17588359241271913.
[15] Qiu MZ, Zhou YX, Zhang XK, et al. Lauren classification combined with HER2 status is a better prognostic factor in Chinese gastric cancer patients[J]. BMC Cancer, 2014, 14:823. DOI: 10.1186/1471-2407-14-823
[16] Nakayama I, Takahari D, Chin K, et al. Incidence, clinicopathological features, and clinical outcomes of low HER2 expressed, inoperable, advanced, or recurrent gastric/gastroesophageal junction adenocarcinoma[J]. ESMO Open, 2023, 8(4):101582. DOI: 10.1016/j.esmoop.2023.101582
[17] Bang YJ, van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial[J]. Lancet, 2010, 376(9742):687-697. DOI: 10.1016/S0140-6736(10)61121-X
[18] Cytryn SL, Janjigian YY. HER2 targeting in esophagogastric cancer: redefining the landscape and breaking barriers[J]. J Natl Compr Canc Netw, 2023, 21(4):423-429. DOI: 10.6004/jnccn.2023.7010
[19] Peng Z, Liu TS, Wei J, et al. Efficacy and safety of a novel anti-HER2 therapeutic antibody RC48 in patients with HER2-overexpressing, locally advanced or metastatic gastric or gastroesophageal junction cancer: a single-arm phase II study[J]. Cancer Commun, 2021, 41(11):1173-1182. DOI: 10.1002/cac2.12214
[20] Shitara K, Bang YJ, Iwasa S, et al. Trastuzumab deruxtecan in previously treated HER2-positive gastric cancer[J]. N Engl J Med, 2020, 382(25):2419-2430. DOI: 10.1056/NEJMoa2004413
[21] Janjigian YY, Kawazoe A, Bai YX, et al. Pembrolizumab in HER2-positive gastric cancer[J]. N Engl J Med, 2024, 391(14):1360-1362. DOI: 10.1056/NEJMc2408121
[22] Lee CK, Rha SY, Kim HS, et al. A single arm phase Ib/II trial of first-line pembrolizumab, trastuzumab and chemotherapy for advanced HER2-positive gastric cancer[J]. Nat Commun, 2022, 13(1):6002. DOI: 10.1038/s41467-022-33267-z
[23] Janjigian YY, Maron SB, Chatila WK, et al. First-line pembrolizumab and trastuzumab in HER2-positive oesophageal, gastric, or gastro-oesophageal junction cancer: an open-label, single-arm, phase 2 trial[J]. Lancet Oncol, 2020, 21(6):821-831. DOI: 10.1016/S1470-2045(20)30169-8
[24] Janjigian YY, Kawazoe A, Bai Y, et al. Final overall survival for the phase III, KEYNOTE-811 study of pembrolizumab plus trastuzumab and chemotherapy for HER2+ advanced, unresectable or metastatic G/GEJ adenocarcinoma[J]. Ann Oncol, 2024, 35(suppl_2):S877-S878.
[25] Chen Y, Jia KR, Chong XY, et al. Implications of PD-L1 expression on the immune microenvironment in HER2-positive gastric cancer[J]. Mol Cancer, 2024, 23(1):169. DOI: 10.1186/s12943-024-02085-w
[26] Qin SK, Ji JF, Xu RH, et al. Treatment patterns and outcomes in Chinese patients with gastric cancer by HER2 status: a noninterventional registry study (EVIDENCE)[J]. Oncologist, 2021, 26(9):e1567-e1580. DOI: 10.1002/onco.13826
[27] 中华医学会临床药学分会《生物类似药临床应用管理专家共识》编写专家组.生物类似药临床应用管理专家共识(第一版)[J].中华医学杂志,2020,100(38):2982-2989.
[28] Saini KS, Punie K, Twelves C, et al. Antibody-drug conjugates, immune-checkpoint inhibitors, and their combination in breast cancer therapeutics[J]. Expert Opin Biol Ther, 2021, 21(7):945-962. DOI: 10.1080/14712598.2021.1936494
[29] Huang L, Wang RQ, Xie K, et al. A HER2 target antibody drug conjugate combined with anti-PD-(L)1 treatment eliminates hHER2+ tumors in hPD-1 transgenic mouse model and contributes immune memory formation[J]. Breast Cancer Res Treat, 2022, 191(1):51-61. DOI: 10.1007/s10549-021-06384-4
[30] Li S, Liu ZM, Liu YG, et al. Efficacy of disitamab vedotin (RC48) plus tislelizumab and S-1 as first-line therapy for HER2-overexpressing advanced stomach or gastroesophageal junction adenocarcinoma: a multicenter, single-arm, phase II trial (RCTS)[J]. J Clin Oncol, 2024, 42(suppl_16):4009.
[31] Shen L, Ding GL, Feng D, et al. A randomized phase II/III study to evaluate the safety and efficacy of disitamab vedotin (DV) plus toripalimab and chemotherapy/trastuzumab as first-line treatment for HER2-expressed, locally advanced, or metastatic gastric cancer[J]. J Clin Oncol, 2024, 42(suppl_3):TPS427.
[32] Janjigian YY, Laarhoven H, Rha SY, et al. Trastuzumab Deruxtecan monotherapy and combinations in patients with advanced/metastatic HER2-positive esophageal, gastric or gastroesophageal junction adenocarcinoma: DESTINY-Gastric03 (DG-03)[J]. Ann Oncol, 2024, 35(suppl_2):S878.
[33] Lee KW, Bai L, Jung M, et al. Zanidatamab (zani) plus chemotherapy (chemo) and tislelizumab (tis) as first-line (1L) therapy for patients (pts) with advanced HER2-positive (+) gastric/gastroesophageal junction adenocarcinoma (GC/GEJC): Updated results from a phase Ib/II study[J]. Ann Oncol, 2023, 34(suppl_2):S855-S856.
[34] Shen L, Gong J, Niu Z, et al. The preliminary efficacy and safety of KN026 combined with KN046 treatment in HER2-positive locally advanced unresectable or metastatic gastric/gastroesophageal junction cancer without prior systemic treatment in a phase II study[J]. Ann Oncol, 2022, 33(suppl_7):S1102.
[35] Jin L, Gao Y, Li N, et al. HLX22 plus HLX02 and XELOX as first-line therapy for HER2-positive advanced gastric/gastroesophageal junction cancer: Updated results from a randomized, double-blind phase II study[J]. Ann Oncol, 2024, 35(suppl_1):S171-S172.
[36] Li ZF, Zhao H, Hu HH, et al. Mechanisms of resistance to trastuzumab in HER2-positive gastric cancer[J]. Chin J Cancer Res, 2024, 36(3):306-321.
[37] Palle J, Tougeron D, Pozet A, et al. Trastuzumab beyond progression in patients with HER2-positive advanced gastric adenocarcinoma: a multicenter AGEO study[J]. Oncotarget, 2017, 8(60):101383-101393. DOI: 10.18632/oncotarget.20711
[38] Wang H, Nie CY, Xu WF, et al. In era of immunotherapy: the value of trastuzumab beyond progression in patients with trastuzumab-resistant HER2-positive advanced or metastatic gastric cancer[J]. Therap Adv Gastroenterol, 2024, 17:17562848241245455.
[39] Kim CG, Jung M, Kim HS, et al. Trastuzumab combined with ramucirumab and paclitaxel in patients with previously treated human epidermal growth factor receptor 2-positive advanced gastric or gastroesophageal junction cancer[J]. J Clin Oncol, 2023, 41(27):4394-4405. DOI: 10.1200/JCO.22.02122
[40] Makiyama A, Sukawa Y, Kashiwada T, et al. Randomized, phase II study of trastuzumab beyond progression in patients with HER2-positive advanced gastric or gastroesophageal junction cancer: WJOG7112G (T-ACT study)[J]. J Clin Oncol, 2020, 38(17):1919-1927. DOI: 10.1200/JCO.19.03077
[41] Narita Y, Kadowaki S, Masuishi T, et al. Correlation between human epidermal growth factor receptor 2 expression level and efficacy of trastuzumab beyond progression in metastatic gastric cancer[J]. Oncol Lett, 2017, 14(2):2545-2551. DOI: 10.3892/ol.2017.6409
[42] Horita Y, Nishino M, Sugimoto S, et al. Phase II clinical trial of second-line weekly paclitaxel plus trastuzumab for patients with HER2-positive metastatic gastric cancer[J]. Anticancer Drugs, 2019, 30(1):98-104. DOI: 10.1097/CAD.0000000000000691
[43] Li Q, Jiang HQ, Li H, et al. Efficacy of trastuzumab beyond progression in HER2 positive advanced gastric cancer: a multicenter prospective observational cohort study[J]. Oncotarget, 2016, 7(31):50656-50665. DOI: 10.18632/oncotarget.10456
[44] Wang YK, Gong JF, Wang AR, et al. Disitamab vedotin (RC48) plus toripalimab for HER2-expressing advanced gastric or gastroesophageal junction and other solid tumours: a multicentre, open label, dose escalation and expansion phase 1 trial[J]. EClinicalMedicine, 2024, 68:102415.
[45] Yan X, Xie Z, Ouyang K, et al. Disitamabvedotin (RC48) combined with programmed death-1 inhibitor for pre-treated HER2 expressed (IHC 2+3+) advanced gastric cancer A multi-center real-world study[J]. Ann Oncol, 2024, 35(suppl_1):S179-S180.
[46] van Cutsem E, di Bartolomeo M, Smyth E, et al. Trastuzumab deruxtecan in patients in the USA and Europe with HER2-positive advanced gastric or gastroesophageal junction cancer with disease progression on or after a trastuzumab-containing regimen (DESTINY-Gastric02): primary and updated analyses from a single-arm, phase 2 study[J]. Lancet Oncol, 2023, 24(7):744-756. DOI: 10.1016/S1470-2045(23)00215-2
[47] Shimozaki K, Fukuoka S, Ooki A, et al. HER2-low gastric cancer: is the subgroup targetable[J]. ESMO Open, 2024, 9(9):103679. DOI: 10.1016/j.esmoop.2024.103679
[48] Li F, Emmerton KK, Jonas M, et al. Intracellular released payload influences potency and bystander-killing effects of antibody-drug conjugates in preclinical models[J]. Cancer Res, 2016, 76(9):2710-2719. DOI: 10.1158/0008-5472.CAN-15-1795
[49] Chen ZH, Yuan JJ, Xu YY, et al. From AVATAR mice to patients: RC48-ADC exerted promising efficacy in advanced gastric cancer with HER2 expression[J]. Front Pharmacol, 2022, 12:757994. DOI: 10.3389/fphar.2021.757994
[50] Skidmore L, Sakamuri S, Knudsen NA, et al. ARX788, a site-specific anti-HER2 antibody-drug conjugate, demonstrates potent and selective activity in HER2-low and T-DM1-resistant breast and gastric cancers[J]. Mol Cancer Ther, 2020, 19(9):1833-1843. DOI: 10.1158/1535-7163.MCT-19-1004
[51] Li H, Zhang X, Xu ZY, et al. Preclinical evaluation of MRG002, a novel HER2-targeting antibody-drug conjugate with potent antitumor activity against HER2-positive solid tumors[J]. Antib Ther, 2021, 4(3):175-184.
[52] Zhang Y, Qiu MZ, Wang JF, et al. Phase 1 multicenter, dose-expansion study of ARX788 as monotherapy in HER2-positive advanced gastric and gastroesophageal junction adenocarcinoma[J]. Cell Rep Med, 2022, 3(11):100814. DOI: 10.1016/j.xcrm.2022.100814
[53] Li J, Luo S, Liu T, et al. Phase I trial of SHR-A1811 in HER2-expressing advanced gastric cancer (GC) or gastroesophageal junction adenocarcinoma (GEJ) and colorectal cancer (CRC)[J]. Ann Oncol, 2023, 34(suppl_2):S478.
[54] Xu JM, Ying JE, Liu RR, et al. KN026 (anti-HER2 bispecific antibody) in patients with previously treated, advanced HER2-expressing gastric or gastroesophageal junction cancer[J]. Eur J Cancer, 2023, 178:1-12. DOI: 10.1016/j.ejca.2022.10.004
[55] Xu J, Zhao J, Chen Y, et al. Efficacy and safety of KN026 in combination with chemotherapy in patients (pts) with unresectable or metastatic HER2 positive gastric or gastroesophageal cancers (GC/GEJC) after first-line treatment with a trastuzumab-containing regimen[J]. Ann Oncol, 2024, 35(suppl_2):S889.
[56] Tehfe M, Lee J, Rha SY, et al. Phase II dose optimization results from MOUNTAINEER-02: A study of tucatinib, trastuzumab, ramucirumab, and paclitaxel for HER2+ gastroesophageal cancer (GEC)[J]. Ann Oncol, 2023, 34(suppl_2):S857-S858.
[57] Yamaguchi K, Bang YJ, Iwasa S, et al. Trastuzumab deruxtecan (T-DXd; DS-8201) in patients with HER2–positive advanced gastric or gastroesophageal junction (GEJ) adenocarcinoma: Final overall survival (OS) results from a randomized, multicenter, open-label, phase 2 study (DESTINY-Gastric01)[J]. J Clin Oncol, 2022, 40(suppl_4):242.
[58] Yamaguchi K, Bang YJ, Iwasa S, et al. Trastuzumab deruxtecan in anti-human epidermal growth factor receptor 2 treatment-naive patients with human epidermal growth factor receptor 2-low gastric or gastroesophageal junction adenocarcinoma: exploratory cohort results in a phase II trial[J]. J Clin Oncol, 2023, 41(4):816-825. DOI: 10.1200/JCO.22.00575
[59] Shen L, Chen P, Lu J, et al. Trastuzumab deruxtecan (T-DXd) in Chinese patients (pts) with previously treated HER2-positive locally advanced/metastatic gastric cancer (GC) or gastroesophageal junction adenocarcinoma (GEJA): Primary efficacy and safety from the phase II single-arm DESTINY-Gastric06 (DG06) trial[J]. Ann Oncol, 2023, 34(suppl_4):S1542-S1543.
[60] 中国抗癌协会胃癌专业委员会, 中国抗癌协会肿瘤内镜学专业委员会.胃癌胃镜活检标本HER-2检测中国专家共识(2023版)[J].中国肿瘤临床,2023,50(19):973-982. DOI: 10.12354/j.issn.1000-8179.2023.20230961
[61] Rivera F, Izquierdo-Manuel M, García-Alfonso P, et al. Perioperative trastuzumab, capecitabine and oxaliplatin in patients with HER2-positive resectable gastric or gastro-oesophageal junction adenocarcinoma: NEOHX phase II trial[J]. Eur J Cancer, 2021, 145:158-167. DOI: 10.1016/j.ejca.2020.12.005
[62] Hofheinz RD, Hegewisch-Becker S, Kunzmann V, et al. Trastuzumab in combination with 5-fluorouracil, leucovorin, oxaliplatin and docetaxel as perioperative treatment for patients with human epidermal growth factor receptor 2-positive locally advanced esophagogastric adenocarcinoma: a phase II trial of the Arbeitsgemeinschaft Internistische Onkologie Gastric Cancer Study Group[J]. Int J Cancer, 2021, 149(6):1322-1331. DOI: 10.1002/ijc.33696
[63] Tokunaga M, Machida N, Mizusawa J, et al. Early endpoints of a randomized phase II trial of preoperative chemotherapy with S-1/CDDP with or without trastuzumab followed by surgery for HER2-positive resectable gastric or esophagogastric junction adenocarcinoma with extensive lymph node metastasis: Japan Clinical Oncology Group study JCOG1301C (Trigger Study)[J]. Gastric Cancer, 2024, 27(3):580-589. DOI: 10.1007/s10120-024-01467-9
[64] Wagner AD, Grabsch HI, Mauer M, et al. Integration of trastuzumab (T), with or without pertuzumab (P), into perioperative chemotherapy (CT) of HER-2 positive gastric (GC) and esophagogastric junction cancer (EGJC): First results of the EORTC 1203 INNOVATION study, in collaboration with the Korean Cancer Study Group, and the Dutch Upper GI Cancer group[J]. J Clin Oncol, 2023, 41(suppl_16):4057.
[65] Li N, Li Z, Fu Q, et al. Phase Ⅱ study of SHR1210 and trastuzumab in combination with CAPOX for neoadjuvant treatment of HER2-positive gastric or gastroesophageal junction (GEJ) adenocarcinoma[J]. J Clin Oncol, 2022, 40(suppl_4):296.
[66] Peng Z, Zhang XT, Liang H, et al. Atezolizumab and trastuzumab plus chemotherapy in patients with HER2+ locally advanced resectable gastric cancer or adenocarcinoma of the gastroesophageal junction: a multicenter, randomized, open-label phase II study[J]. J Clin Oncol, 2024, 42(suppl_3):312.
[67] Takahari D, Kawazoe A, Machida N, et al. Phase 2 study of trastuzumab deruxtecan as neoadjuvant treatment for HER2-positive gastric and gastroesophageal junction adenocarcinoma (EPOC2003)[J]. J Clin Oncol, 2024, 42(suppl_3):309.
[68] Chai J, Wang L, Liu L, et al. Efficacy and safety of disitamabvedotin (RC48) combined with camrelizumab and S-1 for neoadjuvant therapy of locally advanced gastric cancer with HER2 overexpression: Preliminary results of a prospective, single-arm, phase II study[J]. Ann Oncol, 2024, 35(suppl_2):S908.
[69] 中国抗癌协会胃癌专业委员会.免疫检查点抑制剂用于进展期胃癌围手术期治疗的中国专家共识(2024版)[J].中华消化外科杂志,2024,23(3):309-322. DOI: 10.3760/cma.j.cn115610-20240130-00049
[70] He QF, Chen JH, Zhou K, et al. Effect of additional trastuzumab in neoadjuvant and adjuvant treatment for patients with resectable HER2-positive gastric cancer[J]. Ann Surg Oncol, 2021, 28(8):4413-4422. DOI: 10.1245/s10434-020-09405-6
[71] Frydman AE, Drouillard A, Soularue E, et al. Addition of trastuzumab to perioperative chemotherapy in HER2-positive gastroesophageal adenocarcinoma patients: a multicenter retrospective observational AGEO study[J]. Dig Liver Dis, 2024, 56(1):198-205. DOI: 10.1016/j.dld.2023.06.007
[72] Abali H, Yalcin S, Onal HC, et al. A phase Ⅱ study of the combination of oxaliplatin, capecitabine, and trastuzumab and chemoradiotherapy in the adjuvant setting in operated patients with HER2-positive gastric or gastroesophageal junction cancer (TOXAG study): a Turkish oncology group study[J]. Am J Clin Oncol, 2021, 44(7):301-307. DOI: 10.1097/COC.0000000000000825
[73] Cho JH, Lim JY, Cho JY. Survival analysis based on human epidermal growth factor 2 status in stage II-III gastric cancer[J]. World J Gastroenterol, 2017, 23(41):7407-7414. DOI: 10.3748/wjg.v23.i41.7407
[74] Mitsui Y, Sato Y, Miyamoto H, et al. Trastuzumab in combination with docetaxel/cisplatin/S-1 (DCS) for patients with HER2-positive metastatic gastric cancer: feasibility and preliminary efficacy[J]. Cancer Chemother Pharmacol, 2015, 76(2):375-382. DOI: 10.1007/s00280-015-2807-7
[75] Arigami T, Matsushita D, Okubo K, et al. A prognostic scoring system for conversion surgery after trastuzumab-based chemotherapy for human epidermal growth factor receptor 2-positive advanced gastric cancer[J]. Surg Today, 2022, 52(12):1721-1730. DOI: 10.1007/s00595-022-02515-6
[76] Liang H, Wang XN, Shang L, et al. Phase Ⅱ clinical study evaluating the efficacy and safety of disitamab vedotin combined with sintilimab and S-1 in the conversion treatment of HER2-over expression unresectable gastric cancer[J]. J Clin Oncol, 2024, 42(suppl_3):TPS428.
[77] 中国抗癌协会临床肿瘤学协作专业委员会,中国抗癌协会胃癌专业委员会,中国抗癌协会肿瘤病理专业委员会.人表皮生长因子受体2阳性晚期胃癌分子靶向治疗的中国专家共识[J].中华肿瘤杂志,2013,35(4):315-319. DOI: 10.3760/cma.j.issn.0253-3766.2013.04.017
[78] 中国抗癌协会.中国肿瘤整合诊治技术指南(CACA)-2023-心血管保护[M].天津:天津科学技术出版社,2023.
[79] 中国临床肿瘤学会指南工作委员会组织.中国临床肿瘤学会(CSCO)肿瘤治疗相关心血管毒性防治指南-2021[M].北京:人民卫生出版社,2021.
[80] 中国药学会医院药学专业委员会,中国抗癌协会肿瘤临床化疗专业委员会.抗体偶联药物安全性跨学科管理中国专家共识[J].中国医院药学杂志,2023,43(1):1-10.
[81] 徐晓晶,余一祎,刘青,等.胃癌抗体偶联药物不良事件的发生机制及管理策略[J].临床肿瘤学杂志,2023,28(8):751-759. DOI: 10.3969/j.issn.1009-0460.2023.08.014
[82] 紫杉类药物相关周围神经病变规范化管理专家共识专家委员会.紫杉类药物相关周围神经病变规范化管理专家共识[J].中华肿瘤杂志,2020,42(3):170-179. DOI: 10.3760/cma.j.cn112152-20200203-00062
[83] 中国抗癌协会肿瘤支持治疗专业委员会,中国抗癌协会肿瘤临床化疗专业委员会.化疗诱导的周围神经病变诊治中国专家共识(2022版)[J].中华肿瘤杂志,2022,44(9):928-934.
[84] 中国抗癌协会肿瘤药物临床研究专业委员会,国家抗肿瘤药物临床应用监测专家委员会,国家肿瘤质控中心乳腺癌专家委员会,等.抗体药物偶联物治疗恶性肿瘤临床应用中国专家共识(2023版)[J].中华肿瘤杂志,2023,45(9):741-762. DOI: 10.3760/cma.j.cn112152-20220713-00489
[85] 德曲妥珠单抗临床管理路径及不良反应处理共识专家组.德曲妥珠单抗临床管理路径及不良反应处理中国专家共识(2024版)[J].中华肿瘤杂志,2024,46(4):304-318. DOI: 10.3760/cma.j.cn112152-20231122-00319
[86] Seo S, Ryu MH, Park YS, et al. Loss of HER2 positivity after anti-HER2 chemotherapy in HER2-positive gastric cancer patients: results of the GASTric cancer HER2 reassessment study 3 (GASTHER3)[J]. Gastric Cancer, 2019, 22(3):527-535. DOI: 10.1007/s10120-018-0891-1
[87] Janjigian YY, Sanchez-Vega F, Jonsson P, et al. Genetic predictors of response to systemic therapy in esophagogastric cancer[J]. Cancer Discov, 2018, 8(1):49-58. DOI: 10.1158/2159-8290.CD-17-0787
[88] Shitara K, Bang YJ, Iwasa S, et al. Trastuzumab deruxtecan in HER2-positive advanced gastric cancer: exploratory biomarker analysis of the randomized, phase 2 DESTINY-Gastric01 trial[J]. Nat Med, 2024, 30(7):1933-1942. DOI: 10.1038/s41591-024-02992-x
[89] 中国抗癌协会胃癌专业委员会.胃癌高通量测序临床应用中国专家共识[J].中国肿瘤临床,2023,50(6):309-318. DOI: 10.12354/j.issn.1000-8179.2023.20230030
[90] Wang HX, Li BF, Liu ZT, et al. HER2 copy number of circulating tumour DNA functions as a biomarker to predict and monitor trastuzumab efficacy in advanced gastric cancer[J]. Eur J Cancer, 2018, 88:92-100. DOI: 10.1016/j.ejca.2017.10.032
[91] Yagisawa M, Taniguchi H, Satoh T, et al. Trastuzumab deruxtecan in advanced solid tumors with human epidermal growth factor receptor 2 amplification identified by plasma cell-free DNA testing: a multicenter, single-arm, phase II basket trial[J]. J Clin Oncol, 2024, 42(32):3817-3825. DOI: 10.1200/JCO.23.02626
[92] Wang DS, Liu ZX, Lu YX, et al. Liquid biopsies to track trastuzumab resistance in metastatic HER2-positive gastric cancer[J]. Gut, 2019, 68(7):1152-1161.
排版编辑:古木











 苏公网安备32059002004080号
苏公网安备32059002004080号


