骨髓增生异常综合征(MDS)是一种起源于造血干细胞伴分子生物学异常的血液肿瘤,其临床表现是无效造血、难治性血细胞减少、高风险向急性髓系白血病(AML)转化。因此,改善造血功能、延缓疾病进展和延长生存期是MDS治疗的首要目标1。自2023年第1版NCCN MDS指南发布以来,分子遗传学的国际预后评分系统(IPSS-M)作为MDS预后评估系统之一,体现了基于基因突变的MDS精准治疗新趋势。随着靶向药物的上市和应用,MDS患者的生存得到了明显改善。本期特邀北京大学人民医院王昱教授,结合2024年美国血液学会(ASH)年会的研究成果,分享艾伏尼布治疗IDH1突变MDS的最新研究进展。
MDS是一组起源于造血干细胞伴分子生物学异常的异质性髓系克隆性疾病, 其表现是无效造血、难治性血细胞减少以及高风险向AML转化1。80%以上的MDS患者伴有基因突变,包括甲基化调控、组蛋白修饰、剪接体和转录因子等驱动基因的突变2,3。其中,IDH突变在MDS中的发生率为4%~12%,IDH突变促使2-羟基戊二酸(2-HG)的高水平积累,导致表观遗传调控异常,进而阻滞造血细胞的分化并促进MDS进展为AML3。
IDH1突变MDS治疗挑战重重
亟需探索更优临床策略
1.1 IDH1突变MDS患者输血需求高,生活质量差
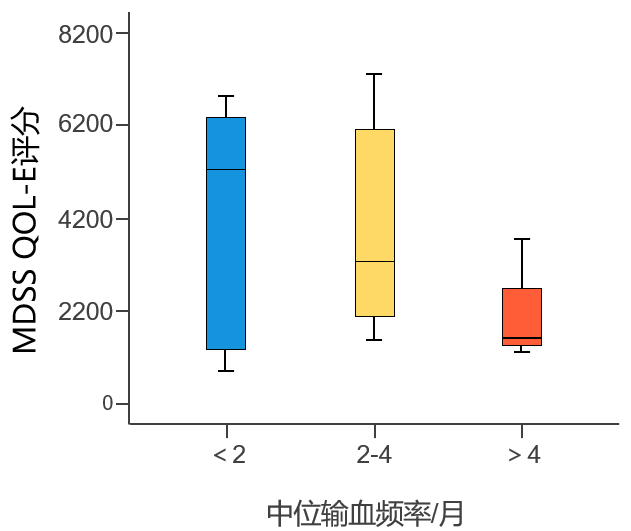
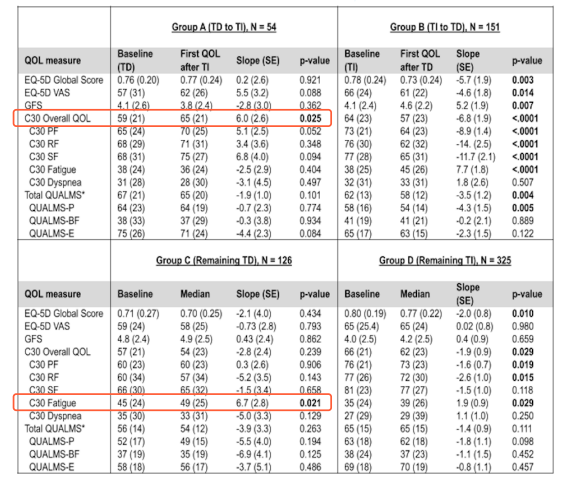
一项来自梅奥诊所的研究纳入了277例连续诊断的MDS患者,包括8例IDH1突变患者和26例IDH2突变患者(IDH突变发生率为12%),旨在分析IDH突变患者的临床特征及IDH突变与MDS预后间的相关性。结果显示,在所有纳入的患者中,有52例(19%)患者存在输血依赖。进一步分析发现,IDH1突变患者输血依赖比例达100%4。本次ASH大会上有一项研究评估了输血负担与MDS患者生活质量间的相关性。该研究纳入259例MDS患者,旨在探讨MDS患者与相关护理人员未满足的需求。结果显示,输血依赖的患者占42%(N=97),其中,33%的患者接受<2个单位/月的输血,54%的患者接受2~4个单位/月的输血,13%的患者接受>4个单位/月的输血;较高的输血频率与患者较差的生活质量相关(p=0.012)(图1)5。本次ASH大会另一项研究则提示,摆脱输血依赖可显著提高MDS患者的总体生活质量和OS。研究人员对MDS-CAN前瞻性登记的1120例患者进行了输血状态随时间变化的回顾性队列分析。结果显示,由输血依赖(TD)转为非输血依赖(TI)的A组,总体生活质量显著改善(p=0.025),身体和社会功能评分呈现出改善趋势;维持TD的C组,疲劳程度则明显增加(p=0.021)(表1);维持TI的患者具有最佳的OS曲线,而维持TD的患者具有最差的OS曲线(p<0.001)6。
1.2 IDH1突变MDS具有较高的转白风险
本次ASH大会公布的一项回顾性分析,纳入了1321例LR-MDS患者(其中,IDH1突变患者37例),旨在评估IDH1突变对患者OS和白血病转化的影响。结果显示, IDH1突变 LR-MDS患者具有更高的AML转化率(27% vs 11%,p=0.003)和更差的无白血病生存期(LFS)(92个月 vs NR,p=0.006)7。该研究结论与一项来自德国的研究结论一致:研究纳入193例MDS患者和53例由MDS转化为AML的患者,结果显示,IDH1突变在MDS中的发生率为3.6%,在AML中的发生率为7.5%,IDH1突变与较高的AML转化率(67% vs 28%,P=0.04)和较短的OS(HR 3.20; 95% CI 1.47-6.99)相关8。
1.3 前IDH1抑制剂时代,IDH1突变MDS患者的OS较短
梅奥诊所的一项研究进行了多变量分析,结果显示,IDH1突变(HR 4.0,95% CI 1.9-8.8, P=0.0004)、IPSS-R风险评分(P<0.0001)和诊断时红细胞输注(P=0.002)是较差生存的独立预测因素4。一项来自我国的回顾性队列研究纳入108例初发MDS患者,低危患者主要采用支持治疗(维甲酸、沙利度胺、十一酸睾酮、复方皂矾丸、输血治疗),高危患者采用传统化疗(如CAG、HAG、IA)或地西他滨(标准5天方案或3天方案),旨在评估IDH突变组与非突变组的预后差异。结果显示,中位随访472天, IDH1突变组的OS显著低于非突变组(165天 vs 740天,P=0.023)9。本次ASH大会公布的一项回顾性分析纳入了1057例HR-MDS患者(其中,IDH1突变患者32例),旨在评估IDH1突变HR-MDS患者对去甲基化药物(HMA)的反应。结果显示,在HMA治疗失败的IDH1突变HR-MDS患者中,28例未接受IDH1抑制剂治疗的患者中位OS仅5.1个月,而4例HMA治疗失败后接受IDH1抑制剂治疗的患者,中位OS为28.6个月7。
艾伏尼布精准靶向IDH1突变
改善预后重塑MDS治疗格局
艾伏尼布是一种靶向IDH1突变的小分子抑制剂,基于AG120-C-001研究数据,FDA于2023年10月批准艾伏尼布治疗IDH1突变R/R MDS10。
AG120-C-001研究是一项单臂、多中心、临床I期、剂量递增和扩展研究,共纳入19例IDH1突变R/R MDS患者,接受艾伏尼布500mg口服每日一次的治疗,旨在评估艾伏尼布在IDH1突变R/R MDS中的安全性和耐受性、临床活性、药代动力学和药效学。入组患者中位年龄为73.0岁(范围:52-82岁);既往一线接受HMA治疗的患者为73.7%;筛选时,IPSS-R评分为3~4.5分、>4.5~6分和>6分的患者分别为42.1%、15.8%和15.8%;细胞遗传学异常的患者为47.4%;2例(10.5%)患者桥接移植。
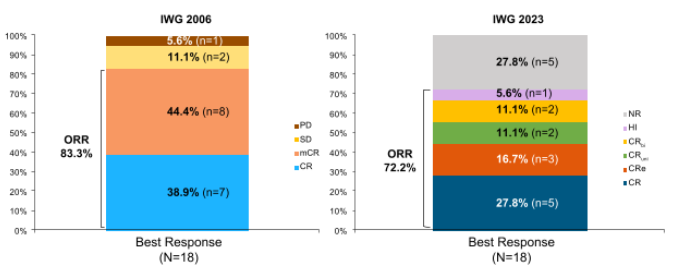
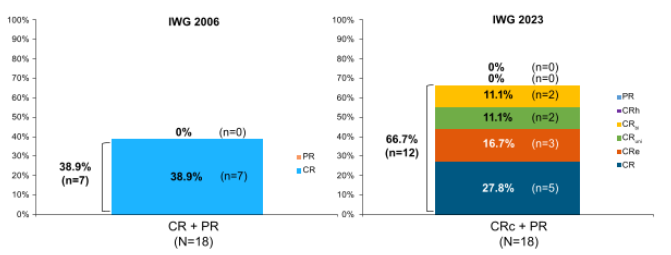
中位治疗时间9.3个月,18例患者接受了疗效评价。根据IWG 2006 标准,ORR为83.3%(图2),CR率为38.9%(图3),达CRc的中位时间为1.87个月,中位DoCR未达到,最大DoCR为80.8个月,中位OS达35.7个月11。本次ASH大会报道了根据 IWG 2023标准评估的最新结果:ORR 为 72.2%(图2),CRc为 66.7%(图3),达CRc的中位时间为1.58个月,CRc患者的中位OS未达到,未缓解患者的中位OS为16.5个月12。提示艾伏尼布单药治疗IDH1突变R/R MDS患者,可实现持久缓解和生存获益。
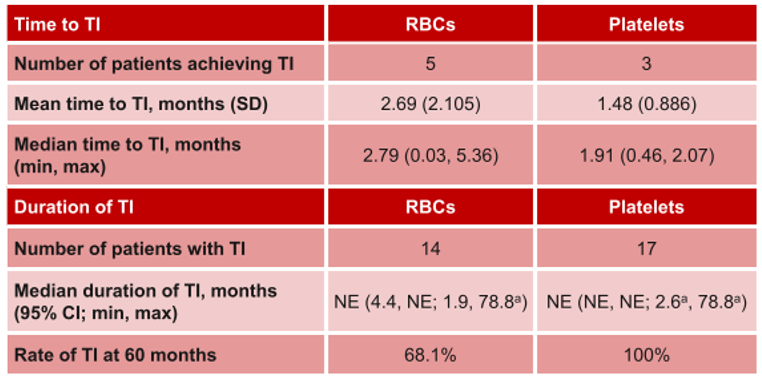
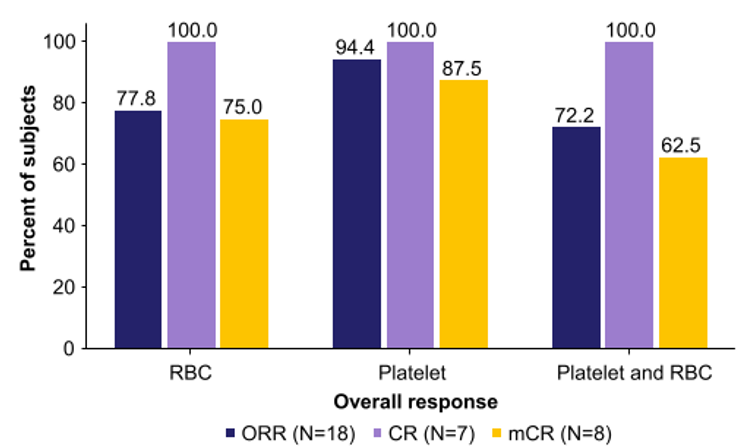
本次ASH大会的另一项报告探讨了AG120-C-001研究中艾伏尼布对IDH1突变R/R MDS患者血液学的影响。结果显示,38.9%的患者达到了CR,且无论是否达到CR,大多数患者都表现出血液学改善(HI)和非输血依赖(TI)。在未达到CR的患者中,36.4%的患者实现HI,达HI的中位时间为0.97个月;第60个月时,100%的患者维持HI。红细胞和血小板达TI的中位时间分别为2.79个月和1.91个月,红细胞和血小板Tl的中位持续时间均未达到(表2)。在获得骨髓CR(mCR)的8例患者中,87.5%患者实现血小板Tl,75%患者实现了红细胞Tl, 62.5%患者同时实现了血小板和红细胞Tl(图4)13。这与AG120-C-001研究已发表的另一项研究中的临床获益相似11。这些研究结果提示,无论治疗反应如何,接受艾伏尼布治疗的IDH1突变R/R MDS患者能够迅速获得HI,实现TI,并长期维持,改善了患者的生活质量,为患者带来显著的临床获益。
AG120-C-001研究结果也提示:艾伏尼布能够显著延长IDH1突变MDS向AML的转化时间。中位随访27.1个月,仅有2例(11.1%)接受艾伏尼布治疗的MDS患者进展为AML。1例患者基线时细胞遗传学评估为预后中等(+8),合并ASXL1、NRAS和PTPN11突变,骨髓原始细胞比例4%,诊断时IPSS-R评分较高,且该患者在病情进展中有过最佳反应;另1例患者基线时细胞遗传学评估为预后不良(7号染色体为单体核型),骨髓原始细胞比例19%,诊断时IPSS-R评分极高,该患者的总缓解期为8.3个月,其中CR持续时间为5.6个月,随后进展为AML11。既往文献报道,阿扎胞苷上市前,IDH1突变MDS患者进展为AML的风险为67%8。提示,艾伏尼布的应用可显著降低IDH1突变MDS向AML转化的风险。
在安全性方面, AG120-C-001研究结果显示艾伏尼布具有良好的耐受性。3级以上TRAE发生率为10.5%,特别关注的不良事件为QT间期延长和分化综合征(均为1~2级),可通过剂量调整和对症治疗进行管理11。
开展多队列深入研究,积累循证医学证据
2024年EHA公布的IDIOME研究共纳入48例IDH1突变MDS患者,其中,未经治疗的一线HR-MDS患者(B队列)为23例,旨在评估艾伏尼布在初治HR-MDS患者中的ORR。
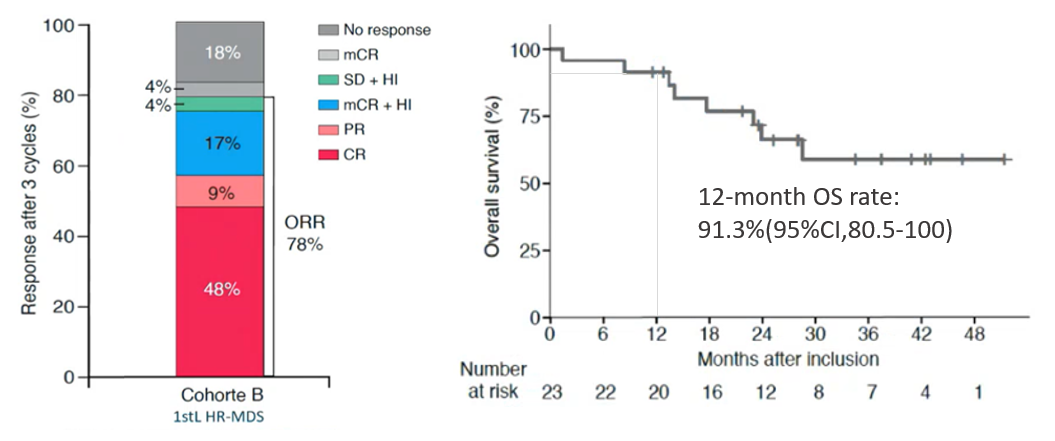
该队列患者的中位年龄为76岁。根据WHO 2016诊断标准,MDS-EB2患者为48%,低原始细胞AML患者为39%。所有患者IPSS-R评分均>3分。根据IPSS细胞遗传学,52%的患者为细胞遗传学风险中等或不良。结果显示,经过3个周期的治疗后ORR达78%(CR率为48%);中位随访25.2个月,中位OS和DOR均未达到,12个月OS率达91.3%(图5),桥接移植的患者为22%14。提示:艾伏尼布治疗IDH1突变初治HR-MDS患者,可实现显著地持久缓解、提供桥接移植的机会和延长患者的生存期。
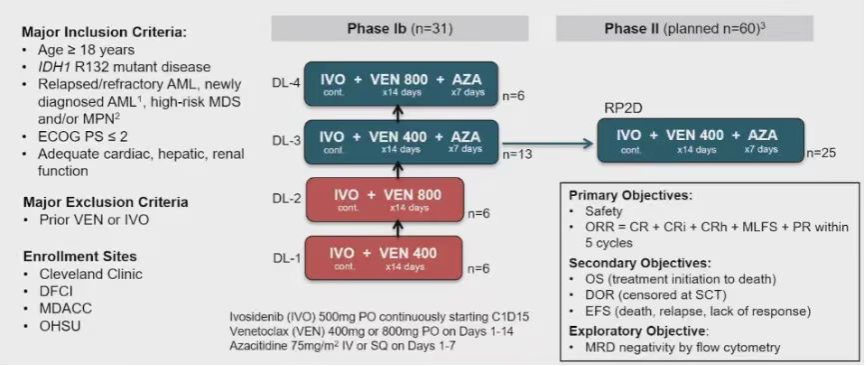
本次ASH大会公布了来自MD. Anderson癌症中心的一项艾伏尼布(IVO)联合维奈克拉(VEN)联合或不联合阿扎胞苷(AZA)治疗IDH1突变恶性血液肿瘤的Ib/II期研究最新数据。给药方案为维奈克拉(400mg或800mg,第1-14天)、阿扎胞苷(75mg/m2,第1-7天)和艾伏尼布(500 mg,从第1周期第15天开始),每个治疗周期为28天,依此分为四个剂量队列(DL)进行剂量探索,最终在DL3(VEN 400mg+IVO+AZA)剂量下扩展II期研究(图6)。
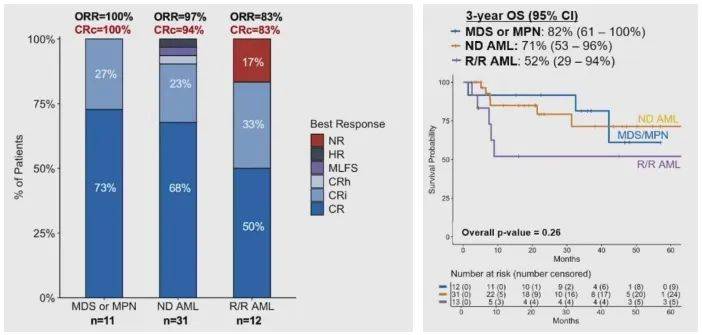
研究共纳入12例MDS/MPN患者,中位年龄70岁(56-81)。在可评估疗效的11例患者中,5个周期内的ORR和CRc均为100%(图7)。中位随访36个月,3年的OS和EFS分别为82%和64%15。该三联方案亦显示出良好的耐受性,未报告新增不良事件15。该结果提示:VEN+IVO±AZA治疗IDH1突变MDS/MPN具有安全、有效、远期疗效持久的潜在临床优势。
专家评述
作为MDS常见的基因突变之一,IDH1突变增加了MDS向AML转化的风险,并伴随着较高的输血需求。目前,多项临床研究表明,FDA获批上市用于IDH1突变R/R MDS的新型、口服、靶向IDH1突变的艾伏尼布,展现出了显著的治疗潜力,包括:良好的耐受性、快速持久缓解、改善输血依赖、提高生活质量、降低转白风险和延长生存期。且艾伏尼布已被NCCN MDS指南推荐用于IDH1突变低危和高危MDS的治疗,如:IDH1突变HR-MDS(IPSS-R评分为中等、高和极高)移植候选患者,可接受艾伏尼布联合阿扎胞苷治疗(推荐级别:2B)后桥接移植,或对常规化疗方案无应答的患者,可考虑接受艾伏尼布单药治疗(推荐级别:2B)后桥接移植16。
期待随着IDH1突变MDS研究的深入了解和新型治疗策略的不断涌现, IDH1突变MDS迎来突破性的治疗进展,以改善患者的整体预后。
专家简介
北京大学人民医院
血液科副主任
学术任职:
中华医学会血液学分会第十一届感染学组副组长
北京医学会血液学分会委员
中华医学会血液学分会第十届造血干细胞应用学组委员兼秘书
中华医学会血液学分会第十届青年委员
中国医疗保健国际交流促进会理事、血液学分会副秘书长
中国抗癌协会血液肿瘤专业委员会中国MDS/MPN工作组副组长、血液病转化委员会委员
中国老年医学会血液学分会常务委员、MDS学术工作委员会副组长
中国中西医结合学会血液学专业委员会委员
北京中西医结合学会血液学专业委员会常务委员
中华血液学杂志通讯编委、临床内科杂志编委
国家自然科学基金委评议人
[1].中华医学会血液学分会.中华血液学杂志,2019,40(2):89-97.[2].临床血液学杂志,2017,30(5): 407-412.[3].临床与实验病理学杂志,2021,37(2):198-201.[4].Leukemia. 2012 Jan;26(1):101-5.[5].2024 ASH annual meeting, poster 3800.[6].2024 ASH annual meeting, poster 4583.[7].2024 ASH annual meeting, poster 4589.[8].Haematologica. 2010 Oct; 95(10): 1668–1674.[9].中华医学杂志,2013,93(40):3180-3184.[10].https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-ivosidenib-myelodysplastic-syndromes查询日期2025年1月10日[11].DiNardo CD, et al. Blood Adv. 2024 Aug 13;8(15):4209-4220.[12].2024 ASH annual meeting, poster 1841.[13].2024 ASH annual meeting, poster 3226.[14].2024 EHA annual meeting, Oral S182.[15].2024 ASH annual meeting, Oral 219.[16].NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) Myelodysplastic Syndromes Version 1.2025.
排版编辑:肿瘤资讯-展思懿











 苏公网安备32059002004080号
苏公网安备32059002004080号


