在乳腺癌的众多类型中,大多数患者属于激素受体阳性(HR+)乳腺癌,这类患者的癌细胞会表达雌激素受体和(或)孕激素受体。一直以来,内分泌治疗是 HR+ 乳腺癌的重要治疗手段,且在治疗初期效果显著。然而,当免疫治疗这一新兴疗法进入视野,HR+ 乳腺癌的治疗局面却并未如预期般被改写。
免疫治疗在 HR+ 乳腺癌中的进展为何如此坎坷?原来,HR+ 乳腺癌的程序性死亡配体 1(PD-L1)和肿瘤浸润淋巴细胞(TILs)表达较低,仅有 15% 的患者 PD-L1 综合阳性评分(CPS)>10,这使得免疫治疗难以有效发挥作用,这也导致至今FDA都未批准任何一款针对 HR+ 乳腺癌的免疫疗法。
不过,医学科研人员并未放弃,他们持续探索优化治疗方案,且已取得了一些令人振奋的成果。本文基于领域综述1,全面梳理 HR+乳腺癌免疫治疗及相关研究进展,带您深入了解这一领域的前世今生。
晚期及转移性HR+/HER2- 乳腺癌
帕博利珠单抗
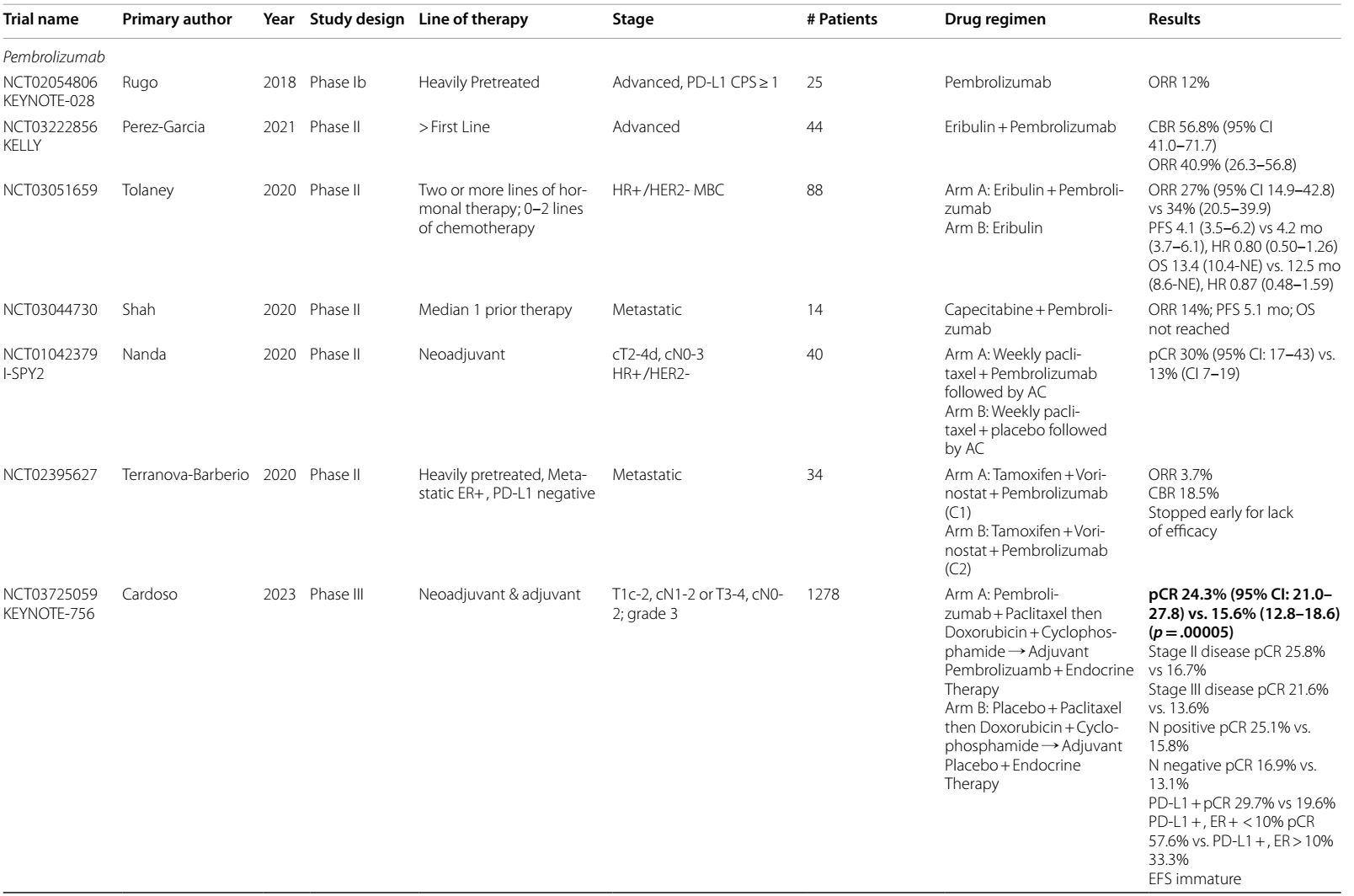
HR+/HER2 - 疾病的首个免疫治疗试验2评估了帕博利珠单抗单药治疗经大量预处理、PD-L1 CPS≥1 的转移性乳腺癌(mBC),客观缓解率(ORR)为 12%。一项针对曾接受 0-2 线化疗及至少两线内分泌治疗的患者开展的 II 期试验3,探究了化疗与免疫疗法联合使用的效果,即艾立布林±帕博利珠单抗,但该联合治疗未显示出在ORR、无进展生存期(PFS)或总生存期(OS)方面的获益。
SG——TROPiCS-2 试验
在抗体偶联药物(ADC)戈沙妥珠单抗(SG)用于三阴性乳腺癌(TNBC)取得成功后,TROPiCS-2 试验在三线或更后线治疗中,对内分泌治疗耐药的 HR+/HER2- mBC患者中,比较了 SG 与医生选择的治疗方案(TPC)。接受 SG 治疗的患者,PFS(5.5 个月 vs 4.0 个月)4和 OS(14.1 个月 vs 11.2 个月)5显著改善,这促使 FDA 于 2023 年 2 月批准 SG 用于三线或更后线治疗HR+/HER2- mBC。
SG±帕博利珠单抗——SACI-IO HR+试验
SACI-IO HR+ Ⅱ期试验6,在接受过≥1 线内分泌治疗、0-1 线化疗且在转移阶段未接受过免疫治疗或 ADC 治疗的任何 PD-L1 状态的 HR+/HER2- mBC 患者中,分析了 SG 联合或不联合帕博利珠单抗的治疗方案。联合治疗组未观察到 PFS 获益(8.1 个月 vs 6.2 个月,风险比 [HR] 0.81),中位随访 12.5 个月时OS数据尚不成熟。在 PD-L1 CPS≥1 的亚组中,SG 联合帕博利珠单抗治疗,PFS 有 4.4 个月的非显著性延长,不过OS数据尚不成熟。
Dato-DXd——Pan-Tumour 01、TROPION-Breast 01
Dato-DXd用于 HR+/HER2- mBC的研究也显示出有前景的结果。I 期Pan-Tumour 01研究7中 HR+/HER2-队列发现,在经大量预处理的患者中,Dato-DXd 单药治疗的ORR为26.8%,PFS为8.3个月。III期TROPION-Breast 01试验8,9在二线或三线治疗中,将 Dato-DXd与TPC进行比较,结果显示Dato-DXd组PFS为6.9个月,优于化疗组的4.9个月(HR 0.63),但根据新闻稿,未显示出OS获益。
其他 ADC 药物
该领域的其他ADC药物包括enfortumab vedotin,在 II 期EV-202研究10中,经大量预处理的患者使用该药后,ORR为15.6%,PFS为5.4个月;还有patritumab deruxtecan,在II期 ICARUS-BREAST-01 试验11二线治疗中,3个月ORR为 28.6%。
LAG-3 调节剂
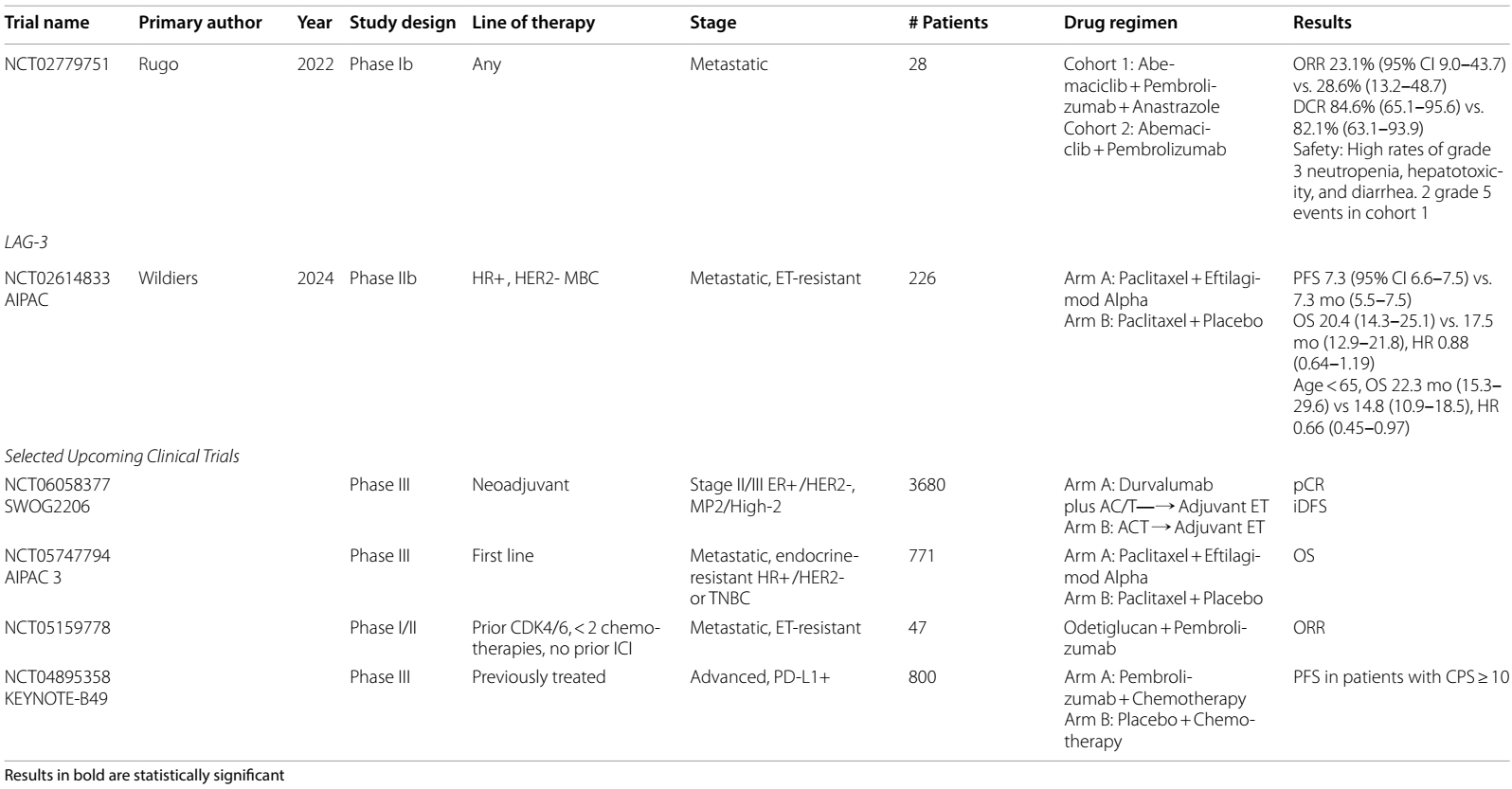
AIPAC 研究12正在探索 LAG-3 调节剂在乳腺癌中的应用。这项 II 期试验将对内分泌治疗产生耐药的 HR+/HER2- mBC 患者随机分组,分别接受紫杉醇联合LAG-3抑制剂eftilagimod alpha或单纯紫杉醇治疗。总体而言,PFS 或 OS 无显著差异,但年龄小于 65 岁的患者确实有7个月的显著 OS 获益,且治疗6个月后 CD8 计数增加的患者 OS 显著改善。
CDK4/6i+ICIs+ET
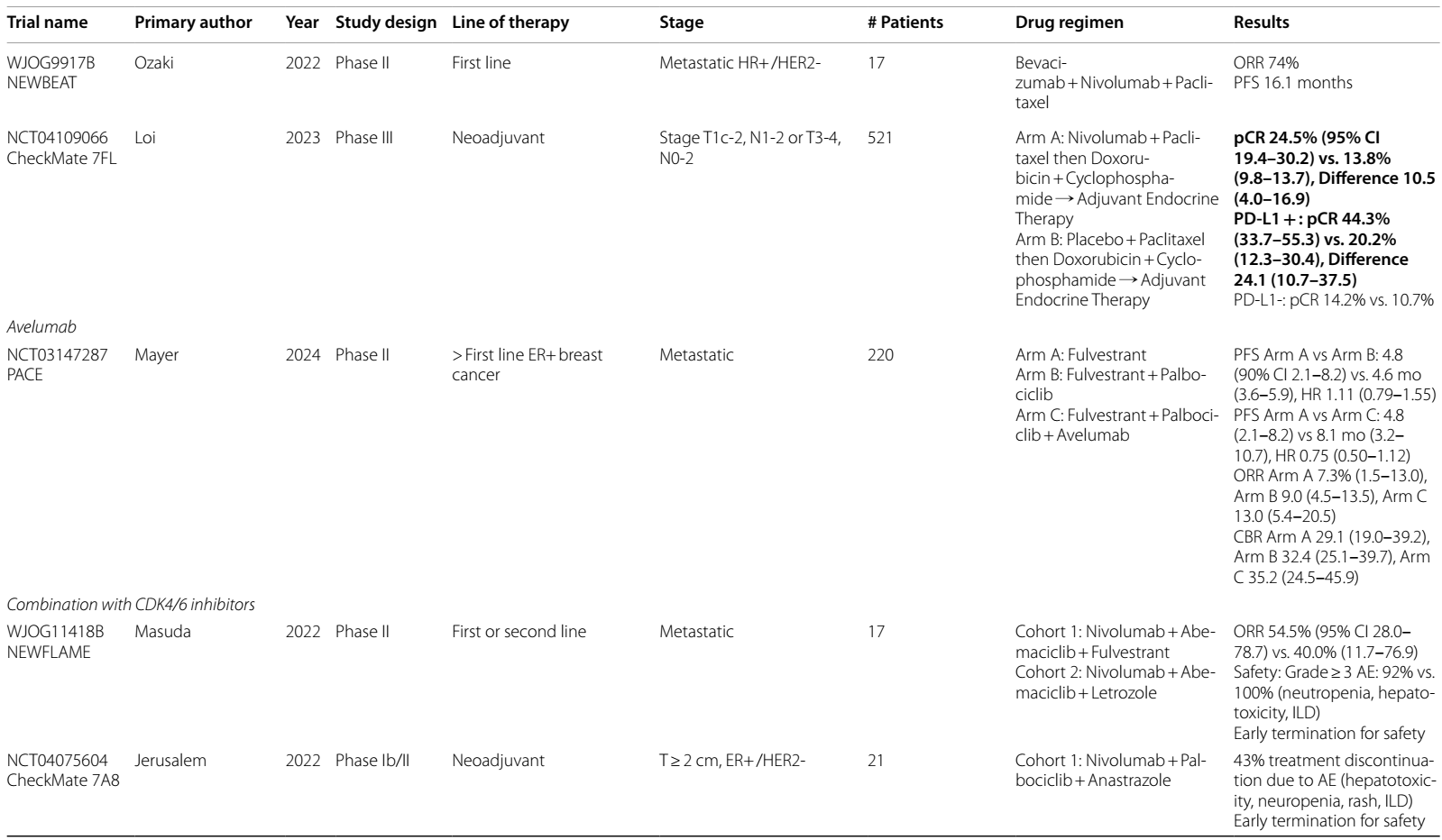
鉴于CDK4/6抑制剂(CDK4/6i)在HR+ 疾病中的明确获益,探究CDK4/6i与免疫检查点抑制剂(ICIs)联合使用的试验备受关注,但存在安全性问题。一项 1b 期研究13,在未接受过 CDK4/6i 治疗的 HR+/HER2- mBC 患者中,评估阿贝西利+帕博利珠单抗±阿那曲唑的治疗方案,一线治疗ORR为 23%,既往接受过化疗的患者ORR为 29%。在未治疗组和既往治疗组中,3级不良反应的发生率分别为69.2%和60.7%,一线治疗中发生1例5级间质性肺病 (ILD),肝毒性高于预期。
NEWFLAME II 期研究14,在HR+/HER2- mBC 一线或二线治疗中,评估纳武利尤单抗联合阿贝西利和来曲唑或氟维司群的方案。尽管入组的前 17 例患者中,来曲唑组ORR为 54.5%,氟维司群组为 40.0%,但该试验因安全性问题提前终止。超过90%的患者出现 3 级不良反应,来曲唑组有 1 例 ILD 导致的 5 级事件。
类似地,Checkmate 7A8 试验15中,新辅助纳武利尤单抗、哌柏西利和阿那曲唑治疗,43%的患者因不良反应(包括肝毒性、中性粒细胞减少、皮疹和 ILD)停止治疗后,试验终止。
PACE II 期研究16,在既往接受过 CDK4/6i 和芳香化酶抑制剂治疗后疾病进展的 HR+/HER2- mBC 患者中,探索氟维司群、氟维司群联合哌柏西利,或氟维司群联合哌柏西利和阿维鲁单抗的方案。虽然该研究旨在评估疾病进展后继续使用 CDK4/6i 的疗效,但与单独使用氟维司群相比,氟维司群联合哌柏西利和阿维鲁单抗组有 3.3 个月的非显著性 PFS 获益(HR 0.75)。3级或4级不良事件罕见,未出现上述帕博利珠单抗和纳武利尤单抗试验中的 ILD 情况。
早期HR+/HER2- 乳腺癌
新辅助/辅助帕博利珠单抗——I-SPY 2、KEYNOTE-756
尽管总体而言,HR+ 乳腺癌预后良好,但对于复发风险高的患者,仍需进行强化治疗。目前,免疫疗法联合化疗用于特定高风险亚组的治疗效果备受关注。I-SPY 2 的数据17显示,在肿瘤大小≥2.5 cm的HR +/HER2-、MammaPrint高危乳腺癌患者中,帕博利珠单抗联合紫杉醇,随后给予多柔比星和环磷酰胺 (T-AC) 可改善pCR率 (30% vs. 13%)。
在 III 期KEYNOTE-756试验18中,通过在新辅助治疗阶段将 I-SPY 2 方案与标准T-AC方案进行对比,并在辅助治疗阶段分别使用帕博利珠单抗或安慰剂联合内分泌治疗,明确了新辅助和辅助帕博利珠单抗对 3 级、高风险 ER+ 疾病的益处。该试验中76%的患者PD-L1 呈阳性。帕博利珠单抗组的 pCR 率提高了 8.5%(24.3% vs. 15.6%,p = 0.00005),在淋巴结阳性患者、CPS≥1 定义的 PD-L1阳性患者(29.7% vs. 19.6%)以及 ER 阳性率<10% 的患者中,获益更为明显。值得注意的是,在该试验中,临床医生可选择每 2 周或每 3 周给药一次。目前,EFS数据尚待评估,以明确辅助帕博利珠单抗治疗的益处。
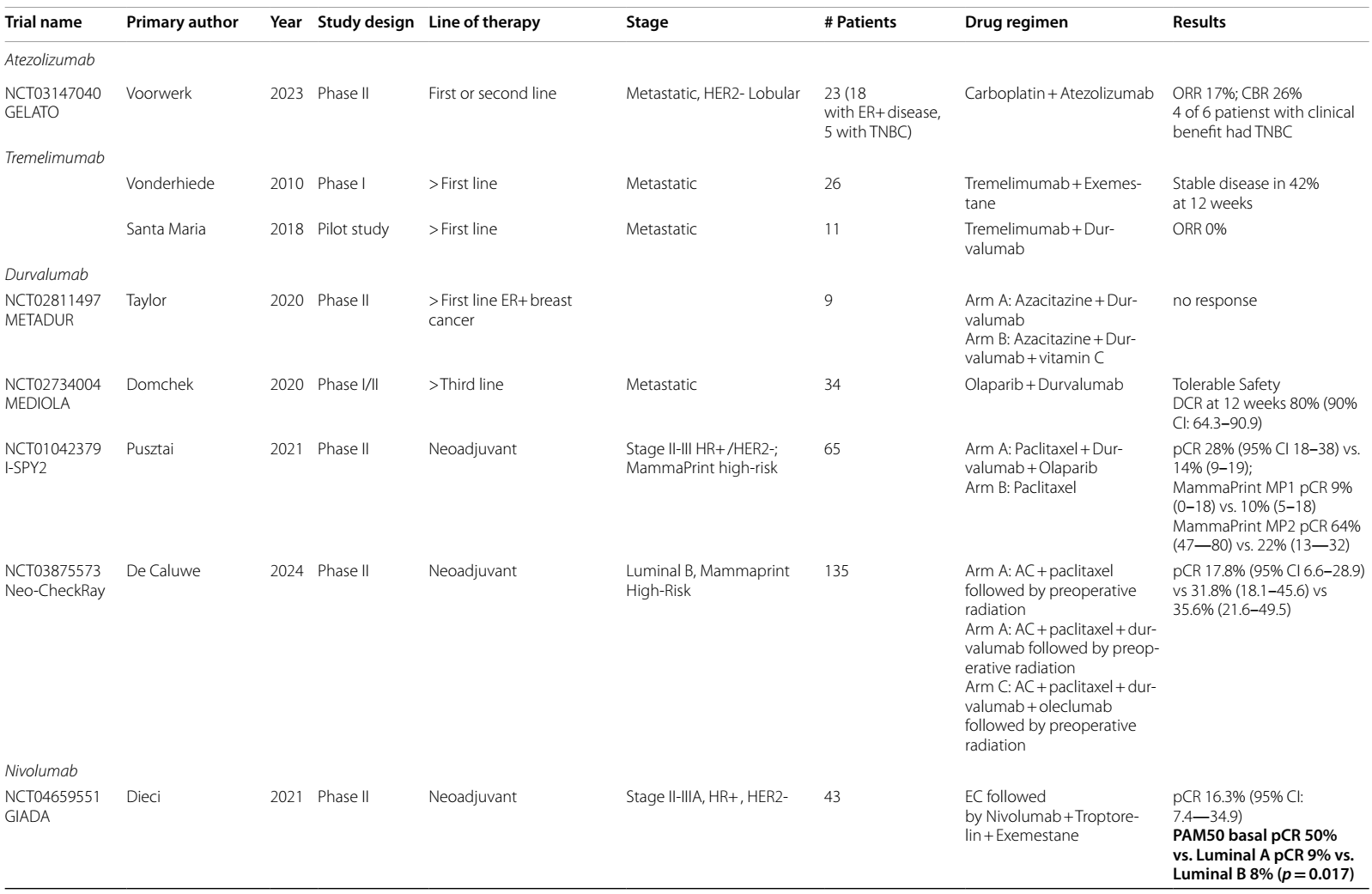
新辅助纳武利尤单抗——GIADA、Checkmate 7FL
GIADA试验19对 II - III 期管腔 B 型乳腺癌患者进行评估,发现采用表柔比星联合环磷酰胺(EC)治疗后,再使用纳武利尤单抗、曲普瑞林和依西美坦进行治疗,pCR 率达到 16.3%。
III 期 Checkmate 7FL 试验20旨在探索1278 例高风险ER+/HER2-乳腺癌患者使用新辅助和辅助纳武利尤单抗的疗效。患者被随机分配接受新辅助紫杉醇联合或不联合纳武利尤单抗,随后接受AC方案治疗,接着辅助内分泌治疗联合纳武利尤单抗或安慰剂。结果显示,pCR优势显著(24.5% vs. 13.8%),在35%的PD-L1阳性患者中优势更为突出(44.3% vs. 20.2%)。在ER<50%、PR<10% 以及TILs≥1% 的患者中也观察到 pCR 获益。该试验证实了免疫疗法对ER+乳腺癌的pCR益处。然而,基于MonarchE的数据,在阿贝西利辅助治疗获得 FDA 批准后,研究的辅助治疗部分提前停止入组,因为如上所述,由于安全性问题,CDK4/6i无法与 ICI 安全联合使用。EFS 数据待定。
I-SPY2 研究数据21还表明,新辅助度伐利尤单抗联合紫杉醇和奥拉帕利,可能使II-III期 HR+/HER2- 乳腺癌患者获益。该研究纳入了 MammaPrint 检测为高复发风险(High-1或High-2)的患者。虽然在High-1组中未观察到pCR率的差异,但在High-2疾病患者中,64% 接受免疫治疗的患者达到 pCR,而紫杉醇对照组仅为 22%。这一发现表明,MammaPrint High-2 可能是 HR+/HER2 - 早期乳腺癌免疫治疗的预测生物标志物,但仍需进一步验证。
在早期HR+/HER2- 乳腺癌中,ADC联合ICI已显示出初步潜力。I-SPY 2.2研究22针对高风险早期 HR+/HER2- 乳腺癌,采用新辅助Dato-DXd联合度伐利尤单抗治疗,总体pCR率达到 50%,免疫特征亚型患者的pCR率高达79%。
总体而言,免疫疗法或许对早期HR+/HER2- 乳腺癌有益,但鉴于该病症还有其他治疗选择,因此仍需对生物标志物展开更多研究,以便预测免疫疗法的疗效。
HR+/HER2- 乳腺癌的未来临床试验
即将开展的III期临床试验SWOG S2206(NCT06058377),将明确针对ER+/HER2- 且经MammaPrint检测为 High-2 疾病的患者,仅采用新辅助免疫疗法(不进行辅助免疫治疗)的效果。这些患者将接受度伐利尤单抗联合AC-T新辅助化疗,或仅接受AC-T化疗。
在 III 期试验AIPAC-003(NCT05747794)中,LAG-3 抑制疗法将得到进一步研究。该试验将针对内分泌治疗耐药的 HR+/HER2- mBC患者,或不符合PD-L1 治疗条件的TNBC患者,探究使用紫杉醇联合或不联合 eftilagimod alpha 的疗效。
即将开展的 SASCIA 试验(NCT04595565),将探索对于 HR+/HER2 - 乳腺癌残留病灶,使用SG进行辅助 ADC 治疗与化疗相比的效果。同时,一项试验(NCT04448886)正在评估在一线或二线转移阶段,使用 SG 联合或不联合帕博利珠单抗的疗效。
表1 ICIs在HR+乳腺癌中当前和即将进行的临床试验
相关阅读:免疫疗法新征程:解锁乳腺癌治疗的多元密码
1. Heater NK, Warrior S, Lu J. Current and future immunotherapy for breast cancer. J Hematol Oncol. 2024 Dec 25;17(1):131. doi: 10.1186/s13045-024-01649-z.
2. Rugo HS, Delord J-P, Im S-A, et al. Safety and antitumor activity of pembrolizumab in patients with estrogen receptor–positive/human epidermal growth factor receptor 2–negative advanced breast cancer. Clin Cancer Res. 2018;24(12):2804–11.
3. Tolaney SM, Barroso-Sousa R, Keenan T, et al. Effect of Eribulin with or without pembrolizumab on progression-free survival for patients with hormone receptor-positive, ERBB2-negative metastatic breast cancer. JAMA Oncol. 2020;6(10):1598.
4. Rugo HS, Bardia A, Marmé F, et al. Sacituzumab govitecan in hormone receptor–positive/human epidermal growth factor receptor 2–negative metastatic breast cancer. J Clin Oncol. 2022;40(29):3365–76.
5. Rugo HS, Bardia A, Marmé F, et al. Overall survival with sacituzumab govitecan in hormone receptor-positive and human epidermal growth factor receptor 2-negative metastatic breast cancer (TROPiCS-02): a randomised, open-label, multicentre, phase 3 trial. The Lancet. 2023;402(10411):1423–33.
6. Garrido-Castro AC, Kim SE, Desrosiers J, et al. SACI-IO HR+: A randomized phase II trial of sacituzumab govitecan with or without pembrolizumab in patients with metastatic hormone receptor-positive/HER2-negative breast cancer. J Clin Oncol. 2024;42(17_suppl):LBA1004–LBA1004. 10.1200/JCO.2024.42.17_suppl.LBA1004.
7. Bardia A, Krop IE, Kogawa T, et al. Datopotamab deruxtecan in advanced or metastatic HR+/HER2– and triple-negative breast cancer: results from the phase I TROPION-pantumor01 study. J Clin Oncol. 2024;42(19):2281–94.
8. Bardia A, Jhaveri K, Im SA, et al. LBA11 Datopotamab deruxtecan (Dato-DXd) vs chemotherapy in previously-treated inoperable or metastatic hormone receptor-positive, HER2-negative (HR+/HER2–) breast cancer (BC): Primary results from the randomised phase III TROPION-Breast01 trial. Ann Oncol. 2023;34:S1264–5.
9. Datopotamab deruxtecan final overall survival results reported in patients with metastatic HR-positive, HER2-low or negative breast cancer in TROPION-Breast01 Phase III trial [press release]. AstraZeneca, Spetember, 23, 2024.
10. Giordano A, Awan AAA, Bruce JY, et al. Enfortumab vedotin (EV) in triple-negative breast cancer (TNBC) and HR+/HER2- breast cancer (BC) cohorts of EV-202. J Clin Oncol. 2024;42(16_suppl):1005–1005. 10.1200/JCO.2024.42.16_suppl.1005.
11. Pistilli B, Ibrahimi N, Lacroix-Triki M, et al. 189O A phase II study of patritumab deruxtecan (HER3-DXd), in patients (pts) with advanced breast cancer (ABC), with biomarker analysis to characterize response to therapy (ICARUS-BREAST01). ESMO Open. 2023;8(1):101378.
12. Wildiers H, Armstrong A, Cuypere E, et al. Paclitaxel plus Eftilagimod Alpha, a Soluble LAG-3 Protein, in Metastatic, HR+ Breast Cancer: Results from AIPAC, a Randomized, Placebo Controlled Phase IIb Trial. Clin Cancer Res. 2024;30(3):532–41.
13. Rugo HS, Peter Kabos J, Beck T, et al. Abemaciclib in combination with pembrolizumab for HR+, HER2− metastatic breast cancer: Phase 1b study. npj Breast Cancer. 2022. 10.1038/s41523-022-00482-2.
14. Masuda J, Sakai H, Tsurutani J, et al. Efficacy, safety, and biomarker analysis of nivolumab in combination with abemaciclib plus endocrine therapy in patients with HR-positive HER2-negative metastatic breast cancer: a phase II study (WJOG11418B NEWFLAME trial). J Immunother Cancer. 2023;11(9):e007126.
15. Jerusalem G, Prat A, Salgado R, et al. Neoadjuvant nivolumab + palbociclib + anastrozole for oestrogen receptor-positive/human epidermal growth factor receptor 2-negative primary breast cancer: results from CheckMate 7A8. The Breast. 2023;72:103580.
16. Mayer EL, Ren Y, Wagle N, et al. PACE: a randomized phase II study of fulvestrant, palbociclib, and avelumab after progression on cyclin-dependent kinase 4/6 inhibitor and aromatase inhibitor for hormone receptor–positive/human epidermal growth factor receptor-negative metastatic breast. J Clin Oncol. 2024;42(17):2050–60.
17. Nanda R, Liu MC, Yau C, et al. Effect of pembrolizumab plus neoadjuvant chemotherapy on pathologic complete response in women with early-stage breast cancer. JAMA Oncol. 2020;6(5):676.
18. Cardoso F, O’Shaughnessy J, McArthur H, et al. Abstract GS01-02: Phase 3 study of neoadjuvant pembrolizumab or placebo plus chemotherapy, followed by adjuvant pembrolizumab or placebo plus endocrine therapy for early-stage high-risk ER+/HER2− breast cancer: KEYNOTE-756. Cancer Res. 2024;84(9_Supplement):GS01-02-GS01-02. 10.1158/1538-7445.SABCS23-GS01-02.
19. Dieci MV, Guarneri V, Tosi A, et al. Neoadjuvant chemotherapy and immunotherapy in luminal B-like breast cancer: results of the phase II GIADA trial. Clin Cancer Res. 2022;28(2):308–17.
20. Loi S, Curigliano G, Salgado R, et al. Abstract GS01-01: Biomarker results in high-risk estrogen receptor positive, human epidermal growth factor receptor 2 negative primary breast cancer following neoadjuvant chemotherapy ± nivolumab: an exploratory analysis of CheckMate 7FL. Cancer Res. 2024;84(9_Supplement):GS01-01-GS01-01. 10.1158/1538-7445.SABCS23-GS01-01.
21. Pusztai L, Yau C, Wolf DM, et al. Durvalumab with olaparib and paclitaxel for high-risk HER2-negative stage II/III breast cancer: results from the adaptively randomized I-SPY2 trial. Cancer Cell. 2021;39(7):989-98.e5.
22. Trivedi MS, Shatsky RA, Nanda R, et al. LBA15 Rates of pathologic complete response (pCR) after datopotamab deruxtecan (Dato) plus durvalumab (Durva) treatment strategy in the neoadjuvant setting: results from the I-SPY 2.2 trial. Annals of Oncol. 2024;35:S1208–9. 10.1016/j.annonc.2024.08.2253.
排版编辑:肿瘤资讯-Jina











 苏公网安备32059002004080号
苏公网安备32059002004080号


