

摘要
胃癌肝转移的总体发生率约为9.9%~18.7%,异质性大,患者5年生存率<20%,尤其是甲胎蛋白阳性胃癌和胃肝样腺癌伴肝转移患者预后更差。目前美国国家综合癌症网络和日本胃癌学会均未制定专门针对此类患者系统完善的诊疗策略。本文就胃癌肝转移的分类、诊断(血清学、影像学、病理学)、治疗(手术、药物)等方面作一系统综述。
背景
与日本、韩国相比,我国胃癌患者分期更晚,许多患者在初诊时已存在肝脏、腹膜等远处转移。胃癌肝转移(gastric cancer with liver metastasis,GCLM)多通过血行传播,总体发生率为9.9%~18.7%[1]。与结直肠癌肝转移不同,GCLM的预后更差,应引起足够的重视,目前301医院陈凛教授牵头开展的全国多中心RECORD研究旨在探究我国GCLM患者的流行病学情况。现阶段胃癌指南推荐的主要治疗方法是减瘤手术、化疗、介入等姑息治疗。近10年来,胃癌的治疗在化疗、靶向治疗和免疫治疗方面均取得了一定的进展,但是REGONIVO研究表明肝转移对免疫治疗敏感性较淋巴结或者肺转移更差[2],无法切除的GCLM等晚期胃癌患者的中位生存期(overall survival,OS)仅为4~14.3个月[3,4],其中甲胎蛋白(alpha fetoprotein,AFP)阳性胃癌和胃肝样腺癌患者更易发生肝转移,预后尤其差[5,6]。GCLM的治疗模式仍处在探索阶段,各国的胃癌指南对于GCLM的诊疗标准不尽相同,本文围绕近年来国内外GCLM的诊疗现状进行系统综述。
总结与展望
GCLM异质性大且预后差,尤其是AFP阳性胃癌和胃肝样腺癌伴发肝转移,整体治疗效果不佳。制定合适的标准对GCLM进一步分类,积累特定GCLM患者手术获益的数据,探索出可能适合手术的GCLM患者的基线特征,分类探索最佳的治疗方案是未来的主要研究方向。未来,随着多学科诊疗模式的广泛实施,治疗药物的不断更新,大型临床研究数据的不断涌现,GCLM患者的治疗获益必然会更加显著。
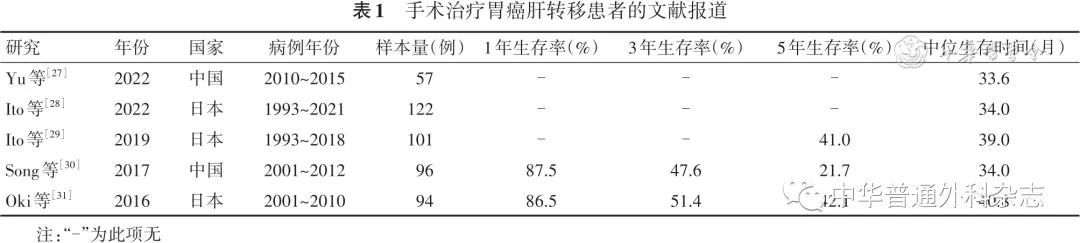
[1] CheonSH, RhaSY, JeungHC, et al. Survival benefit of combined curative resection of the stomach (D2 resection) and liver in gastric cancer patients with liver metastases[J]. Ann Oncol, 2008, 19(6): 1146-1153. DOI: 10.1093/annonc/mdn026.
[2] YukamiH, KawazoeA, LinYT, et al. Updated
efficacy outcomes of anti-PD-1 antibodies plus multikinase inhibitors
for patients with advanced gastric cancer with or without liver
metastases in clinical trials[J]. Clin Cancer Res, 2022, 28(16): 3480-3488. DOI: 10.1158/1078-0432.CCR-22-0630.
[3] LiuT, BaiY, LinX, et al. First-line
nivolumab plus chemotherapy vs chemotherapy in patients with advanced
gastric, gastroesophageal junction and esophageal adenocarcinoma:
CheckMate 649 Chinese subgroup analysis[J]. Int J Cancer, 2023, 152(4):749-760. DOI: 10.1002/ijc.34296.
[4] BangYJ, Van CutsemE, FeyereislovaA, et al. Trastuzumab
in combination with chemotherapy versus chemotherapy alone for
treatment of HER2-positive advanced gastric or gastro-oesophageal
junction cancer (ToGA): a phase 3, open-label, randomised controlled
trial[J]. Lancet, 2010, 376(9742): 687-697. DOI: 10.1016/S0140-6736(10)61121-X.
[5] 徐开盛,李永柏,黄进堂,等. 甲胎蛋白阳性胃癌的临床病理特征与预后分析[J]. 中华普通外科杂志, 2021, 36(8):585-590. DOI: 10.3760/cma.j.cn113855-20210411-00236.
[6] 戴伟钢,刘大伟,吴晖,等. 胃肝样腺癌临床病理特征及预后分析[J]. 中华普通外科杂志, 2018, 33(1):11-15. DOI: 10.3760/cma.j.issn.1007-631X.2018.01.004.
[7] ThelenA, JonasS, BenckertC, et al. Liver resection for metastatic gastric cancer[J]. Eur J Surg Oncol, 2008, 34(12): 1328-1334. DOI: 10.1016/j.ejso.2008.01.022.
[8] KroeseTE, van HillegersbergR, SchoppmannS, et al. Definitions and treatment of oligometastatic oesophagogastric cancer according to multidisciplinary tumour boards in Europe[J]. Eur J Cancer, 2022, 164(1): 18-29. DOI: 10.1016/j.ejca.2021.11.032.
[9] DangHZ, YuY, JiaoSC. Prognosis of HER2 over-expressing gastric cancer patients with liver metastasis[J]. World J Gastroenterol, 2012, 18(19):2402-2407.DOI: 10.3748/wjg.v18.i19.2402.
[10] LiuX, ShengW, WangY. An
analysis of clinicopathological features and prognosis by comparing
hepatoid adenocarcinoma of the stomach with AFP-producing gastric cancer[J]. J Surg Oncol, 2012, 106(3): 299-303. DOI: 10.1002/jso.23073.
[11] 王雅坤,沈琳,张小田. 70例血清甲胎蛋白升高晚期胃癌患者的临床病理特征及预后[J]. 中华肿瘤杂志, 2017, 39(7):514-517. DOI: 10.3760/cma.j.issn.0253-3766.2017.07.007.
[12] 茅翔,罗奋,陈宗祐,等. 提高对胃肝样腺癌和产甲胎蛋白胃癌的认识[J]. 中华肿瘤杂志, 2015(6):401-403. DOI: 10.3760/cma.j.issn.0253-3766.2015.06.001.
[13] QuBG, BiWM, QuBT, et al. PRISMA-compliant
article: clinical characteristics and factors influencing prognosis of
patients with hepatoid adenocarcinoma of the stomach in china[J]. Medicine, 2016, 95(15): e3399. DOI: 10.1097/MD.0000000000003399.
[14] TsurumaruD, NishimutaY, MurakiT, et al. Gastric
cancer with synchronous and metachronous hepatic metastasis predicted
by enhancement pattern on multiphasic contrast-enhanced CT[J]. Eur J Radiol, 2018, 108(2): 165-171. DOI: 10.1016/j.ejrad.2018.09.030.
[15] PangY, ZhaoL, LuoZ, et al. Comparison of 68Ga-FAPI and 18F-FDG uptake in gastric, duodenal, and colorectal cancers[J]. Radiology, 2021, 298(2): 393-402. DOI: 10.1148/radiol.2020203275.
[16] YasakaK, AkaiH, AbeO, et al. Deep
learning with convolutional neural network for differentiation of liver
masses at dynamic contrast-enhanced CT: a preliminary study[J]. Radiology, 2018, 286(3): 887-896. DOI: 10.1148/radiol.2017170706.
[17] ZhouN, LiuC, GuoX, et al. Impact of 68Ga-NOTA-MAL-MZHER2 PET imaging in advanced gastric cancer patients and therapeutic response monitoring[J]. Eur J Nucl Med Mol Imaging, 2021, 48(1): 161-175. DOI: 1007/s00259-020-04898-5.
[18] ZhengDX, MengSC, LiuQJ, et al. Predicting
liver metastasis of gastrointestinal tract cancer by diffusion-weighted
imaging of apparent diffusion coefficient values[J]. World J Gastroenterol, 2016, 22(10): 3031-3037. DOI: 10.3748/wjg.v22.i10.3031.
[19] BraadlandPR, GiskeødegårdG, SandsmarkE, et al. Ex vivo metabolic fingerprinting identifies biomarkers predictive of prostate cancer recurrence following radical prostatectomy[J]. Br J Cancer, 2017, 117(11): 1656-1664. DOI: 10.1038/bjc.2017.346.
[20] HammCA, WangCJ, SavicLJ, et al. Deep learning for liver tumor diagnosis part I: development of a convolutional neural network classifier for multi-phasic MRI[J]. Eur Radiol, 2019, 29(7): 3338-3347. DOI: 10.1007/s00330-019-06205-9.
[21] StrobelD, BernatikT, BlankW, et al. Diagnostic
accuracy of CEUS in the differential diagnosis of small (≤20 mm) and
subcentimetric (≤10 mm) focal liver lesions in comparison with
histology:results of the DEGUM multicenter trial[J]. Ultraschall Med, 2011, 32(6): 593-597. DOI: 10.1055/s-0031-1271114.
[22] AritaJ, OnoY, TakahashiM, et al. Routine
preoperative liver-specific magnetic resonance imaging does not exclude
the necessity of contrast-enhanced intraoperative ultrasound in hepatic
resection for colorectal liver metastasis[J]. Ann Surg, 2015, 262(6): 1086-1091. DOI: 10.1097/sla.0000000000001085.
[23] JiangJ, DingY, LuJ, et al. Integrative
analysis reveals a clinicogenomic landscape associated with liver
metastasis and poor prognosis in hepatoid adenocarcinoma of the stomach[J]. Int J Biol Sci, 2022, 18(14): 5554-5574. DOI: 10.7150/ijbs.71449.
[24] 周永清,陈旭,丁海斌. 胃癌患者中TRAP1、Ki-67、AFP的表达及其联合预测胃癌肝转移的价值[J]. 实用癌症杂志, 2016, 31(9):1412-1413. DOI: 10.3969/j.issn.1001-5930.2016.09.007.
[25] GaranciniM, UggeriF, DegrateL, et al. Surgical treatment of liver metastases of gastric cancer: is local treatment in a systemic disease worthwhile?[J]. HPB (Oxford), 2012, 14(3): 209-215. DOI: 10.1111/j.1477-2574.2011.00428.x.
[26] MarkarSR, MikhailS, MalietzisG, et al. Influence
of surgical resection of hepatic metastases from gastric adenocarcinoma
on long-term survival: systematic review and pooled analysis[J]. Ann Surg, 2016, 263(6): 1092-1101. DOI: 10.1097/SLA.0000000000001542.
[27] YuP, YuPF, JiangZ, et al. Comparison
of surgical resection combined with chemotherapy and palliative
chemotherapy for synchronous hepatic metastases from gastric cancer[J]. J Clin Oncol, 2022, 40(16 suppl): e16041 . DOI: 10.1200/JCO.2022.40.16_suppl.e16041.
[28] ItoH, TakemuraN, ObaA, et al. Trends
in long-term survival after liver resection for gastric cancer liver
metastasis: analysis of a single-center experience over 28 years[J]. J Clin Oncol, 2022, 40(4 suppl): 290-290. DOI: 10.1200/JCO.2022.40.4_suppl.290.
[29] ItoH, TakemuraN, OnoY, et al. Gastric cancer liver metastasis: optimal management for oligo-metastatic disease[J]. J Clin Oncol, 2019, 37(4 suppl): 136. DOI: 10.1200/jco.2019.37.4_suppl.136.
[30] SongA, ZhangX, YuF, et al. Surgical resection for hepatic metastasis from gastric cancer: a multi- institution study[J]. Oncotarget, 2017, 8(41): 71147-71153. DOI: 10.18632/oncotarget.16705.
[31] OkiE, TokunagaS, EmiY, et al. Surgical treatment of liver metastasis of gastric cancer: a retrospective multicenter cohort study (KSCC1302)[J]. Gastric Cancer, 2016, 19(3): 968-976. DOI: 10.1007/s10120-015-0530-z.
[32] MarteG, TufoA, SteccanellaF, et al. Efficacy
of surgery for the treatment of gastric cancer liver metastases: a
systematic review of the literature and meta-analysis of prognostic
factors[J]. J Clin Med, 2021, 10(5): 1141. DOI: 10.3390/jcm10051141.
[33] LiaoYY, PengNF, LongD, et al. Hepatectomy for liver metastases from gastric cancer: a systematic review[J]. BMC Surg, 2017, 17(1): 14. DOI: 10.1186/s12893-017-0215-0.
[34] ZhouF, YuXL, LiangP, et al. Microwave ablation is effective against liver metastases from gastric adenocarcinoma[J]. Int J Hyperther, 2017, 33(7): 830-835. DOI: 10.1080/02656736.2017.1306120.
[35] LindbladKE, LujambioA. Liver metastases inhibit immunotherapy efficacy[J]. Nat Med, 2021, 27(1): 25-27. DOI: 10.1038/s41591-020-01190-9.
[36] MontagnaniF, CrivelliF, AprileG, et al. Long-term survival after liver metastasectomy in gastric cancer: systematic review and meta-analysis of prognostic factors[J]. Cancer Treat Rev, 2018, 69: 11-20. DOI: 10.1016/j.ctrv.2018.05.010.
[37] FukamiY, KaneokaY, MaedaA, et al. Adjuvant hepatic artery infusion chemotherapy after hemihepatectomy for gastric cancer liver metastases[J]. Int J Surg, 2017, 46(1): 79-84. DOI: 10.1016/j.ijsu.2017.08.578.
[38] Al-BatranSE, HomannN, PauligkC, et al. Effect
of neoadjuvant chemotherapy followed by surgical resection on survival
in patients with limited metastatic gastric or gastroesophageal junction
cancer: the AIO-FLOT3 trial[J]. JAMA Oncol, 2017, 3(9): 1237-1244. DOI: 10.1001/jamaoncol.2017.0515.
[39] 黄和,陈其余,周磊,等. XELOX方案联合肝动脉化疗栓塞治疗胃癌伴肝转移的有效性与安全性[J]. 中华普通外科杂志, 2019, 34(12):1048-1051. DOI: 10.3760/cma.j.issn.1007-631X.2019.12.009.
[40] ZhuXD, HuangMZ, WangYS, et al. XELOX
doublet regimen versus EOX triplet regimen as first-line treatment for
advanced gastric cancer: an open-labeled, multicenter, randomized,
prospective phase Ⅲ trial (EXELOX)[J]. Cancer Commun (Lond), 2022, 42(4): 314-326. DOI: 10.1002/cac2.12278.
[41] KroeseTE, TakahashiY, LordickF, et al. Liver oligometastatic disease in synchronous metastatic gastric cancer patients: a nationwide population-based cohort study[J]. Eur J Cancer, 2023, 179:65-75. DOI: 10.1016/j.ejca.2022.11.01.
[42] YoonHH, JinZ, KourO, et al. Association
of PD-L1 expression and other variables with benefit from immune
checkpoint inhibition in advanced gastroesophageal cancer: systematic
review and meta-analysis of 17 phase 3 randomized clinical trials[J]. JAMA Oncol, 2022, 8(10):1456-1465. DOI: 10.1001/jamaoncol.2022.3707.
[43] JanjigianYY, KawazoeA, YañezP, et al. The keynote-811 trial of dual PD-1 and HER2 blockade in HER2-positive gastric cancer[J]. Nature, 2021, 600(7890): 727-730. DOI: 10.1038/s41586-021-04161-3.
[44] LiangH, LiZ, HuangZ, et al. Prognostic
characteristics and clinical response to immunotherapy targeting
programmed cell death 1 for patients with advanced gastric cancer with
liver metastases[J]. Front Immunol, 2022, 13: 1015549. DOI: 10.3389/fimmu.2022.1015549.











 苏公网安备32059002004080号
苏公网安备32059002004080号


