对于早期高危HR阳性乳腺癌患者,应用CDK4/6抑制剂联合方案具有显著获益。然而,真实世界研究显示CDK4/6抑制剂对BRCA突变的HR阳性/HER2阴性乳腺癌患者疗效不佳,并且CDK4/6抑制剂联合方案暂无针对BRCA突变人群的单独分析。OlympiA研究是目前唯一治疗gBRCA1/2突变、HER2阴性高危早期乳腺癌的首个且唯一取得OS获益的III期临床研究,且安全性良好。本期特邀哈尔滨医科大学附属肿瘤医院黄元夕教授针对gBRCA突变、HR阳性/HER2阴性乳腺癌患者的辅助治疗方案进行了深入探讨,以飨读者。
早期高危HR阳性乳腺癌患者应用OFS+AI/TAM+CDK4/6抑制剂
具有显著获益
乳腺癌是全球女性最常见的恶性肿瘤之一,其中HR阳性/HER2阴性乳腺癌约占所有乳腺癌的70%[1]。内分泌治疗是HR阳性乳腺癌患者主要的全身治疗手段。乳腺癌的内分泌治疗经历了百年发展历史,他莫昔芬(SERM)、来曲唑/阿那曲唑(AI)、氟维司群(SERD)等是乳腺癌内分泌治疗的基本药物。尽管传统内分泌单药治疗HR阳性早期乳腺癌患者获益显著,但仍有部分患者面临较高的复发风险,因此需要通过强化治疗以进一步改善预后。随着临床试验提供的循证医学证据不断更新,在卵巢功能抑制(OFS)和传统内分泌治疗的基础上,联合CDK4/6抑制剂治疗进一步降低了HR阳性早期乳腺癌患者的复发风险。
monarchE研究[2]是首个CDK4/6抑制剂阿贝西利在HR阳性/HER2阴性高复发风险早期乳腺癌辅助治疗中获得阳性结果的临床研究。该研究是一项全球Ⅲ期临床研究,共纳入5637例HR阳性/HER2阴性高危早期乳腺癌患者,研究按照患者的高危分层特征分为两个队列(队列1:基于临床病理学特征的高危或≥4枚淋巴结(ALN)阳性;1~3枚ALN阳性且满足以下至少1项:G3,T≥5cm;队列2:基于Ki-67增殖指数的高危:1~3枚ALN阳性和Ki-67增殖指数≥20%且G1~2且浸润癌大小<5cm)。所有患者按1∶1比例随机分组,分别接受2 年疗程的CDK4/6抑制剂阿贝西利联合5~10年标准内分泌治疗或单独5~10年标准内分泌治疗。2023年ESMO大会公布了该研究的5年数据,结果显示,联合阿贝西利使辅助治疗持续获益,5 年iDFS率的绝对获益达7.6%(HR=0.680,95% CI:0.599~0.772,P<0.001),5年无远处复发(DRFS)绝对获益达6.7%(HR=0.675,95% CI:0.588~0.774; P<0.001),且阿贝西利组的死亡人数更少。2024年ESMO BC年会上,monarchE研究公布了基于携带gBRCA1/2突变和不常见体细胞变异人群的探索性分析结局[3],研究结果显示,与单独接受内分泌治疗相比,接受辅助阿贝西利联合内分泌治疗的携带gBRCA1/2突变的患者发生的iDFS事件较少(1例,5%)。然而,鉴于样本量小且事件数量有限,HR的估计值具有高度变异性,可能会随时间而变化,因此应谨慎解读。
NATALEE研究[4]聚焦另一种CDK4/6抑制剂瑞波西利在HR阳性/HER2阴性早期乳腺癌患者辅助强化治疗中的疗效及安全性。该研究纳入患者范围更广泛[包括ⅡA期:N0(G3,G2伴Ki-67增殖指数≥20%或多基因检测高危) 或N1;ⅡB期:N0或N1;Ⅲ期:N0、N1、N2或 N3],包含约44%的绝经前患者,主要终点为iDFS。该研究结果显示,与对照组相比, 瑞波西利联合非甾体类AI和戈舍瑞林组意向治疗(ITT)人群的iDFS获益差异有统计学意义(P<0.05),3年iDFS率的绝对获益率为3.3%,最终iDFS分析[5]表明,瑞波西利联合非甾体类AI和戈舍瑞林组3年iDFS持续稳健获益(90.7%vs87.6%,HR 0.749,95% CI,0.628-0.892);并且各关键亚组的iDFS获益与ITT人群 一致,与疾病分期、淋巴结累及、绝经状态、年龄和Ki-67增殖指数无关。NATALEE研究结果支持将瑞波西利联合内分泌治疗±戈舍瑞林作为Ⅱ期或Ⅲ期HR阳性/HER2阴性早期乳腺癌复发风险患者 (包括淋巴结阴性疾病患者)的新治疗选择。
真实世界研究显示CDK4/6抑制剂
对BRCA突变的HR阳性/HER2阴性乳腺癌
患者疗效不佳
一项在2011年1月至2022年6月Flatiron健康数据存储库中收集的接受CDK4/6抑制剂+ET一线治疗的HR阳性/HER2阴性转移性乳腺癌患者中进行的回顾性队列研究[6]结果显示:接受一线CDK4/6抑制剂 + ET的BRCA突变的转移性乳腺癌患者的mPFS显著差于BRCA野生型或未知BRCA状态患者。
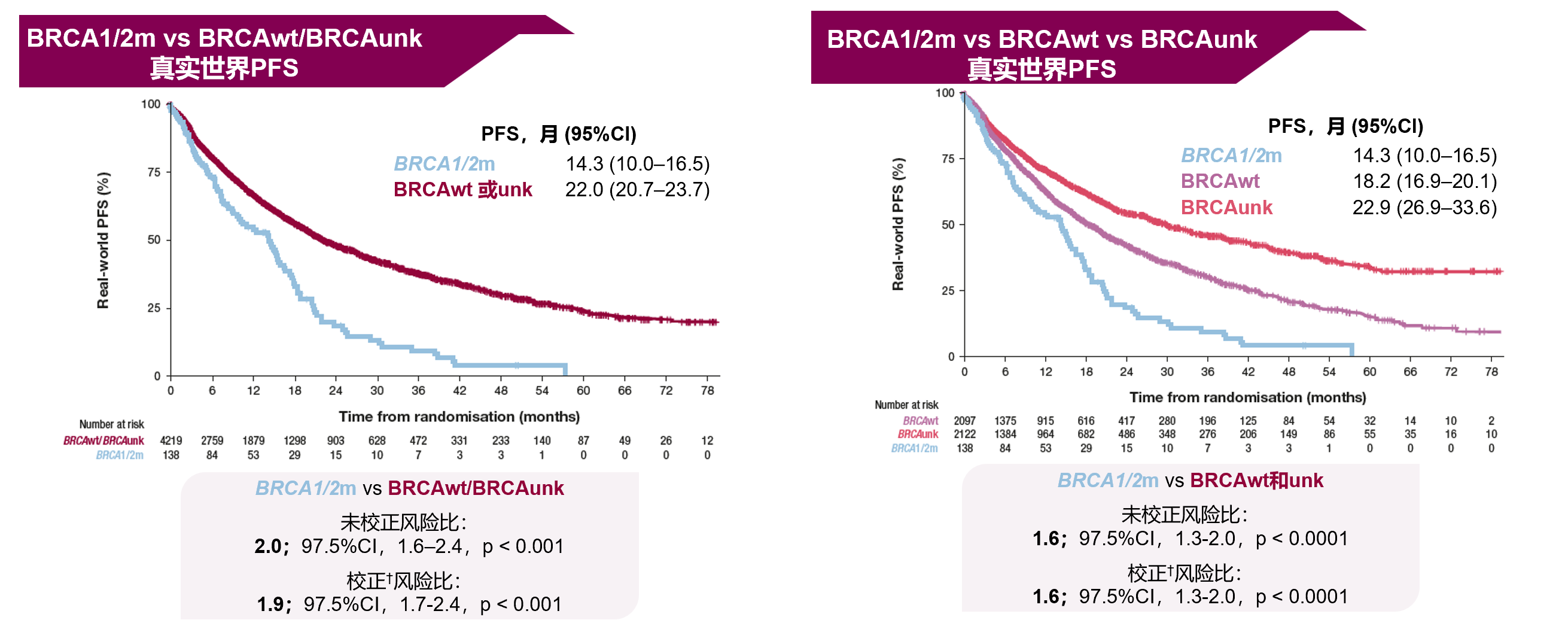
ET+CDK4/6抑制剂针对BRCA突变人群
的疗效尚待更多研究验证
monarchE研究和NATALEE研究初步数据均未显示出OS获益。并且monarchE研究的患者量较少,限制了对gBRCA1/2和不常见体细胞变异统计显著性评估的准确性。而NATALEE研究未纳入gBRCA1/2突变人群,目前尚不清楚gBRCA突变携带者是否能从瑞波西利治疗中获得与BRCA野生型患者相同的益处。
OlympiA研究是目前唯一治疗gBRCA1/2突变、HER2阴性高危早期乳腺癌的
首个且唯一取得OS获益的
III期临床研究,且安全性良好
OlympiA研究[7]是一项双盲、随机对照、国际多中心的Ⅲ期临床研究,共纳入1836例 HER2阴性、gBRCA突变的高复发风险早期乳腺癌患者,在完成新辅助治疗或辅助治疗以及局部治疗后被随机分配接受奥拉帕利或安慰剂治疗1年。主要终点是无浸润性疾病生存率。
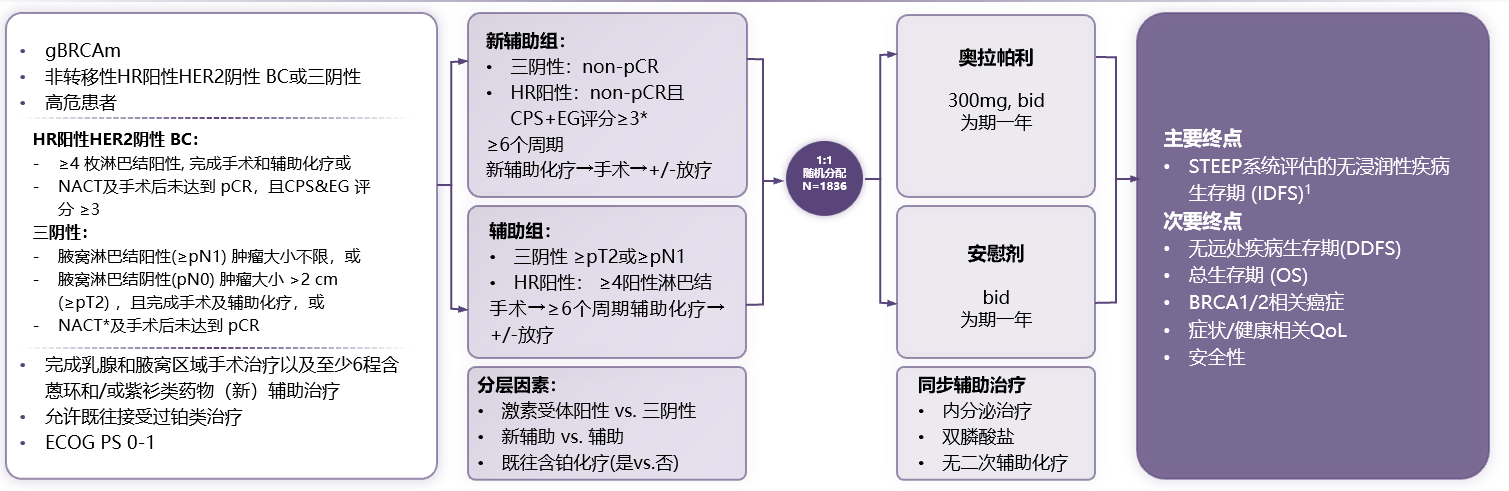
图2:OlympiA研究设计
基线数据显示,奥拉帕利组中患者的中位年龄为42岁;根据激素受体状态分类,奥拉帕利组中HR阳性/HER2阴性乳腺癌占比为18.2%。

奥拉帕利组显著改善gBRCA突变、HER2阴性早期乳腺癌患者的3年iDFS(85.9% vs 77.1%),降低浸润性疾病复发或死亡风险42%(HR=0.58,P<0.001),达到了研究的主要终点。奥拉帕利组显著改善gBRCA突变、HER2阴性早期乳腺癌患者的3年DDFS(87.5% vs. 80.4%),降低远处疾病复发或死亡风险43%(HR=0.57,P < 0.01)。此外,两组4年OS率分别为89.8% vs 86.4%(HR=0.68;P=0.01),奥拉帕利显著降低32%的死亡风险[8]。
亚组分析结果显示:在研究分层因素和预设亚组中,奥拉帕利的获益均与总体分析人群一致。其中,在携带gBRCA突变的HR阳性患者中,奥拉帕利组和对照组的4年OS率分别为88.1% vs 86.3%(HR=0.90;95% CI 0.45~1.78);4年iDFS率分别为80.1% vs 76.6%(HR=0.68;95% CI 0.40~1.13);4年DDFS率分别为82.1% vs 77.7%(HR=0.69;95% CI 0.40~1.18)。
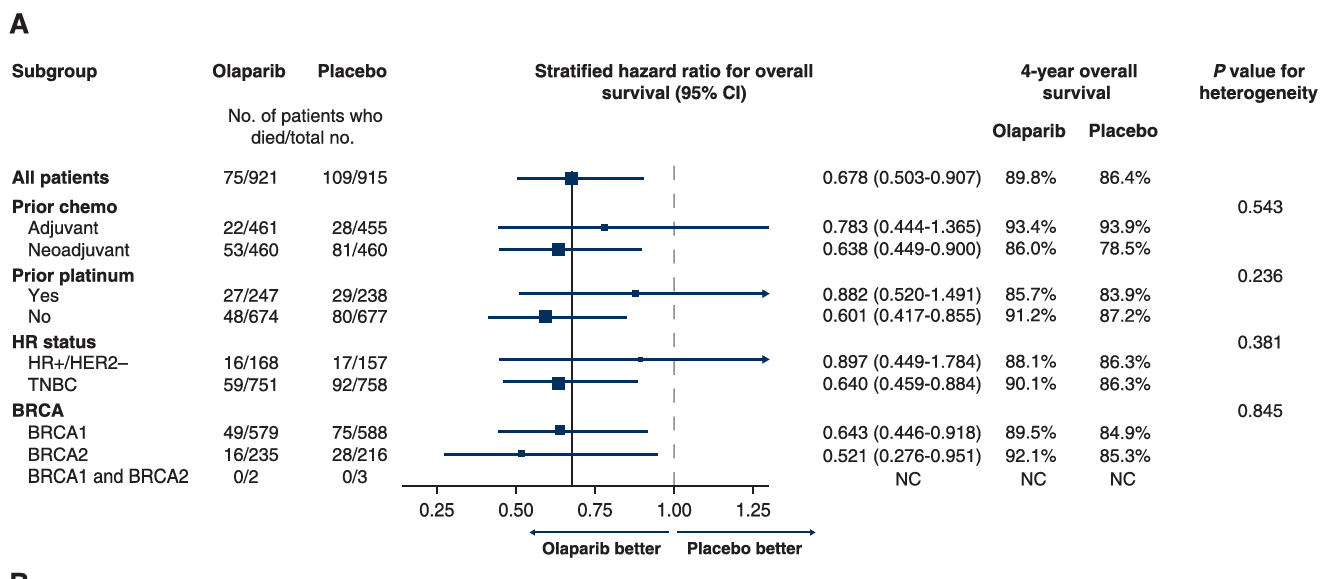 图4:4年OS的亚组分析
图4:4年OS的亚组分析
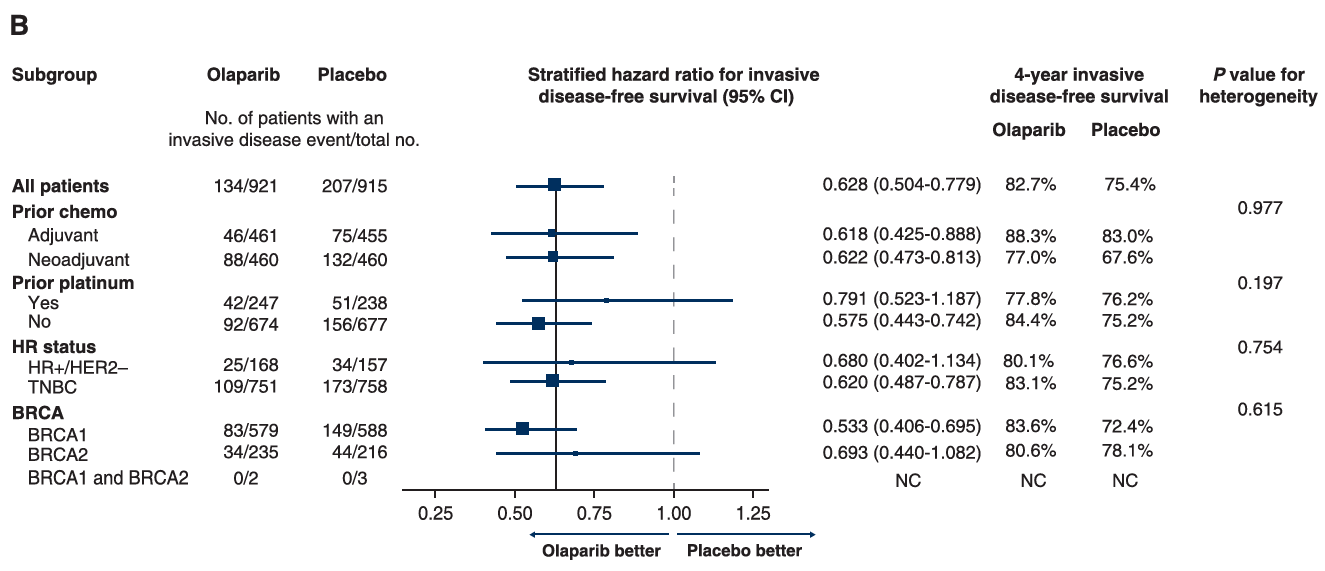 图5:4年iDFS的亚组分析
图5:4年iDFS的亚组分析
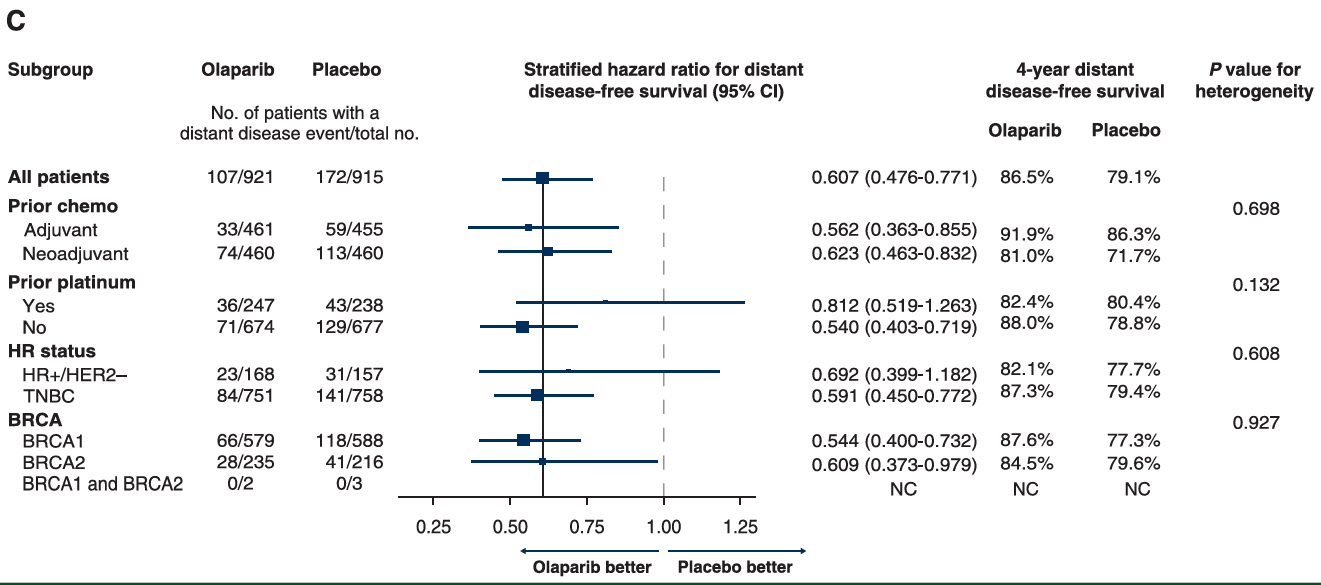 图6:4年DDFS的亚组分析
图6:4年DDFS的亚组分析
此外,奥拉帕利相较于阿贝西利和瑞波西利安全性更优。奥拉帕利的≥3级不良事件(AE)发生率为24.5%,因AE导致的停药率为9.9%,且不良事件多数可通过剂量调整或对症干预得到有效管理。相比之下,阿贝西利的≥3级AE发生率为49.9%,因AE导致的停药率高达61.7%;瑞波西利的≥3级AE发生率为62.6%,因AE导致的停药率为20.0%。这些数据表明,奥拉帕利在降低严重不良事件风险的同时,具有更优的安全性特征及管理可控性。
在2024年12月11日的SABCS大会上,OlympiA研究更新了6年生存随访数据(摘要号:GS1-09)[9],研究报告了自首例患者入组以来10年的第三次预先指定分析结果,中位随访时间达到6.1年(最长9.6年),自上次随访以来延长了2.6年。
主要研究终点方面,ITT人群中,奥拉帕利组的6年iDFS率达到79.6%,安慰剂组为70.3%,绝对获益9.4%(HR 0.65 95%CI:0.53-0.78),在所有预设亚组中观察到一致的iDFS获益。
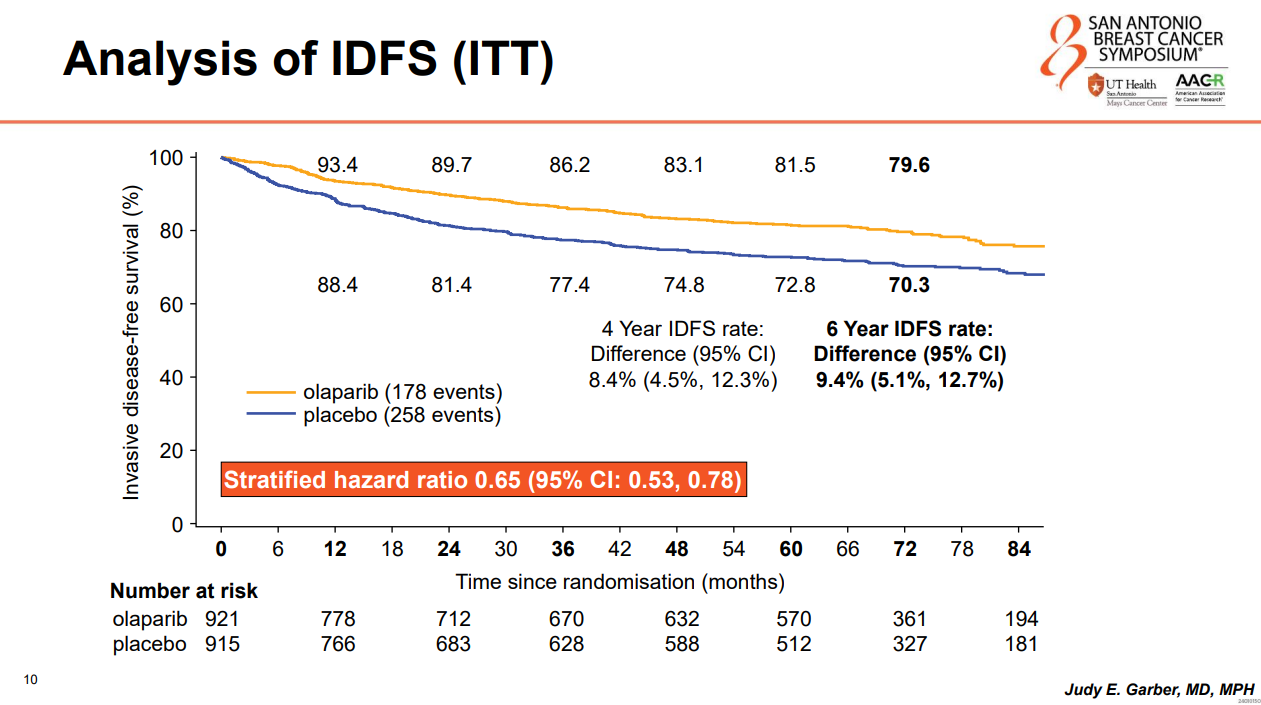 图7:iDFS分析
图7:iDFS分析
根据HR状态分层,在HR阳性患者中,奥拉帕利组的6年iDFS率为77.5%,安慰剂组为67.7%(HR 0.681,95%CI 0.437-1.051)。

DDFS方面,ITT人群中,奥拉帕利组的6年DDFS率为83.5%,安慰剂组为75.7%,绝对获益为7.8%(HR 0.65,95%CI 0.53-0.81),亚组分析同样显示了在包括HR阳性亚组在内的所有预设亚组的一致获益。
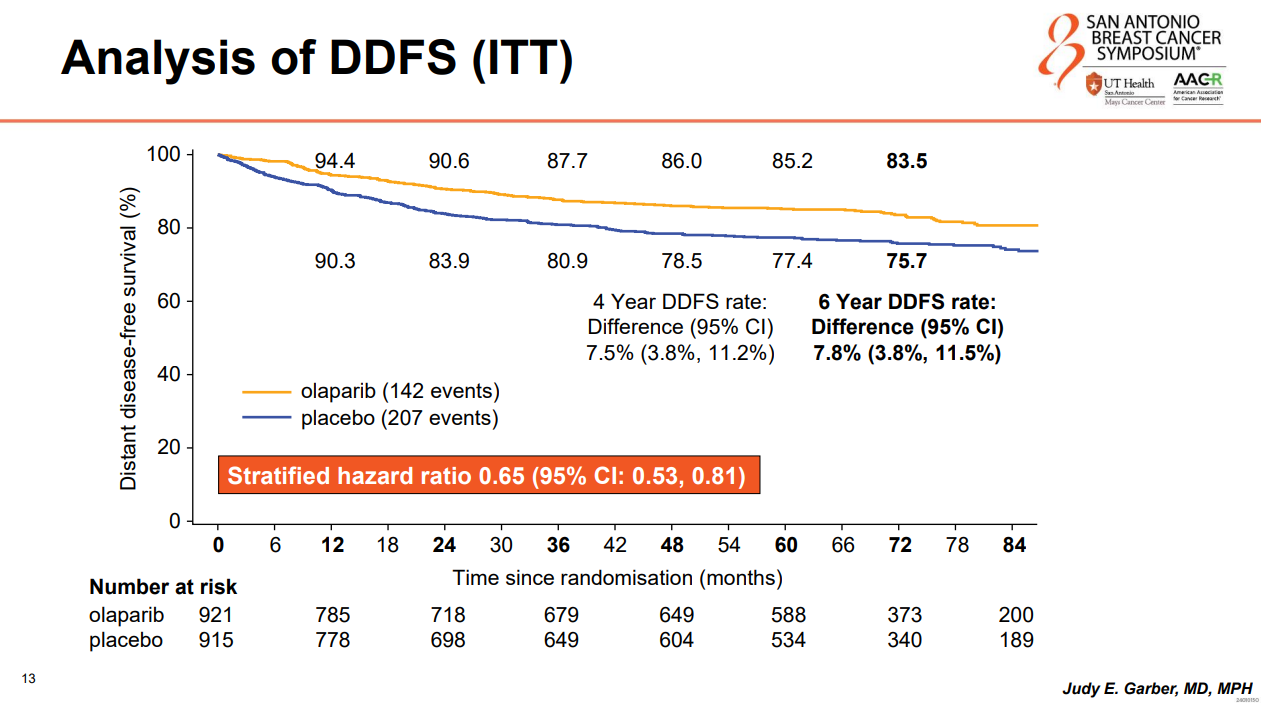
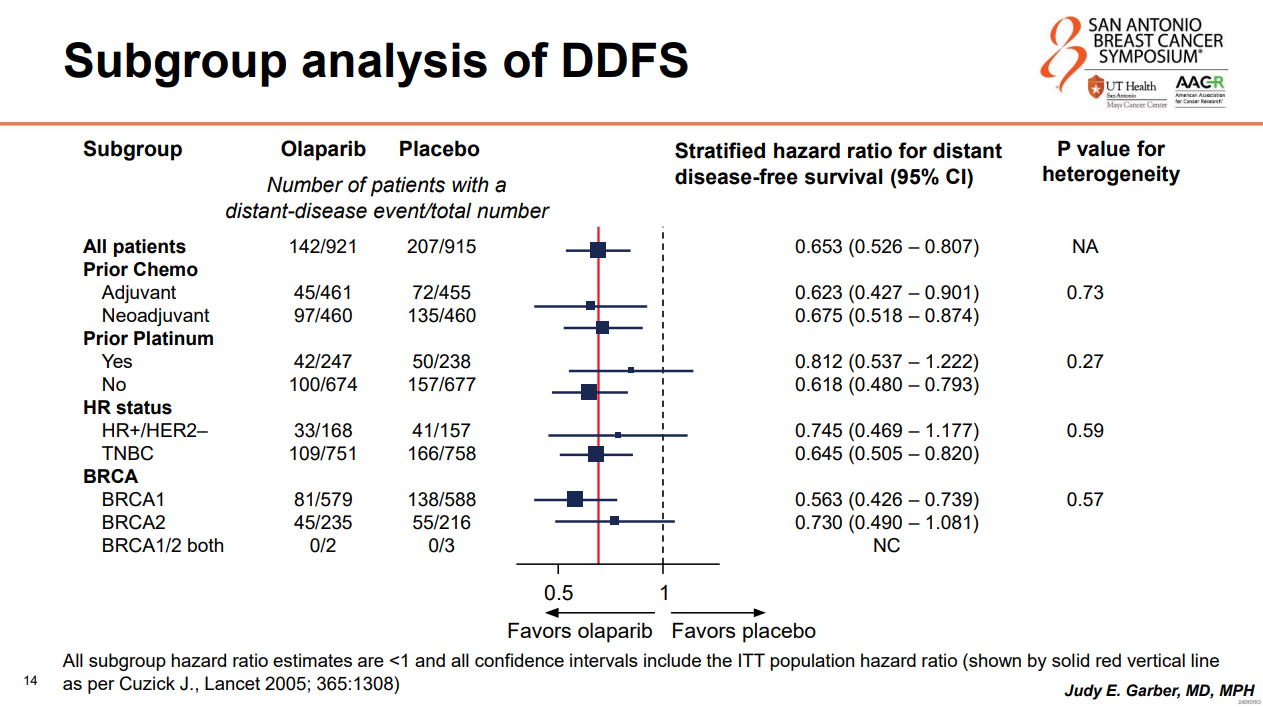
图10:DDFS亚组分析
总生存方面,ITT人群中,奥拉帕利组的6年OS率为87.5%,安慰剂组则为83.2%,绝对获益为4.4%(HR 0.72,95%CI 0.56-0.93)。奥拉帕利的OS获益在包括HR阳性患者的所有亚组中保持一致。

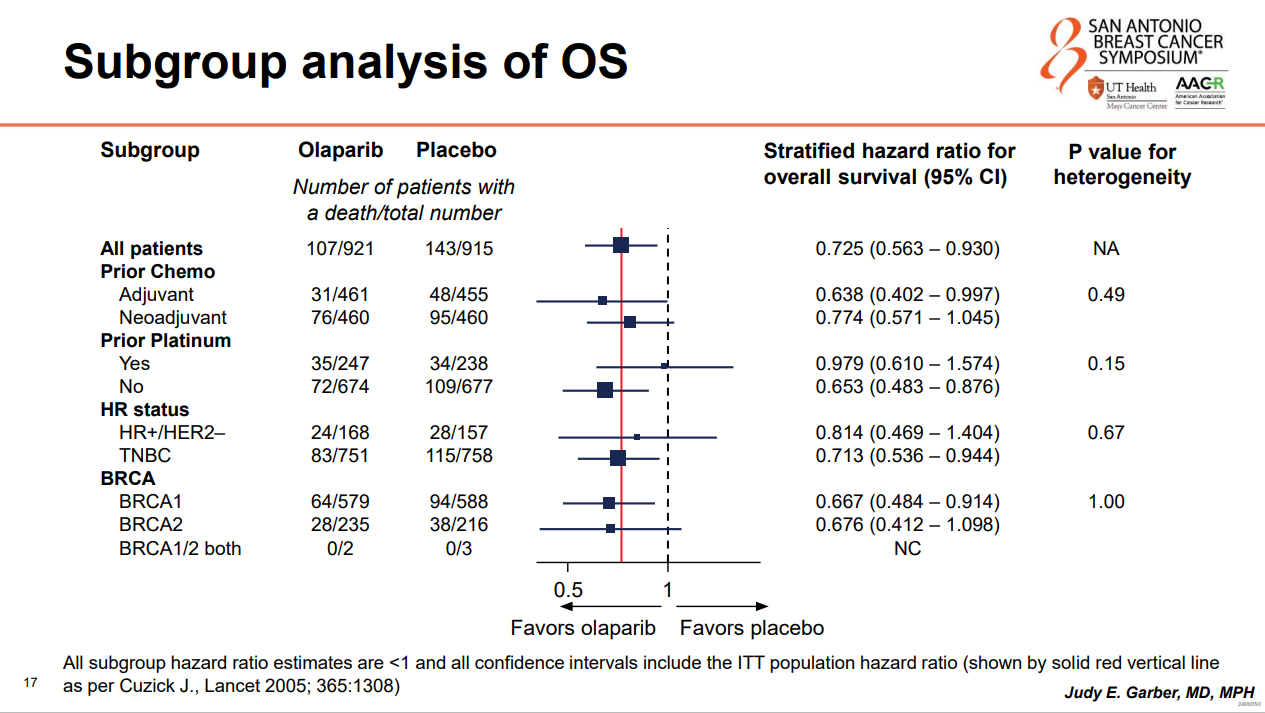 图12:OS亚组分析
图12:OS亚组分析
国内外指南对于伴gBRCA突变的HR阳性
乳腺癌患者,推荐奥拉帕利辅助强化治疗
NCCN 指南(2024年V5)[10]:

ASCO遗传性乳腺癌管理指南(2021年)[11]

ESMO指南(2023年)[12]

St. Gallen共识(2023年)[13]

CBCS BC指南(2024年)[14]

专家介绍
博士生导师、肿瘤学博士
哈尔滨医科大学附属肿瘤医院乳腺外科三病区主任
中国抗癌协会乳腺癌专业委员会常委
中国肿瘤临床学会乳腺癌专家委员会委员
中国医师协会肿瘤分会乳腺学组常委
北京癌症防治学会乳腺专业委员会副主任委员
黑龙江省医学会乳腺专业委员会副主任委员
黑龙江省乳腺癌临床质控专家委员会主任委员
[1] 国家肿瘤质控中心乳腺癌专家委员会, 等. 中华肿瘤杂志, 2021, 43(4):405-413.
[2] Johnston SRD, et al. J Clin Oncol. 2020 Dec 1;38(34):3987-3998.
[3] Christine Desmedt, et al. 2024 ESMO BC abstract 3MO.
[4] Slamon D, et al. N Engl J Med. 2024 Mar 21;390(12):1080-1091.
[5] Hortobagyi GN, et al. Ann Oncol. 2024 Oct 21:S0923-7534(24)04064-X.
[6] Safonov A, et al. Presented at ESMO Breast 2023; 11–13 May; Berlin, Germany; Poster 210P.
[7] Tutt ANJ, et al. N Engl J Med. 2021 Jun 24;384(25):2394-2405.
[8] Geyer CE Jr, et al. Ann Oncol 2022;33:1250–1268.
[9] Judy Garber, et al. SABCS 2024. GS1-09.
[10] NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®). Breast Cancer. Version 5.2024.
[11] Tung NM, et al. J Clin Oncol. 2021 Sep 10;39(26):2959-2961.
[12] Loibl S, et al. Ann Oncol. 2024 Feb;35(2):159-182.
[13] Curigliano G et al. Ann Oncol. 2023 Nov;34(11):970-986.
[14] 中国抗癌协会乳腺癌诊治指南与规范(2024年精要本)
责任编辑:肿瘤资讯-Kelly
排版编辑:肿瘤资讯-邓文普











 苏公网安备32059002004080号
苏公网安备32059002004080号


