乳腺癌是具有高度异质性的疾病,不同临床分期、病理类型的乳腺癌预后不同[1]。尽管新药不断研发上市,极大丰富了乳腺癌的治疗选择,但晚期乳腺癌仍存在未被满足的治疗需求。对于HR+/HER2-乳腺癌而言,CDK4/6i治疗进展后尚无标准的治疗方案。而晚期三阴性乳腺癌(TNBC)的新药探索较为缓慢,患者整体生存预后仍有待改善。Trop-2 ADC是乳腺癌领域冉冉升起的新星,在HER2-晚期乳腺癌展现出了治疗潜力。
2024圣安东尼奥乳腺癌大会(SABCS)于2024年12月10-13日举行。本次会议公布了多项Trop-2 ADC戈沙妥珠单抗(SG)在HER2-乳腺癌中的研究进展和真实世界应用情况。【肿瘤资讯】特邀广东省人民医院廖宁教授分享研究进展,以期更好指导SG在临床实践中的应用。
特邀嘉宾
广东省人民医院外科乳腺科行政主任
广东省医师协会乳腺专科医师分会主任委员
中国抗癌协会乳腺癌专业委员会(CBCS)常务委员
美国肿瘤外科学会(SSO)国际理事会理事
国际前哨淋巴结学会(ISNS)国际理事会理事
美国癌症研究协会(AACR)中国区顾问
国家卫生健康委员会医政司《乳腺癌诊疗规范》编写组成员
国家卫生健康委员会合理用药专家委员会抗肿瘤药物专业组成员
美国国家综合癌症网络(NCCN)肿瘤临床实践指南乳腺癌(中国版专家组成员
圣加仑早期乳腺癌治疗国际共识指南(中文版)专家组成员
SG在HER2-晚期乳腺癌治疗
已经取得突破性进展
Trop-2是乳腺癌治疗领域的明星靶点,在所有乳腺癌亚型中均存在过表达。经过免疫组化确认,约有50% ER+乳腺癌、93% TNBC患者呈现Trop-2过表达[2],提示Trop-2是具有广阔治疗前景的靶点。以SG为代表的Trop-2 ADC不负众望,在HER2-晚期乳腺癌取得了突破性进展。
III期确证性ASCENT研究结果显示,SG相比化疗延长经治的mTNBC中位无进展生存期(PFS)(5.6个月 vs 1.7 个月,HR 0.39, 95% CI 0.31-0.49)和中位总生存期(OS)(12.1个月 vs 6.7个月,HR 0.48, 95% CI 0.38-0.59)[3]。基于ASCENT研究的阳性结果,美国食品药品监督管理局(FDA)已批准SG用于治疗既往接受过至少2种疗法的mTNBC成人患者。中国国家药品监督管理局(NMPA)也批准SG用于既往至少接受过2种系统治疗(其中至少一种治疗针对转移性疾病)的不可切除的局部晚期或转移性TNBC成人患者。目前,SG已经广泛应用于临床,惠及广大mTNBC患者。
除了给mTNBC患者带来显著获益,SG在HR+/HER2-晚期乳腺癌的疗效也令人惊喜。III期TROPiCS-02研究结果提示,戈沙妥珠单抗相比化疗可延长经治(至少接受过1种内分泌治疗和1种CDK4/6i治疗、1种紫杉类治疗)的HR+/HER2-晚期乳腺癌患者中位PFS(5.5个月vs 4.0个月,HR 0.66, 95%CI 0.53-0.83)和中位OS(11.2个月 vs 14.4个月,HR 0.79, 95%CI 0.65-0.96)[4]。目前,FDA已批准SG用于治疗既往接受过内分泌治疗和至少2次系统治疗的HR+/HER2-不可切除或转移性乳腺癌患者的适应症。
亚太桥接研究、III期临床EVER-132-002研究结果显示,SG相比TPC延长内分泌耐药、2-4线化疗经治的HR+/HER2-晚期乳腺癌患者mPFS(4.3 vs 4.2个月,HR 0.67,95%CI 0.52-0.87)和中位OS(21个月 vs 15.4个月,HR 0.64, 95%CI 0.47-0.88)[5]。
以上研究证实了SG在经治HER2-晚期乳腺癌患者疗效和安全性,有望为填补临床治疗空白。本次SABCS会议公布的研究为SG治疗HER2-晚期乳腺癌再添循证证据。
2024 SABCS前沿进展,指导SG临床应用
P2-09-25: Subgroup Analyses From the Phase 3 EVER-132-002 Study of Asian Patients With HR+/HER2- Metastatic Breast Cancer
III期EVER-132-002研究中亚洲HR+/HER2-转移性乳腺癌亚组分析[6]
研究共纳入331名来自中国、韩国地区,既往接受过2-4线系统化疗的HR+/HER2-转移性乳腺癌患者。其中,49%入组患者既往接受过CDK4/6i治疗,30%患者为HER2零表达(HER2 IHC 0),70%患者为HER2低表达(HER2 IHC 1+, IHC 2+/ISH-)。既往中位治疗线数为2L。
结果显示,SG相比化疗显著提高经盲态独立评审委员会(BICR)评估的mPFS和mOS。
● 在未经CDK4/6i治疗亚组中,SG相比化疗的mPFS为5.6个月 vs 4.3个月(HR 0.79,95% CI 0.55-1.13),mOS为20.5个月vs18.1个月(HR 0.77,95% CI 0.50-1.20)。
● 在CDK4/6i经治亚组中,SG相比化疗的mPFS为4.1个月vs2.8个月(HR 0.56,95% CI 0.39-0.81),mOS为21.1个月vs12.3个月(HR 0.50,95% CI 0.31-0.80)。
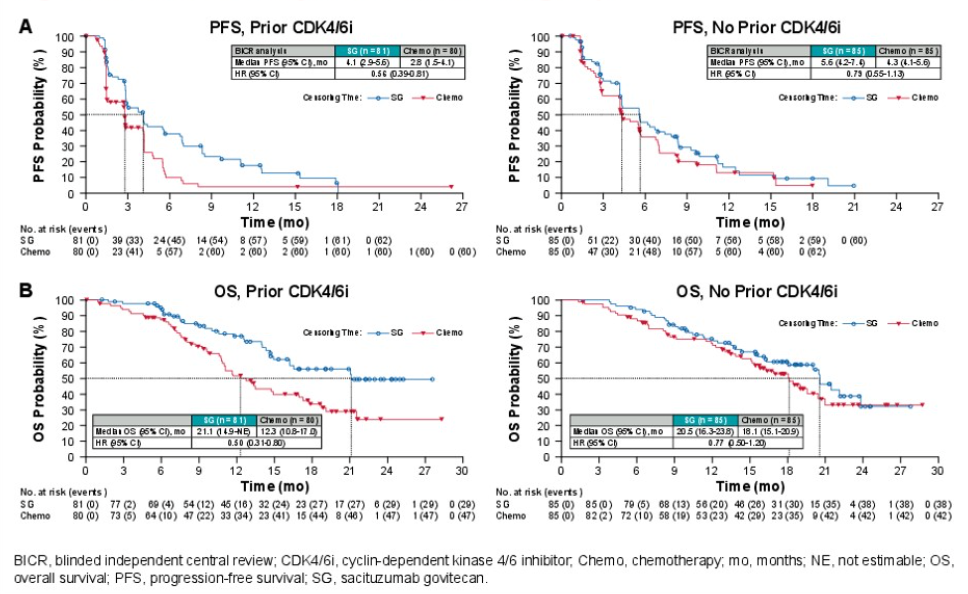
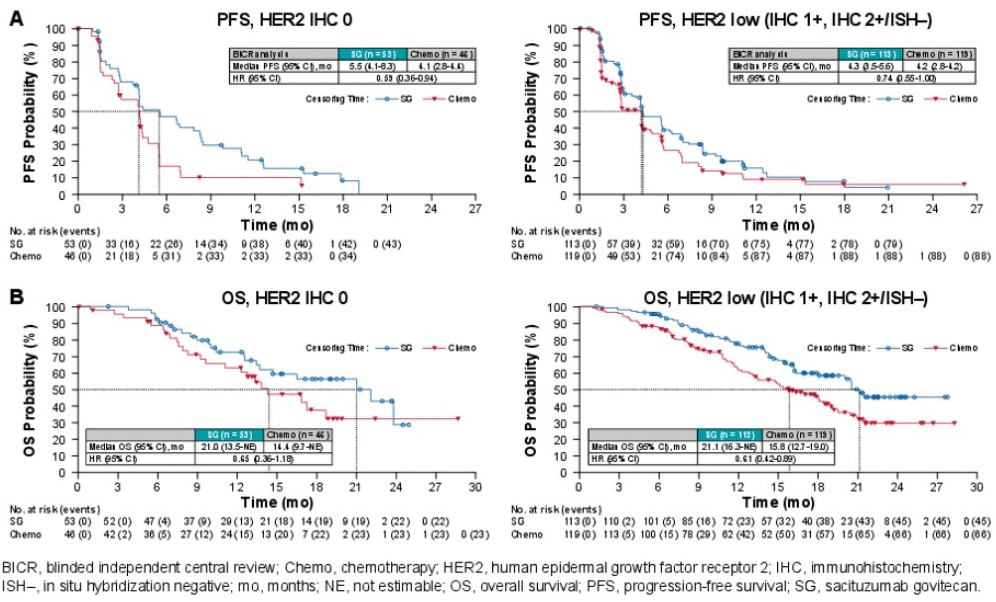
研究还分析了SG在HER2零表达和HER2低表达亚组的疗效,证实SG相比化疗显著提高HER2零表达、HER2低表达人群的PFS和OS。
● 在HER2零表达亚组中,SG相比化疗的mPFS为5.5个月vs4.1个月(HR 0.59,95%CI 0.36-0.94),mOS为21.0个月vs14.4个月(HR 0.65,95% CI 0.36-1.18)。
● 在HER2 低表达亚组中,SG相比化疗的mPFS为4.3个月vs4.2个月(HR 0.74,95% CI 0.55-1.00),mOS为21.1个月vs15.8个月(HR 0.61,95% CI 0.42-0.89)。
在安全性方面,常见治疗期间不良事件(TEAE)包括中性粒细胞减少(65%-71%)、白细胞减少(37%-45%)、贫血(16%-23%)。因TEAE停药的比例较低。本次EVER-132-002研究亚组分析证实,无论HER2零表达或是低表达,无论既往是否接受过CDK4/6i治疗,HR+/HER2-晚期乳腺癌患者均可从SG治疗中获益。
P3-07-24: Real-World Treatment Patterns and Clinical Outcomes of Sacituzumab Govitecan in HER2 negative metastatic breast cancer patients in China
中国HER2-转移性乳腺癌使用SG的真实世界治疗模式和临床结果[7]
浙江省肿瘤医院王晓稼教授团队针对SG在中国HER2-转移性乳腺癌临床治疗应用进行探索。研究纳入44例患者,其中77.3%mTNBC,22.7%HR+/HER2-乳腺癌(含HER2 0,HER2低表达)。88.6%有内脏转移,20.5%有脑转移。68.2%患者接受SG单药治疗,31.8%患者接受SG联合其他疗法(如免疫治疗)。
结果显示,整体人群的真实世界PFS(rwPFS)为4.13个月,其中mTNBC组rwPFS为4.13 个月,HR+/HER2-乳腺癌组rwPFS为5.25个月。 在HR+/HER2-转移性乳腺癌亚组中, 90%患者既往接受过CDK4/6i治疗,70%患者既往接受过化疗。
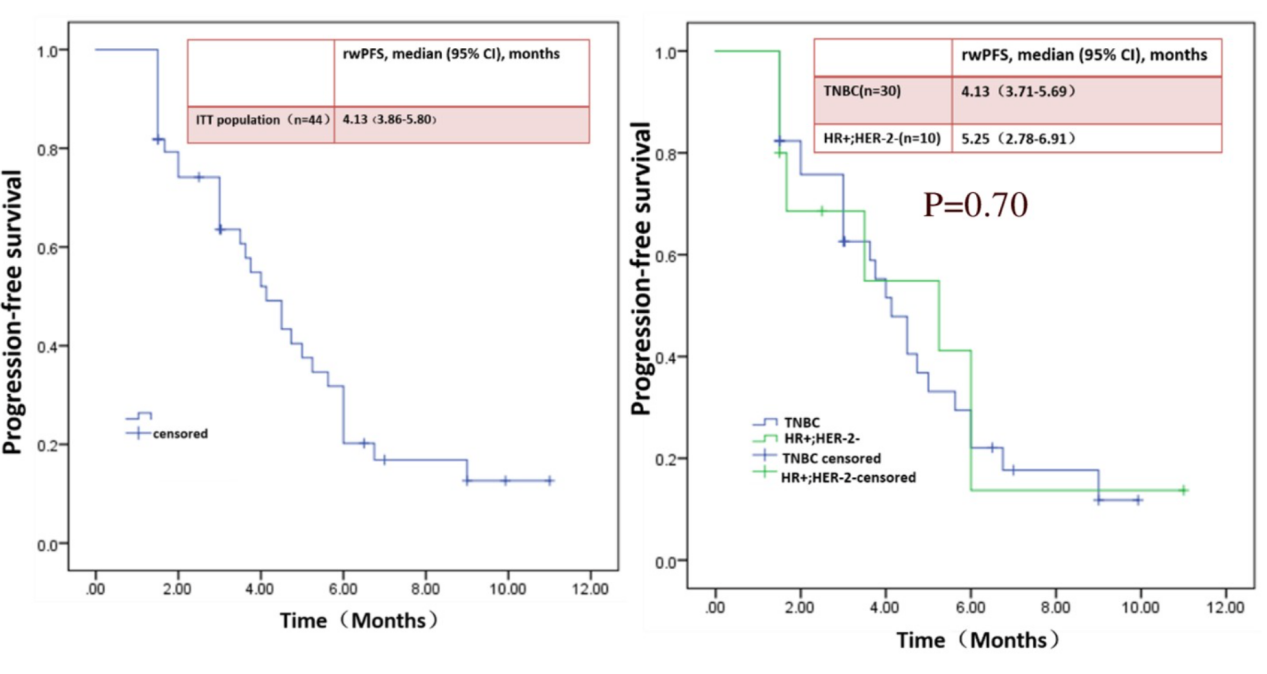
整体人群的rwPFS(左)
和mTNBC、HR+/HER2-转移性乳腺癌亚组rwPFS(右)
这项研究反映了SG在中国HER2-转移性乳腺癌临床实践的应用情况,提示无论SG单药还是联合方案在HER2-转移性乳腺癌治疗领域大有可为。
P2-10-02: SACISUR, results of a real-world evidence observational study of the use of Sacituzumab-Govitecan (SG) in triple negative metastatic breast cancer (mTNBC) clinical practice in the south of Spain.
SACISUR:一项关于SG在西班牙南部mTNBC临床实践中使用的真实世界观察研究[8]
研究共纳入18个不同西班牙医学中心159位mTNBC患者。其中,75.5%患者存在内脏转移,13.9%患者存在中枢神经系统转移。中位前线治疗线数为3线,中位SG治疗周期为7。SG应用于一线、二线、三线治疗方案分别为3.8%、41.8%、54.4%。
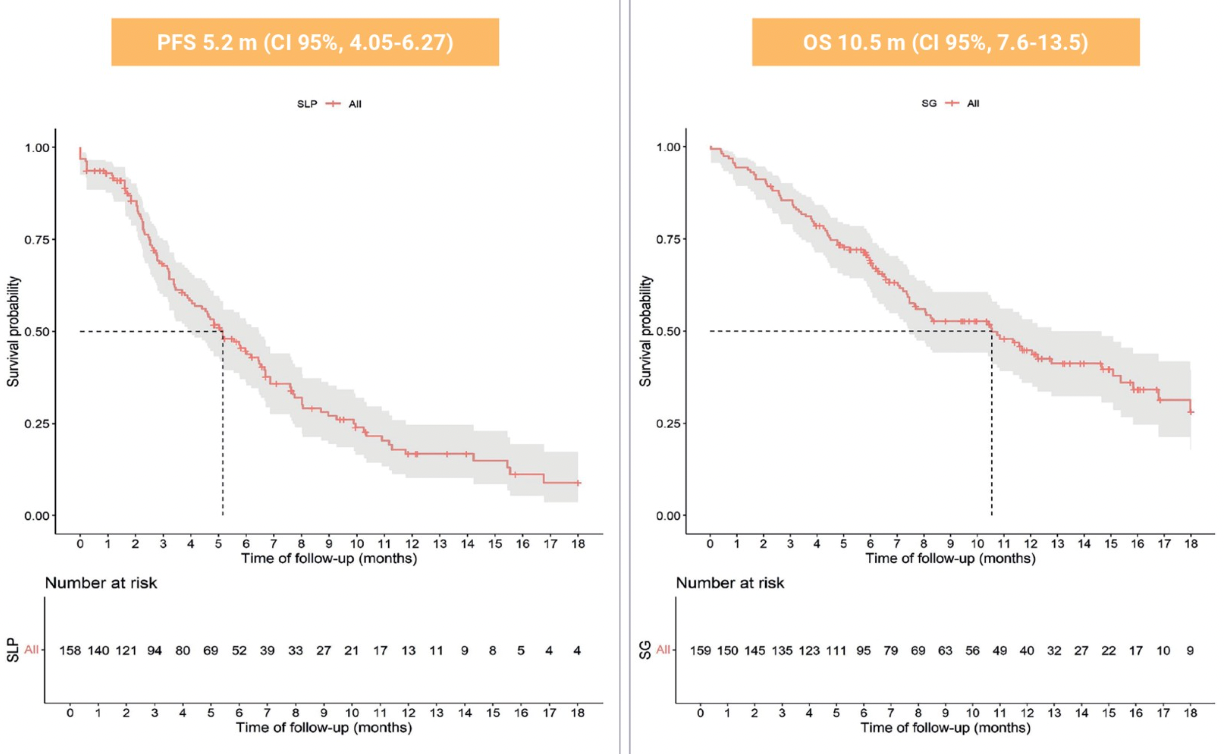
结果显示,mPFS为5.2个月(95% CI 4.05-6.27),mOS为10.5个月(95% CI 7.6-13.5),ORR为31.2%,临床获益率(CBR)为68.9%。中性粒细胞减少症 59.4% (G3-4 30.4%)、腹泻 49% (G3-4 8.2%)、恶心 45.3% (G3-4 0.6%) 和 ALT/AST 升高 24.5% (G3-4 1.9%)。该研究证实,真实世界中SG治疗mTNBC的疗效和安全性与ASCENT研究一致。
P1-07-28: Real-World Study on Efficacy and Safety of SG Alone and Combined with Immunotherapy in Metastatic Triple Negative Breast Cancer Patients
SG单药和SG联合免疫治疗mTNBC的真实世界研究[9]
中山大学孙逸仙纪念医院赵健丽教授团队探索了真实世界中mTNBC使用SG单药和SG联合免疫治疗的疗效和安全性。研究共入组48例mTNBC患者,其中32例接受SG单药治疗,6例接受SG联合PD-1单抗治疗,10例患者接受SG联合PD-1单抗和阿帕替尼治疗。
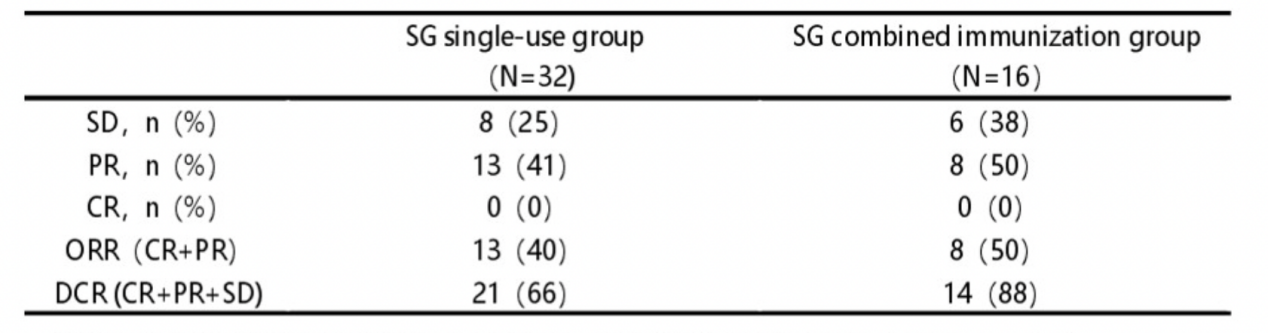
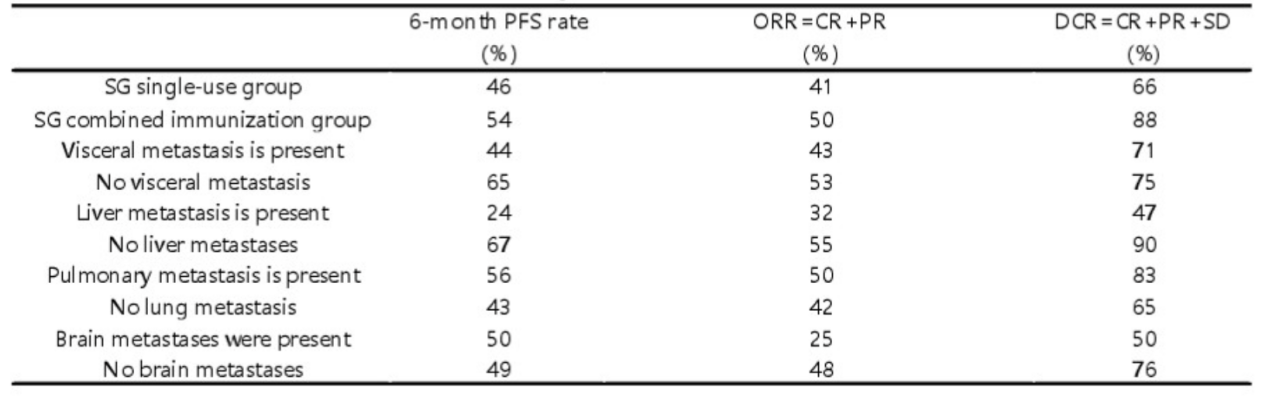
结果显示,SG联合治疗相较SG单药明显提高mTNBC患者的客观缓解率(ORR)和6个月PFS率获益更为显著。SG联合免疫治疗对比SG单药的ORR为54% vs 41%,疾病控制率(DCR)为88% vs 66%。6个月PFS率为54% vs 46%。在内脏转移亚组分析中,无内脏转移患者相比内脏转移患者的ORR分别为53% vs 43%,6个月PFS率分别为65% vs 44%。肝转移患者相比无肝转移患者6个月 PFS 率分别为67% vs 24%。该研究证实,SG联合免疫疗法可以延缓肿瘤进展,并最终改善生存结果和生活质量。
SG单药治疗和SG联合治疗组的ORR和DCR
不同亚组的6个月PFS、ORR、DCR
在安全性和耐受性方面,SG联合治疗组和SG单药组的≥3级或以上不良事件(AE)发生率低于30%。两组均未报告发热性中性粒细胞减少症或3~4级恶性、呕吐、胆红素升高或口腔黏膜炎病例,证实SG单药和联合治疗的安全性可控。
SG赋能HER2-晚期乳腺癌诊治
引领全新治疗模式
SG作为全球首款获批的Trop-2 ADC,在mTNBC和HR+/HER2-转移性乳腺癌的疗效和安全性得到FDA、欧洲药品管理局(EMA)的认可。在中国,SG也已经获批上市用于治疗mTNBC。本次SABCS公布的研究分析和真实世界研究再次为SG治疗HER2-晚期乳腺癌患者提供了循证医学证据。
在真实世界研究中,SG治疗mTNBC的模式、疗效和安全性与临床研究相似,进一步夯实了SG在mTNBC二线治疗的地位。中国学者团队证实了SG在中国临床治疗的有效性,同时探索了SG联合免疫治疗的应用前景,为未来进一步探索mTNBC优化治疗方案打下基础。
对于HR+/HER2-转移性乳腺癌,本次会议公布的研究为临床实践带来了新的诊疗思路。EVER-132-002研究数据亚洲人群分析证实了SG在CDK4/6i经治人群、HER2低表达和HER2 0表达人群中一致的获益趋势。值得一提的是,SG治疗可为CDK4/6i经治人群带来具有统计学意义的临床获益。
对于乳腺癌脑转移、内脏转移患者,SG也展现出值得期待的疗效,有望为这一临床诊疗难题提供新的解决方案。期待未来SG在HER2-转移性乳腺癌展开更多探索,为这部分患者带来新的治疗选择。
[1] 公彦栋,黄焰. 乳腺癌预后预测评估模型的研究进展[J]. 癌症进展,2016,14(9):847-850,853. DOI:10.11877/j.issn.1672-1535.2016.14.09.07.
[2] Sakach, Elizabeth et al. “Trop-2 as a Therapeutic Target in Breast Cancer.” Cancers vol. 14,23 5936. 30 Nov. 2022, doi:10.3390/cancers14235936
[3] Sacituzumab govitecan (SG) versus treatment of physician’s choice (TPC) in patients (pts) with previously treated, metastatic triple-negative breast cancer (mTNBC): Final results from the phase 3 ASCENT study.2022 ASCO 1071.
[4] Sara M. Tolaney, ,et al. Final overall survival (OS) analysis from the phase 3 TROPiCS-02 study of sacituzumab govitecan (SG) in patients (pts) with hormone receptor–positive/HER2-negative (HR+/HER2–) metastatic breast cancer (mBC). J Clin Oncol 41, 2023 (suppl 16; abstr 1003). DOI: 10.1200/JCO.2023.41.16_suppl.1003
[5] Xu BH, Ma F, Wang SS, et al. Sacituzumab Govitecan vs Treatment of Physician’s Choice in Asian Patients With Hormone Receptor–Positive and HER2–Negative Metastatic Breast Cancer: Results From the Phase 3 EVER-132-002 Study. 2023 ESMO Asia. LBA4.
[6] Subgroup Analyses From the Phase 3 EVER-132-002 Study of Asian Patients With HR+/HER2- Metastatic Breast Cancer. 2024 SABCS P2-09-25.
[7] Real-World Treatment Patterns and Clinical Outcomes of Sacituzumab Govitecan in HER2 negative metastatic breast cancer patients in China.2024 SABCS P3-07-24.
[8] SACISUR, results of a real-world evidence observational study of the use of Sacituzumab-Govitecan (SG) in triple negative metastatic breast cancer (mTNBC) clinical practice in the south of Spain.2024 SABCS P2-10-02.
[9] Real-World Study on Efficacy and Safety of SG Alone and Combined with Immunotherapy in Metastatic Triple Negative Breast Cancer Patients. 2024 SABCS P1-07-28.
排版编辑:肿瘤资讯-老猫











 苏公网安备32059002004080号
苏公网安备32059002004080号


