
HER2突变是公认的致癌驱动因素;不同于其他瘤种,非小细胞肺癌(NSCLC)中HER2具有独特且复杂的致癌机制。HER2突变晚期NSCLC预后差,临床治疗棘手,近20年来的探索发现,传统疗法及部分新型药物在此类患者中的疗效非常有限,难以满足临床需求。近日,德曲妥珠单抗获得NMPA批准,成为国内肺癌领域首个获批的ADC药物。期待ADC用于临床并绘就一幅HER2变异NSCLC领域的新时代画卷。
【肿瘤资讯-HER2大师课】特邀哈尔滨医科大学附属肿瘤医院于雁教授回顾和梳理HER2变异NSCLC的独特机制和HER2突变的临床挑战。
内科教研室主任 博士生导师
中国临床肿瘤学会(csco)理事
黑龙江省抗癌协会常务理事
黑龙江省医学发展基金理事
黑龙江省医学会理事会理事
中国抗癌协会化疗专业委员会常委
中国临床肿瘤学会肿瘤支持与康复治疗委员会常委
中国医促进会肿瘤肿瘤舒缓治疗学分会常委
中国医药教育协会肺部肿瘤专业委员会常委
中国抗癌协会癌症康复与姑息治疗委员会常委
中国抗癌协会肺癌专业委员会委员
中国抗癌协会肿瘤异质性与个体化治疗专委会常委
黑龙江省医师协会肺癌专业委员会主任委员
黑龙江省医学会癌症姑息息治疗委员会主任委员
黑龙江省抗癌协会癌症康复与姑息治疗专业委员会主任委员
黑龙江省抗癌协会肿瘤药物临床研究专委会候任主任委员
中华转移性肿瘤杂志编委
中国肿瘤临床与康复杂志编委
NSCLC中ERBB2(HER2)
致癌作用机制独特且复杂
人类表皮生长因子受体(HER)是细胞增殖、肿瘤发生和凋亡的重要介质,HER家族有四个成员:EGFR(也称为HER1或erbB1)、ERBB2(HER2,erbB2或neu)、HER3(erbB3)、HER4(erbB4)。细胞膜表面受体一般由胞外配体结构域(ECD)、α-螺旋跨膜结构域(TM)和细胞内酪氨酸激酶结构域(TKD)三部分组成。在特定条件下,配体与受体的细胞外结构域结合,导致HER蛋白受体的同源或异源二聚化,引起细胞内酪氨酸残基磷酸化而启动MAPK、PI3K/AKT、PKC和STAT等下游信号通路。
原癌基因ERBB2发现于20世纪80年代中期,位于人类17号染色体长臂(17q11.2-q12),HER2是一种185kDa的跨膜糖蛋白。HER2本身没有配体结合域,但它与其他配体结合型EGF受体家族成员结合形成异二聚体,可稳定结合配体并增强激酶介导的下游信号通路激活[1]。值得一提的是,与HER2同家族的HER3缺乏内在酪氨酸激酶活性,只能与其他HER受体形成异源二聚体,HER2/HER3异源二聚体可较强的激活肿瘤增殖相关下游信号通路。NSCLC中,HER2的突变可导致下游细胞增殖信号通路的组成性激活并导致癌变。
HER2过表达的潜在致癌机制尚不完全明确,但细胞表面HER2蛋白的增加会增强含HER2异源二聚体的形成,从而改变细胞极性和粘附并激活相关致癌信号传导通路。与乳腺癌不同的是,NSCLC中HER2扩增的发生率较低,在未接受靶向治疗的NSCLC中HER2扩增是主要的致癌驱动因素;而HER2扩增也可能是EGFR-TKI的获得性耐药机制。研究显示,HER2扩增能增加NSCLC细胞的侵袭能力;且不依赖于配体,可组成性激活HER2和EGFR。HER2扩增与胸膜浸润、从不吸烟和女性等因素密切相关,目前而言其预后意义尚不明确。
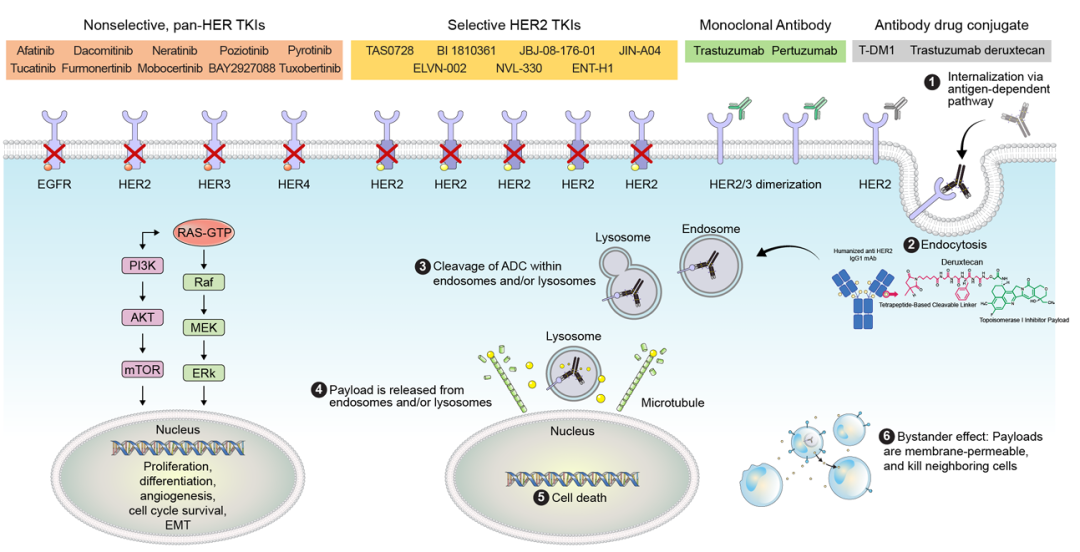
机制模式图
HER2变异NSCLC有庞大患者人群,
预后差,易发生脑转移,临床治疗棘手
与EGFR突变类似,NSCLC中HER2突变在女性、非吸烟者中最常见。研究显示,约有1–6%的NSCLC患者可能发生HER2突变[2-4]。另有研究显示,与其他地区(1-3%)相比,亚洲地区患者HER2突变的发生率略高,约为1.4-6.7%[5]。HER2突变在晚期肺腺癌中国人群中的发生率约为2-4%[6],一项纳入7395例中国患者的研究显示,HER2突变的发生率为5.4%[7]。肺癌的发病率和死亡率居于恶性肿瘤前列,即使HER2突变的发生率在5%左右,晚期NSCLC中仍有不容忽视的庞大群体数量。HER2突变NSCLC预后差;且易发生脑转移,从诊断到治疗,HER2突变NSCLC脑转移的发生率约为50%[8]。因此,临床治疗非常棘手。
另外值得关注的是,约6–35%的NSCLC可能发生HER2蛋白过表达,约10-20%的NSCLC患者发生ERBB2扩增[9-11]。相比HER2突变,HER2蛋白过表达变异和HER2扩增的发生率更高,晚期NSCLC中有更大的患者人群。
化疗、免疫、TKI等疗法在
HER2突变NSCLC中疗效有限
研究者既往在HER2突变NSCLC中探索过多种传统治疗药物的有效性。既往一项研究纳入一线含铂化疗方案治疗期间或之后进展的鳞状或非鳞状NSCLC,1253例患者被随机分配接受多西他赛75mg/m2±雷莫西尤单抗或安慰剂治疗。结果显示,接受多西他赛HER2突变NSCLC的中位OS仅为 9.1个月,中位PFS仅为3.0个月[12]。研究显示,经治HER2突变NSCLC并不能从免疫单药中获益,HER2突变NSCLC接受免疫单药的ORR为7%,低于KRAS、BRAF、ROS1和EGFR变异患者[13]。一项随机、开放标签的III期临床试验纳入经治IIIB或IV期鳞状或非鳞状NSCLC。1225例患者按1:1随机分配接受阿替利珠单抗或多西他赛治疗。结果显示,阿替利珠单抗二线治疗HER2突变NSCLC疗效不佳,ORR仅14%,中位PFS仅2.8个月[14]。
多数HER2 TKIs和抗HER2抗体在HER2突变NSCLC中的疗效仍需进一步改善。大部分小分子HER2 TKI在HER2突变NSCLC中的有效率约为7%-12%,中位PFS约为3-5个月。仅吡咯替尼显示适度的活性,一项前瞻性、多中心、开放标签II期研究中评估了吡咯替尼用于经治HER2突变晚期NSCLC的疗效和安全性[15]。结果显示,吡咯替尼组的ORR为30%,中位PFS为6.9个月[15]。II期MyPathway研究显示,曲妥珠单抗+帕妥珠单抗在HER2突变NSCLC中的ORR为21%[16.17]。一项多中心、非随机II期研究,前瞻性评估了曲妥珠单抗联合帕妥珠单抗用于经铂类化疗进展后HER2突变晚期NSCLC的疗效。结果显示,帕妥珠单抗+曲妥珠单抗治疗HER2突变NSCLC的ORR为28.9%,中位PFS为6.8个月[18]。整体可见,既往各类疗法的HER2突变晚期NSCLC疗效不佳,有效率和临床获益难以令人满意,亟需更有效的疗法和新型创新疗法。
晨光破晓,希望盈怀:
HER2变异NSCLC开启精准化治疗时代
HER2和EGFR同属于HER家族成员。在晚期NSCLC治疗中,EGFR突变晚期NSCLC的诊疗(包括耐药后的治疗)比较程序化,广为熟知。在HER2靶点领域,今年10月NMPA批准了德曲妥珠单抗用于经治HER2突变NSCLC后线治疗的适应症,HER2突变晚期肺癌迎来了精准治疗时代的首个、临床可及的精准疗法。总体上,临床上有关HER2的精准检测及精准诊疗处于起步阶段,未来在检测规范化、精准化领域,还有很多临床实际问题需要解决。
总结
HER2是公认的致癌驱动因素,相比其他瘤种,NSCLC中HER2的作用机制更加独特和复杂。HER2突变NSCLC临床治疗较棘手,多年来的探索发现传统疗法在这类患者中疗效不佳,临床治疗面临挑战。随着HER2 ADC德曲妥珠单抗的获批,HER2突变NSCLC迎来了精准诊疗的新时代,然而关于HER2的精准检测和治疗目前还处于起步阶段,还有待进一步提高,期待ADC用于临床,造福肺癌患者。
[1]Hong L, Patel S, Drusbosky LM, et al. Molecular landscape of ERBB2 alterations in 3000 advanced NSCLC patients. NPJ Precis Oncol. 2024 Oct 1;8(1):217. doi: 10.1038/s41698-024-00720-9. PMID: 39354054.
[2]Arcila, M. E. et al. Prevalence, clinicopathologic associations, and molecular spectrum of ERBB2 (HER2) tyrosine kinase mutations in lung adenocarcinomas. Clin. Cancer Res. 18, 4910–8, (2012).
[3]Shigematsu, H. et al. Somatic mutations of the HER2 kinase domain in lung adenocarcinomas. Cancer Res. 65, 1642–6, (2005).
[4]Tomizawa, K. et al. Prognostic and predictive implications of HER2/ERBB2/neu gene mutations in lung cancers. Lung Cancer74, 139–44, (2011).
[5]Trastuzumab Deruxtecan in Asian Patients With Human Epidermal Growth Factor Receptor 2 (HER2; ERBB2)-Mutant Metastatic Non–Small Cell Lung Cancer: Subgroup Analysis of DESTINY-Lung02. 2023 ESMO ASIA
[6]Jebbink M, et al. Cancer Treat Rev, 2020, 86:101996
[7]Si X, Pan R, Ma S, et al. Genomic characteristics of driver genes in Chinese patients with non-small cell lung cancer. Thorac Cancer. 2021 Feb;12(3):357-363. doi: 10.1111/1759-7714.13757. Epub 2020 Dec 9. PMID: 33300283; PMCID: PMC7862783.
[8]Offin M, Feldman D, Ni A, et al. Frequency and outcomes of brain metastases in patients with HER2-mutant lung cancers. Cancer. 2019 Dec 15;125(24):4380-4387. doi: 10.1002/cncr.32461. Epub 2019 Aug 30. PMID: 31469421; PMCID: PMC6891113.
[9]Pellegrini, C. et al. HER-2/Neu alterations in non-small cell lung cancer: a comprehensive evaluation by real time reverse transcription-PCR, fluorescence in situ hybridization, and immunohistochemistry. Clin. Cancer Res. 9, 3645–52, (2003).
[10]Buttitta, F. et al. Mutational analysis of the HER2 gene in lung tumors from Caucasian patients: mutations are mainly present in adenocarcinomas with bronchioloalveolar features. Int. J. Cancer 119, 2586–91, (2006).
[11]Stephens, P. et al. Lung cancer: intragenic ERBB2 kinase mutations in tumours. Nature 431, 525–6, (2004).
[12]Garon EB, et al. Lancet. 2014;384(9944):665-673
[13]Ren S, Wang J, Ying J, et al. Consensus for HER2 alterations testing in non-small-cell lung cancer. ESMO Open. 2022 Feb;7(1):100395. doi: 10.1016/j.esmoop.2022.100395. Epub 2022 Feb 8. Erratum in: ESMO Open. 2022 Jun;7(3):100482. PMID: 35149428
[14]Rittmeyer A, et al. Lancet. 2017;389(10066):255-265.
[15]Zhou C, et al. Journal of Clinical Oncology, 2020, 38(24): 2753-2761.
[16]Tan AC, Tan DSW. J Clin Oncol. 2022 Feb 20;40(6):611-625;
[17]Offin M, et al. Cancer. 2019 Dec 15;125(24):4380-4387.
[18]Mazieres J, et al. Journal of Clinical Oncology, 2022, 40(7): 719-728.
排版编辑:肿瘤资讯-Ale











 苏公网安备32059002004080号
苏公网安备32059002004080号


