2024年第47届圣安东尼奥乳腺癌研讨会(San Antonio Breast Cancer Symposium,SABCS)于12月10日至13日在美国得克萨斯州圣安东尼奥举行。该会议汇聚了全球约1万名临床医生和专家,是规模最大、最具影响力的乳腺癌研究盛会。
在12月12日的教育会议 7:人们的选择—抗体偶联药物环节中,John Lambert教授、Giuseppe Curigliano教授、Ingrid Mayer教授和Paolo Tarantino教授深入剖析了抗体偶联药物(ADC)的发展历程、作用机制、耐药性以及在乳腺癌治疗中的应用与挑战,探索学术界与工业界的前沿进展,以及如何提高ADC的精准治疗,引起国内外广泛关注与讨论。【肿瘤资讯】特此整理,以飨读者。
ADC的全面解析:历史、作用机制与耐药机制探究
ADC的历史与发展
ADC的历史可以追溯到Paul Ehrlich的“魔法子弹”概念,即寻找一种能够精确靶向并杀死癌细胞而不伤害正常细胞的治疗方法。随着单克隆抗体的发明,这一概念得到了实现,为选择性结合提供了可能。这一过程标志着ADC在提高抗癌药物疗效方面的重大进步。


ADC的作用机制
ADC的作用机制涉及三个基本组成部分:抗体、连接子和载荷。抗体负责将细胞毒性药物精确递送到癌细胞,连接子确保药物在到达目标之前保持稳定,而载荷则是负责杀死癌细胞的细胞毒性药物。

ADC的耐药机制
ADC的耐药性可能源于多个方面,如抗体抗性,由于抗原的丢失或表达降低导致抗体与抗原的结合能力下降;载荷抗性,包括载荷靶点的突变、抗凋亡蛋白的上调以及细胞信号通路的激活,这些都可能阻碍载荷发挥其细胞毒性效应;内化和运输异常,干扰溶酶体的运输和载荷的释放;以及载荷清除,通过ABC药物转运蛋白将载荷排出细胞外,降低其细胞内浓度。此外,具有不可裂解连接子的ADC也可能因其独特的释放机制而表现出不同的耐药性。

ADC的临床研究教训
ADC的临床研究教训包括1980年代的剂量测定研究揭示了肿瘤对单克隆抗体摄取的低效率,仅为注射剂量的0.003%-0.08%;第一代ADC使用的抗癌药物效力不足,表明需要更高效的载荷;此外,由于使用了小鼠单克隆抗体,第一代ADC引发了免疫原性问题,限制了其重复剂量的使用。这些经验对于改进ADC的设计,提高其疗效和降低免疫原性具有重要的指导意义。


ADC的未来发展
ADC的未来发展聚焦于改进目标选择、多样化连接子和载荷、使用前药作为载荷、提升偶联技术以及多样化单克隆抗体和小分子等策略,来不断开拓ADC设计工具箱,以改善毒性特征和治疗指数,并解决耐药性问题。并强调了伴随诊断在患者选择中的重要性以及免疫肿瘤学(IO)组合疗法在临床开发中的潜力。

ADC在乳腺癌治疗中的角色及面临的挑战
ADC在转移性乳腺癌治疗中的历程
在2022至2024年间,所有转移性乳腺癌患者都有机会接受至少一种ADC治疗。这一进展标志着ADC在乳腺癌治疗中的重要地位,尤其是在人表皮生长因子受体2(HER2)阳性、激素受体(HR)阳性/HER2阴性以及三阴性乳腺癌(TNBC)的治疗中。ADC的发展为患者提供了新的治疗选择,其中,T-DXd和T-DM1是两种最具代表性的ADC药物。


HER2阳性乳腺癌治疗的新进展
T-DM1作为首个在乳腺癌中获批的ADC,具有不可裂解的连接子,并且在对曲妥珠单抗耐药的HER2阳性转移性乳腺癌中显示出活性,其药物抗体比(DAR)为3.5:1。此外,T-DM1在EMILIA试验中显示出改善的总生存期(OS)。在KATHERINE试验中,T-DM1的7年OS绝对获益达到了4.7%。
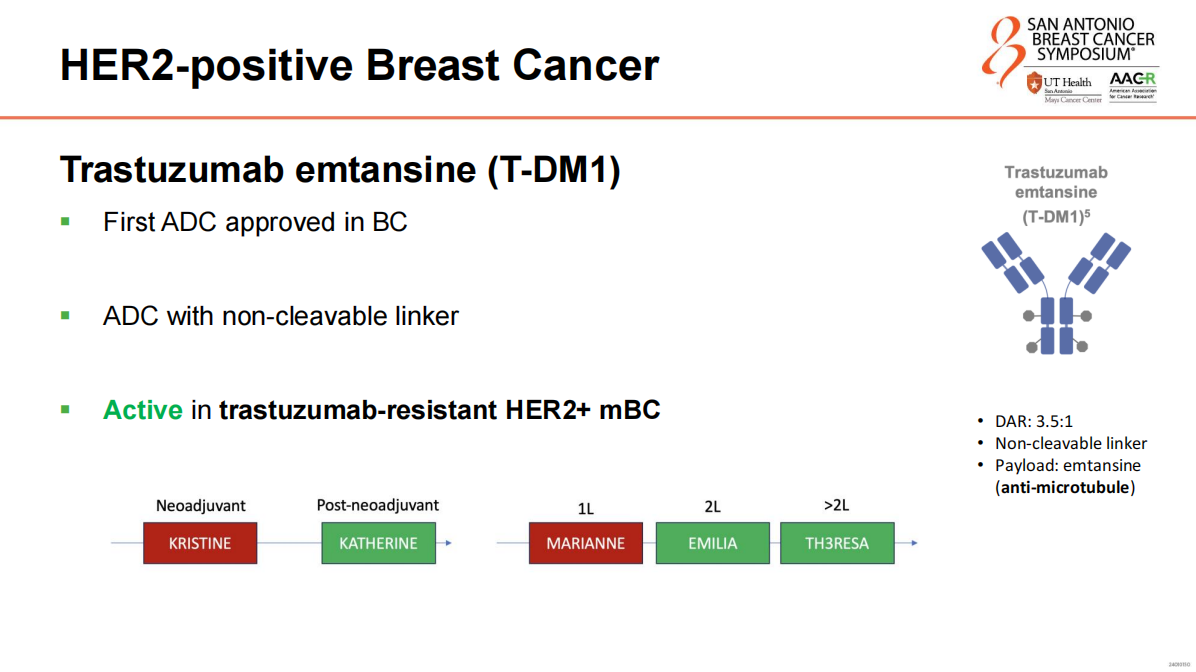
新一代ADC在HER2阳性乳腺癌中的应用
T-DXd作为新一代ADC,携带拓扑异构酶Ⅰ抑制剂,具有约8:1的DAR,并且拥有可裂解的肿瘤选择性连接子,表现出旁观者效应。相比之下,T-DM1携带抗微管药物,其药物与抗体比率为3.5:1,无可裂解的肿瘤选择性连接子,也未表现出旁观者效应。这些特性使得T-DXd在治疗HER2阳性乳腺癌方面展现出潜在的优越性。
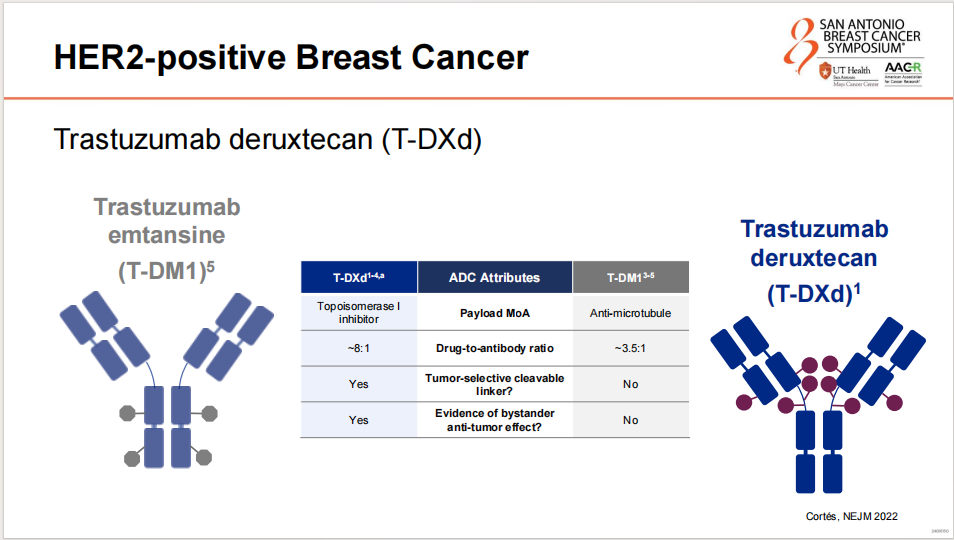
ADC在HER2阳性乳腺癌脑转移治疗中的潜力
在DESTINY-Breast12试验中,T-DXd在HER2阳性乳腺癌脑转移患者显示出显著的中枢神经系统(CNS)反应,在稳定和活动性脑转移患者中,CNS客观缓解率(ORR)和无进展生存期(PFS)均显著改善。这表明T-DXd可能成为HER2阳性乳腺癌脑转移患者的新治疗选择。


HR阳性/HER2阴性乳腺癌治疗的新策略
在HR阳性/HER2阴性乳腺癌中,T-DXd和
戈沙妥珠单抗(SG)作为ADC,对HER2低表达或超低表达的患者显示出潜力。DESTINY-Breast04和DESTINY-Breast06试验的结果表明,T-DXd在HR阳性/HER2阴性乳腺癌患者中具有显著的PFS和OS改善。

TNBC治疗的新策略
在TNBC患者中,SG和芦康沙妥珠单抗(Sac-TMT)作为ADC,对Trop2的高表达的患者显示出治疗疗效。ASCENT试验和OptiTROP-Breast01试验的结果也支持了SG和Sac-TMT在经过多线治疗的TNBC患者中的临床获益,尤其是在PFS方面的改善。
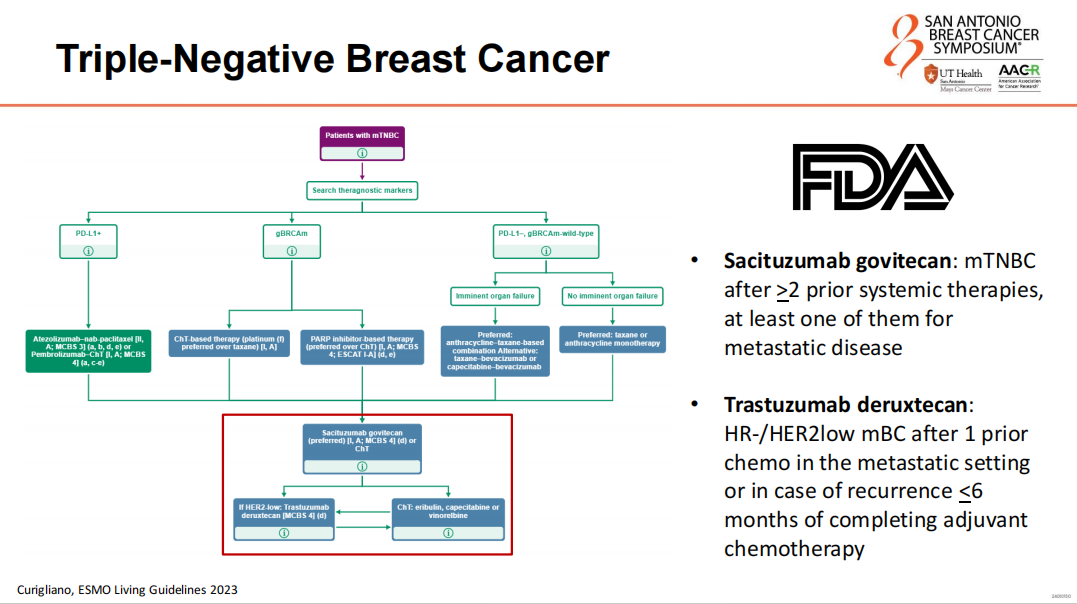
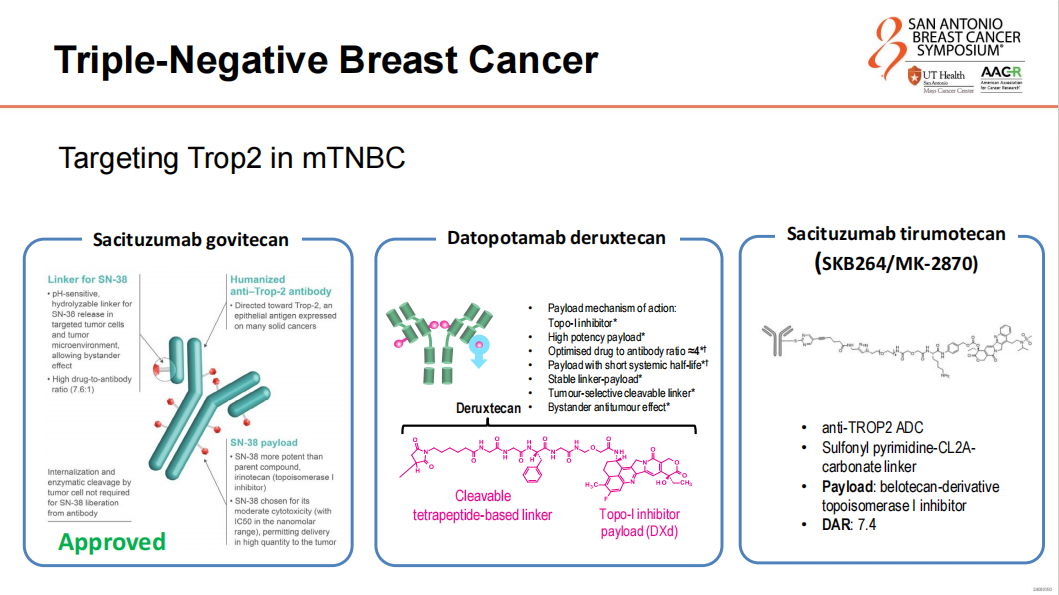
ADC治疗的未来展望
ADC在乳腺癌治疗中的应用正在不断扩展,包括在一线治疗中的潜力。未来的研究将继续探索ADC的最佳序列化、生物标志物的识别以及与免疫治疗的组合,以进一步提高治疗效果并克服耐药性。

ADC开发的艺术:学术界与工业界交汇的洞悉
从学术界到工业界的转变
Ingrid Mayer教授分享了她从学术界转向工业界的经历,特别强调了在阿斯利康作为全球临床策略负责人的角色转变。这一转变不仅标志着个人职业生涯的里程碑,也反映了她在推动ADC发展方面的领导力。

学术界与工业界在ADC临床试验开发中的差异
在ADC临床试验开发中,工业界需考虑全球监管机构的要求以确保注册成功,包括患者群体、对照组、试验设计、剂量优化和统计考虑,同时需考虑生物标志物、伴随诊断测试、多疾病适应症和治疗环境的开发、不同配方的优势、儿科发展、制造/分销问题以及全球标签、商业化和报销策略,而学术界则更侧重于区域性、设计/统计灵活性、预算限制下的小型试验、疾病特定开发,并始终遵循科学/生物学原则,为患者做出利益/风险的最佳决策。

选择最佳ADC靶点
在选择最佳的ADC靶点时,需要考虑的关键因素包括生物学特性、肿瘤表面蛋白密度、内化效率、表达异质性以及正常组织中的表达水平,这些因素共同决定了ADC的疗效和安全性。

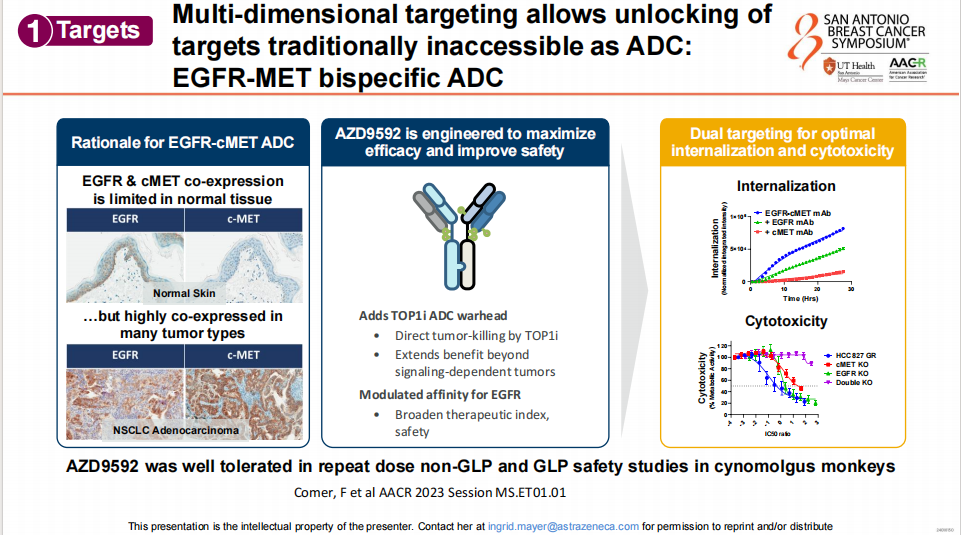
多维靶向在ADC开发中的应用
多维靶向可以帮助解锁传统上难以作为ADC靶点的分子,例如EGFR--cMET双特异性ADC,通过调节对EGFR的亲和力和添加TOP1i ADC载荷来最大化疗效并提高安全性,这种双靶向策略优化了内化和细胞毒性,使其在正常组织中表达有限但在多种肿瘤类型中高度共表达,从而为治疗提供了更广泛的治疗指数和安全性。
位点特异性共轭技术
通过位点特异性共轭技术,ADC的开发性和治疗指数(TI)得到提升,同时减少了非目标毒性,这种技术通过改善抗体的稳定性和降低MTI介导的中性粒细胞减少,从而在提高疗效的同时降低了副作用。

载荷的演变
ADC载荷的演变是从第一代强效DNA损伤剂卡奇霉素,到第二代微管抑制剂,再到第三代拓扑异构酶抑制剂,每一代都致力于提高DAR和Ⅱ期推荐剂量(RP2D)。未来的研究方向致力于先天免疫激动剂、蛋白降解靶向嵌合物(PROTAC)、DNA损伤应答(DDR)抑制剂、表观遗传修饰剂和细胞死亡抑制剂等新型载荷。

实现ADC临床成功的三个领域
为了实现ADC在临床上的成功,需要在三个关键领域进行投资。首先,数字病理学可能为ADC提供更好的预测性生物标志物选择,通过空间数字评分(SDS)测量表达强度和与目标阳性细胞的接近程度,从而改善了对ADC反应的预测,特别是在DG-02研究中,HER2的SDS能够预测患者分层;

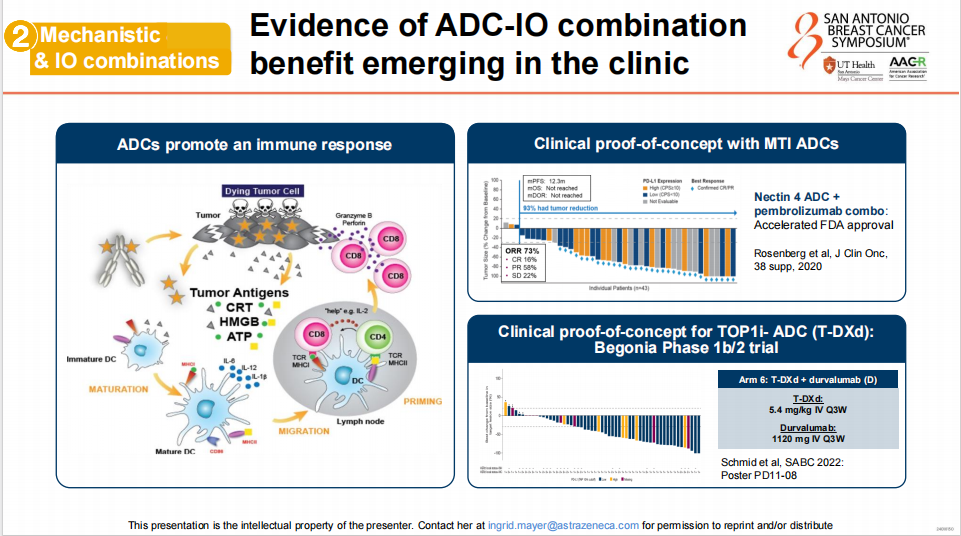
其次,ADC与IO组合的获益正在显现。ADC通过促进免疫反应,激活树突细胞和细胞毒性T细胞,以及通过与MTI ADC和TOP1i ADC(T-DXd)的组合,在患者中显示出了改善的ORR和PFS,这为未来的癌症治疗提供了新的方向;
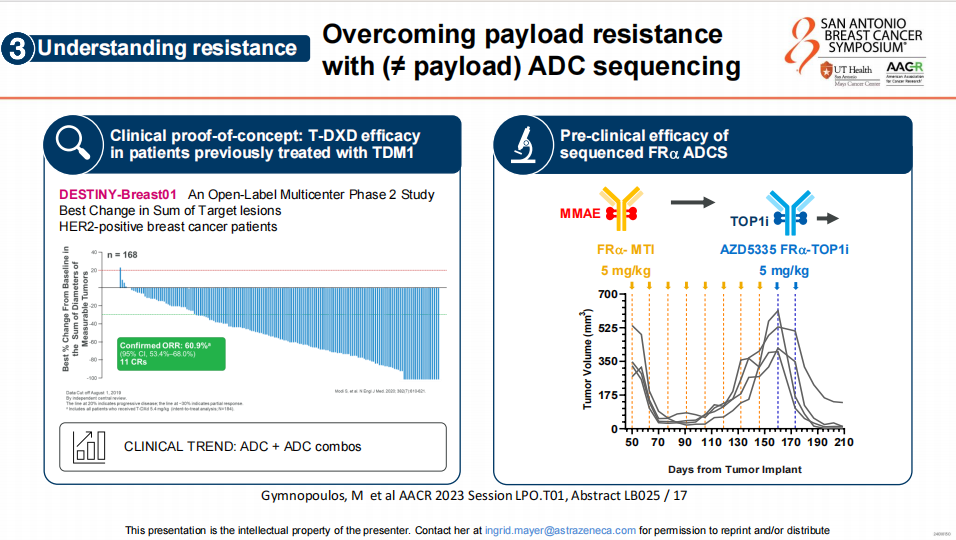
最后,在克服载荷耐药性方面,通过ADC的序列化治疗显示出潜力,同时,通过FRα ADC的序列化治疗在临床前研究中也显示出提高的抗肿瘤疗效,表明通过精心设计的ADC组合和序列化策略可以有效地提高治疗效果并对抗耐药性。
未来方向
展望未来,ADC领域的发展将聚焦于新载荷与连接子的创新、新靶点的探索、利用数字病理学精准评估靶点表达,并通过ADC的组合及序列化治疗策略来克服耐药性,进而重新定义化疗方案,同时借助生物标志物来优化患者治疗响应的预测。

乳腺癌治疗中ADC的精准化发展
ADC领域的快速增长
ADC领域经历了指数级增长,从1980年代首次临床试验到2000年首个ADC获批历经了约20年,第二个ADC(T-DM1)获批用了13年。最近5年内已有8种新型ADC获得批准,预示着未来5年ADC研究将引领我们进入一个快速发展的新阶段。

新型ADC的前景
即将到来的新型ADC,如Dato-DXd和Sac-TMT,携带拓扑异构酶I(Topo I)抑制剂,已在Ⅲ期临床试验中展现出积极结果,有望在短期内成为治疗的新选择。两者均表现出高亲和性和靶向效应,以及旁观者效应,为乳腺癌治疗带来创新疗法。

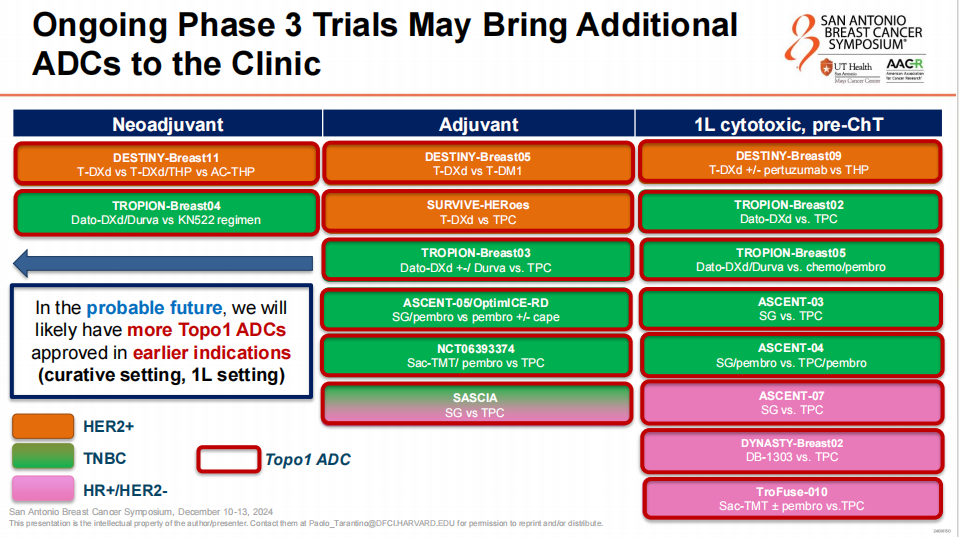
正在进行的Ⅲ期试验
多项正在进行的Ⅲ期临床试验可能会将更多的ADC带入临床。Topo1 ADC有望在HER2阳性、TNBC及HR阳性/HER2阴性乳腺癌患者的新辅助治疗、辅助治疗以及一线化疗前应用中获批。这预示着Topo1 ADC在乳腺癌早期治疗中的潜在应用。
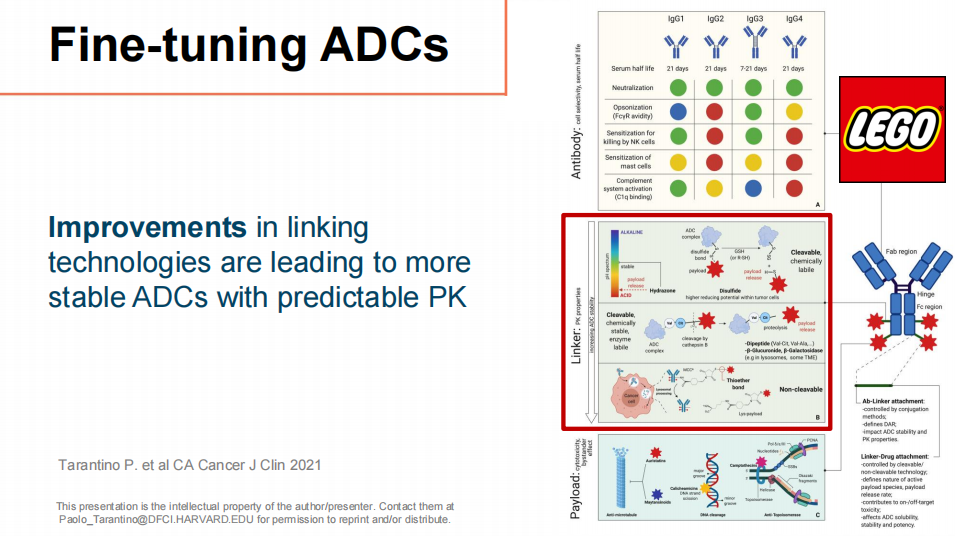
ADC的精细调整
通过改进ADC的连接技术,正在开发更稳定且具有可预测药代动力学(PK)的ADC,这些创新包括新型可裂解和不可裂解的连接子,以及新型载荷,旨在提高治疗效果并减少副作用。

ADC的毒性和剂量优化策略
在乳腺癌治疗中,ADC的毒性由不稳定的连接子和载荷相关毒性主导,而抗体相关毒性虽然常见但很少限制ADC的可耐受剂量;为了优化剂量,已经采取了多种策略,包括剂量封顶、周期限制、反应引导剂量调整以及分割剂量,以最大化风险-效益比并管理ADC的毒性。


未来方向
展望未来,ADC的发展蓝图涵盖了以下几点。可能的未来:将见证更多的Topo1 ADC在早期治疗(新辅助治疗、辅助治疗、一线转移性治疗)中获批;潜在的未来:将开发出能够精准预测ADC活性的定制化组织和血浆生物标志物;可信的未来:将带来创新ADC,这些ADC将提升现有疗法的临床疗效,并在连续治疗中降低交叉耐药性的风险;理想的未来:目标是增强ADC的安全性,并将其治疗效益拓展至肿瘤学领域之外。
在乳腺癌治疗领域,ADC的未来发展方向涵盖了,更多的Topo1 ADC在早期治疗(新辅助、辅助、一线)中获批;开发出能够精细预测ADC活性的组织和/血浆生物标志物;创新ADC改善了早期产品的临床特性,并在连续使用时降低交叉抗性的风险;提高ADC的安全性,并扩大其在肿瘤学以外的治疗获益。

结论与未来研究方向
专家们分别从ADC的发展历程、作用机制、耐药性以及在乳腺癌治疗中的应用与挑战,学术界与工业界的前沿进展以及如何提高ADC的精准治疗四个维度,深入探讨了ADC在乳腺癌治疗中的革命性进展,揭示了ADC如何通过精准靶向癌细胞克服耐药性挑战,并在HER2阳性、HR阳性/HER2阴性及TNBC治疗中展现出潜力。未来五年ADC研究将推动更多创新药物进入临床,优化治疗策略,提高治疗效果。同时应探索ADC在肿瘤学以外领域的应用,为乳腺癌患者带来更安全、有效的治疗选择。
排版编辑:肿瘤资讯-Jenny












 苏公网安备32059002004080号
苏公网安备32059002004080号


