目前,新诊断多发性骨髓瘤(NDMM)的治疗模式已逐步转向四联诱导治疗方案。其中,CD38单抗联合免疫调节剂、蛋白酶体抑制剂及地塞米松已成为标准一线治疗方案。较高比例的患者可实现微小残留病灶(MRD)阴性和无进展生存期(PFS)改善。多项研究表明,达雷妥尤单抗联合卡非佐米、来那度胺和地塞米松(Dara-KRd)方案具有较高的MRD阴性率。
基于此,来自美国Atrium Health Levine癌症研究所的研究人员开展了一项Ⅱ期临床试验[1],评估了Dara-KRd四联诱导治疗NDMM的疗效和安全性,探索了MRD指导下的适应性升阶或降阶治疗,同时还评估了Dara-KRd诱导治疗的适应性免疫调节效应与治疗反应和MRD状态的相关性。近期,该研究结果已发表于Blood advances杂志,【肿瘤资讯】特别邀请黄东平教授对研究进行深入解读,同时展望了NDMM治疗未来发展的趋势。

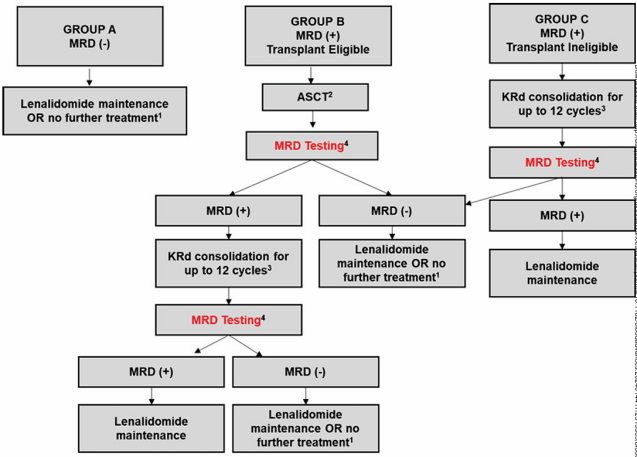
该研究是一项由研究者发起的单臂、两阶段、Ⅱ期试验。纳入的是根据国际骨髓瘤工作组(IMWG)2014标准确诊为NDMM的成人患者,接受总共8个周期的Dara-KRd诱导治疗,包括按照批准剂量和方案皮下注射达雷妥尤单抗,在第1、8和15天静脉注射卡非佐米56mg/m2(第1周期第1天20mg/m2除外),在第1~21天口服来那度胺25mg,以及在每个28天周期的第1、8、15和22天口服或静脉注射地塞米松40mg。诱导治疗后达到≥非常好的部分缓解(VGPR)的患者接受MRD评估,并通过二代测序(NGS)技术将患者分类为MRD阳性或MRD阴性。那些在诱导治疗后没有达到VGPR或没有足够的基线骨髓样本进行克隆性检测的患者被视为MRD阳性。随后基于MRD状态和是否适合ASCT进行分组(图1):A组(MRD阴性)接受来那度胺维持治疗或无进一步治疗(由研究者决定);B组(MRD阳性,适合ASCT患者)接受ASCT;C组(MRD阳性,不适合ASCT患者)接受KRd巩固治疗,最多12个周期(图1)。
主要研究终点是在Dara-KRd诱导结束时的≥完全缓解(CR)率达到70%。次要终点包括诱导治疗后MRD阴性、最佳缓解状态、PFS、总生存期(OS)、总体治疗反应和安全性。
研究结果
2019年12月12日至2022年10月18日期间,共有39例患者入组,患者基线特征如表1所示。中位年龄为62岁(34~78岁)。4例患者(10.3%)为RISS Ⅲ期,15例患者(38.5%)具有高风险细胞遗传学(HRC)特征。
表1. 患者基线特征
疗效
37例患者完成了计划的诱导治疗,其中24例患者被分配到A组,B组和C组则分别为8例和4例患者。中位随访时间为30.1个月(1.7~45.0个月),其中26例患者仍在接受治疗,10例在随访期,3例退出研究(2例死亡,1例失访)。
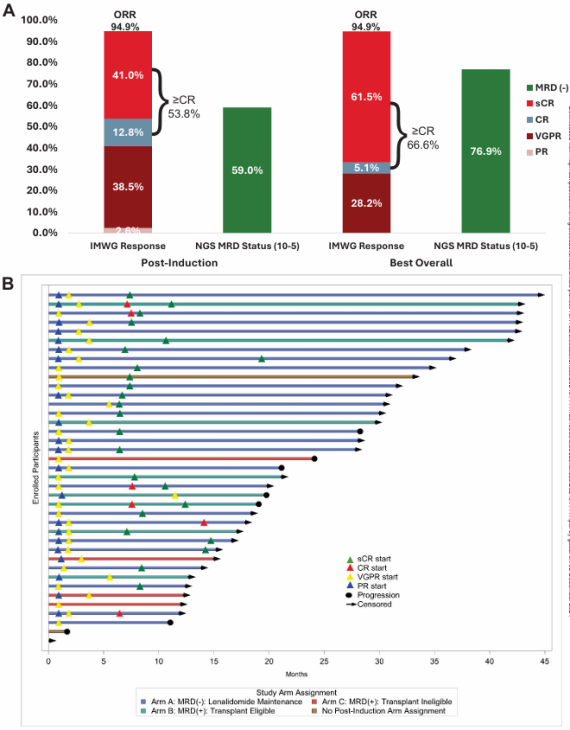
所有39例可评估患者中,有21例患者在诱导治疗结束时达到≥CR(53.8%,90%CI:39.6%,67.7%,P=0.375),其中包括16例患者(41%)达到严格意义上的CR(sCR),未达到预定的统计阈值(即≥CR率达到70%)。诱导治疗结束时的总缓解率(ORR)为94.9%,其中VGPR率为38.5%(15例),PR率为2.6%(1例)(图2A)。在20例IgG-κMM患者中,8例在诱导治疗后达到VGPR。HRC组诱导后的≥CR率为53.3%,标准风险细胞遗传学(SRC)组为54.2%,随着时间的推移,两组的最佳≥CR率均为66.7%。随时间变化的缓解情况如图2B所示。
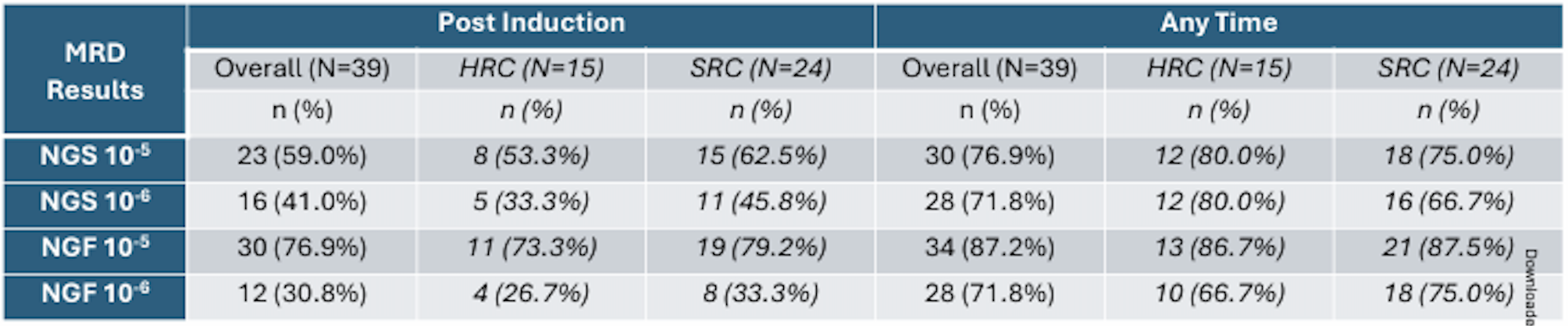
39例患者中有36例可获得诱导治疗末期的NGS MRD结果。在ITT分析中,诱导治疗末期的NGS MRD阴性率为:灵敏度为10-5时为59%,灵敏度为10-6时为41%。诱导治疗结束时,NGS MRD阴性率为:10-5时为77%,10-6时为31%(n=39)。在任何时间点,NGS MRD阴性率在10-5和10-6灵敏度时分别为77%和72%。通过NGF检测,在任何时间点,MRD阴性率在10-5和10-6灵敏度时分别为87%和72%。HRC与SRC患者在诱导治疗后或任何时间的MRD阴性率没有明显差异(表2)。
表2. MRD阴性率的总体情况和细胞遗传学风险分层情况
在23例诱导后NGS MRD阴性(10-5)的患者中,16/20(80%)例患者在6个维持周期后达持续MRD阴性,14/18(77.8%)例患者在12个维持周期后持续MRD阴性。A组中有3例在诱导治疗后已达到NGS MRD阴性(10-6)的患者出现疾病进展(PD)。B组中,5例患者(62.5%)在ASCT后转为NGS MRD阴性(10-5)。C组中,没有患者在开始巩固治疗后1年内转为NGS MRD阴性(10-5)。B组的2例患者和C组的1例患者出现PD或死亡。B组和C组的7例患者在巩固治疗后未达到MRD阴性,其中4例仍存活,且未出现PD。
整个队列的2年PFS率和2年OS率分别为82.5%和97.4%,中位PFS和中位OS均未达到。HRC患者和SRC患者的2年PFS率分别为70.7%和89.4%,2年OS率分别为93.3%和100.0%。
安全性
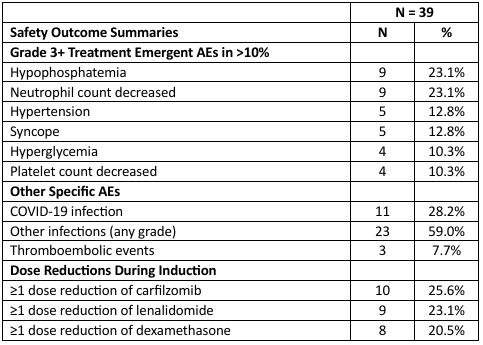
最常见(≥25%)的AE是腹泻(64.1%)、便秘(38.5%)、疲劳(35.9%)、其他感染和寄生感染(33.3%)、上呼吸道感染(33.3%)、咳嗽(30.8%)、恶心(30.8%)、中性粒细胞减少(30.8%)、低磷血症(28.2%)、低钾血症(25.6%)和呕吐(25.6%)。32例患者(82.1%)出现了≥3级AE。最常见的≥3级AE(≥10%)包括中性粒细胞减少(23.1%)和低磷血症(23.1%,表3)。15例患者(38.5%)至少发生过一次SAE,其中9例患者(23.1%)发生与治疗相关的SAE。在诱导治疗期间,2 例患者(5.1%)出现了≥3 级治疗相关的心血管或肺部相关毒性反应,1例患者(2.6%)死于治疗相关的呼吸衰竭。3例患者(7.7%)出现血栓栓塞事件。
表3. 安全性
干细胞动员
共有34例患者进行了干细胞采集。23例患者在完成诱导治疗(7~8个周期的Dara-KRd)后采集干细胞,其中7例首次采集失败,修改方案更早进行干细胞收集后,11例在3~5个周期后采集干细胞的患者中,未报告干细胞采集失败(P=0.069)。
免疫特征分析
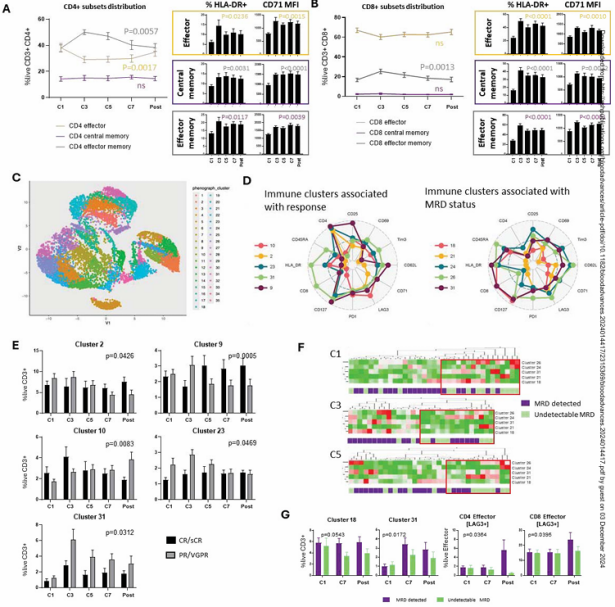
研究评估了Dara-KRd对常规T细胞(CD4+、CD8+)的免疫调节活性。在诱导治疗早期(周期3~5),效应记忆T细胞迅速扩增,而效应T细胞则减少(图3A-B)。Dara-KRd诱导治疗可维持T细胞的活化(HLA DR+)和增殖(CD71 MFI),并在诱导结束时促进可诱导调节性T细胞(Tregs)的扩增(P=0.0058)。中心记忆T细胞的分布保持不变。通过降维分析进一步分析了免疫调节效应与MRD状态的关系(图3C-E)。MRD阴性的患者有较高基线水平的循环γδT细胞[簇24或26],这些细胞在Dara-KRd诱导过程中被激活,还有较高基线水平的激活CD8+效应记忆细胞[簇18]和终末分化效应记忆(TEMRA)CD8+细胞,这些细胞在第3-5周期被Dara-KRd迅速清除(图3D、5F)。诱导治疗后,MRD阴性的患者表现出较低的循环CD8+ TEMRA滴度(P<0.05),同时保持较高的总体效应T细胞适应性,可以通过免疫检查点LAG3表达没有增加来证明(图3G)。
总结
总体而言,尽管研究未能拒绝主要研究终点的零假设,但研究数据证实了Dara-KRd四联诱导方案在NDMM患者中实现了较高的sCR率和MRD阴性率。没有观察到这种联合疗法的新安全性信号。在诱导治疗期间的纵向免疫分析揭示了常规和非常规T细胞的激活以及与MRD相关的免疫亚群的变化。研究结果支持对诱导后MRD阴性的患者进行早期ASCT与不进行早期ASCT的随机试验比较,并对MRD阳性的患者进行强化治疗。
[1] Bhutani M, Robinson M, Foureau D, et al. MRD-driven phase 2 study of daratumumab, carfilzomib, lenalidomide and dexamethasone in newly diagnosed multiple myeloma[J]. Blood Advances, 2024.
[2] Ola Landgren , Malin Hultcrantz , Benjamin Diamond,et al. Safety and Effectiveness of Weekly Carfilzomib, Lenalidomide, Dexamethasone, and Daratumumab Combination Therapy for Patients With Newly Diagnosed Multiple Myeloma: The MANHATTAN Nonrandomized Clinical Trial. JAMA Oncol. 2021 Apr 15. doi: 10.1001/jamaoncol.2021.0611. Online ahead of print.
[3] Costa LJ,et al.Minimal residual disease response-adapted therapy in newly diagnosed multiple myeloma (MASTER): final report of the multicentre, single-arm, phase 2 trial.Lancet Haematol . 2023 Sep 27:S2352-3026(23)00236-3. doi: 10.1016/S2352-3026(23)00236-3.
[4] Derman, B.A., Cooperrider, J., Rosenblatt, J. et al. Final analysis of a phase II trial of daratumumab, carfilzomib, lenalidomide, and dexamethasone in newly diagnosed multiple myeloma without transplant. Blood Cancer J. 14, 87 (2024). https://doi.org/10.1038/s41408-024-01045-3
[5] 2023ASH LBA-1
[6] 2023 ASH oral205
[7] Lancet Haematol. 2023 Nov;10(11):e890-e901.
[8] Lancet Oncol 2023; 24: 139–50
排版编辑:肿瘤资讯-kk











 苏公网安备32059002004080号
苏公网安备32059002004080号


