乳腺癌的异质性使得临床治疗方案因患者的分子特征而有所不同。特别是在激素受体阳性(HR+)和HER2阴性(HER2-)乳腺癌中,存在不同的风险亚群,MammaPrint预后评估系统将其分为低风险(MP-L)和高风险(MP-H1与MP-H2)两大类,二者临床特征和基因表达特征具有差异。近日,Clin Cancer Res发表一项研究,显示HR+/MP-H2肿瘤具有和三阴性乳腺癌(TNBC)高度相似的转录特征和临床结局[1],为乳腺癌分型进一步细化和不同亚型疾病治疗策略提供依据。【肿瘤资讯】整理如下,以飨读者。

研究背景
腔面型(常为HR+)和基底样型(常为HR-)乳腺癌具有大量差异基因表达。基底样癌的特征是高增殖,常见免疫浸润,预后不佳,但是对化疗敏感,接受新辅助化疗和免疫检查点抑制剂(ICI)治疗后,病理完全缓解(pCR)率可达到60%~65%[2,3]。临床中,使用MammaPrint(MP分析)等基因表达为基础的分析,可将HR+/HER2-肿瘤进一步分为基因低风险和高风险组。基因高风险HR+/HER2-肿瘤可从辅助/新辅助化疗中获益。基因低风险和高风险组基本上对应腔面A型和B型分子亚型。腔面A型/基因低风险肿瘤特征是低增殖,具有ER相关基因高表达,辅助内分泌治疗预后良好。腔面B型/基因高风险肿瘤具有更高增殖和免疫相关基因表达和较低的ER调节基因表达[4]。
MP高风险组进一步分为MP-H1(MP评分0~-0.56)和MP-H2(评分-0.57~-1.0)亚组。和MP-H1及MP低风险HR+/HER2-肿瘤相比,MP-H2组的特征是具有更高增殖和DNA修复相关基因表达,更高免疫相关基因表达和更低的ER调节基因表达。当前研究中,使用入组I-SPY2研究患者的治疗前肿瘤标本检测基因表达数据,对比HR+/MP-H2,HR+/MP-H1,TN/MP-H1和TN/MP-H2肿瘤的转录特征和生物学相似性。
研究方法
PY2研究(NCT01042379)是一项多中心随机Ⅱ新辅助平台研究,入组高风险Ⅱ或Ⅲ期乳腺癌患者。研究用于发现新的治疗策略,主要终点是pCR。根据分子分型和MP评分将患者分类,进行各亚组患者的基因表达分析,主元分析,差异基因表达分析,基因集富集分析,并回顾患者临床数据,对比各亚组患者基因表达特征和临床结局。
研究结果
HR+/MP-H2和TNBC具有高度转录相似性
742例HER2-肿瘤的治疗前标本纳入分析,包括274例HR+/MP-H1,105例HR+/MP-H2,305例TN/MP-H2和58例TN/MP-H1肿瘤。和HR+/MP-H1肿瘤相比,HR+/MP-H2肿瘤具有更低的ER百分比阳性(免疫组化ER<10%,45% vs 4%),更高PR低表达(63% vs 28%)和高级别比例(55% vs 31%)。主元分析显示HR+/MP-H2肿瘤和TN/MP-H2肿瘤聚类,提示具有相似转录组特征(图1a-c)。和其他亚组相比,TN/MP-H1肿瘤和TN/MP-H2肿瘤具有更大的转录组相似性。配对欧氏距离测量提示HR+/MP-H2和TN/MP-H2肿瘤较HR+/MP-H2和HR+/MP-H1或HR+/MP-H1和TN/MP-H2肿瘤具有显著更低的平均距离(P<0.001)(图1d)。

HR+/MP-H2和TN/MP-H2肿瘤具有125个显著差异表达基因(图2a),HR+/MP-H2和TN/MP-H1肿瘤具有354个差异表达基因(图2b)。而HR+/MP-H2和HR+/MP-H1肿瘤具有1465个差异表达基因(图2c),TN/MP-H2和TN/MP-H1肿瘤具有559个差异表达基因(图2d)。大多数HR+/MP-H1和HR+/MP-H2肿瘤中不同的基因也在HR+/MP-H1和TN/MP-H2肿瘤中差异表达,证实不论HR状态,MP-H2肿瘤具有转录组相似性(图2e)。这些结果提示HR+/MP-H2肿瘤的转录组特征和TNBC更为相似。
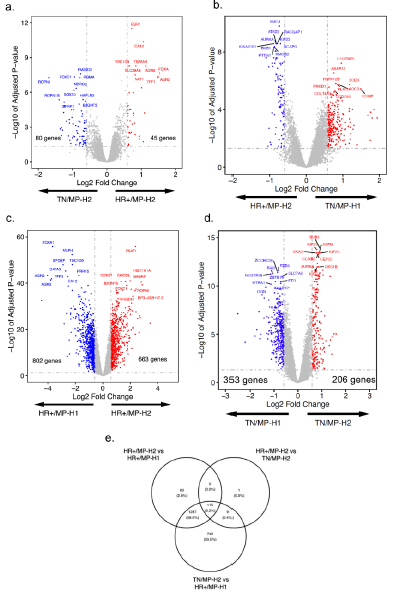
HR+/MP-H1和-H2肿瘤的生物通路差异
使用GO基因集的基因富集分析显示62个基因集在HR+/MP-H2肿瘤中较HR+/MP-H1肿瘤中显著富集,其中36个涉及DNA复制和细胞周期调节,其他涉及RNA加工和细胞代谢。使用KEGG通路分析显示仅2个显著差异表达通路,包括细胞周期和赖氨酸降解,均在HR+/MP-H2肿瘤中过表达。而HR+/MP-H2和TN/MP-H2肿瘤未发现显著差异富集基因集。结果提示TNBC和HR+/MP-H2肿瘤具有相似的高增殖和代谢活性。
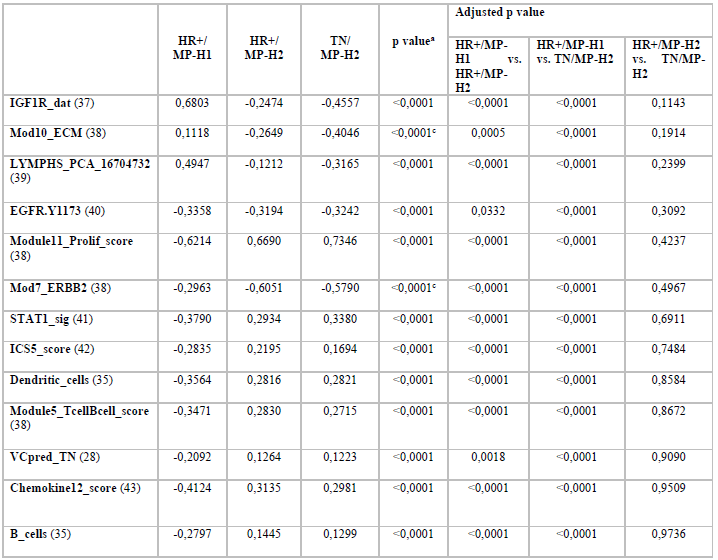
I-SPY2研究评估了32个生物标志物的预测价值,其中13个生物标志物在HR+/MP-H1和-H2或TN/MP-H2肿瘤中显著差异表达(表1)。和HR+/HER2-/MP-H1肿瘤相比,STAT1,T细胞和B细胞评分,整合细胞因子评分5(ICS5),B细胞,树突细胞,趋化因子12特征,VCpred_TN(DNA修复损伤/免疫),增殖评分和ERBB2在两个MP-H2组均更高,符合更高的免疫浸润和增殖活性。
表1. 生物标志物平均表达水平
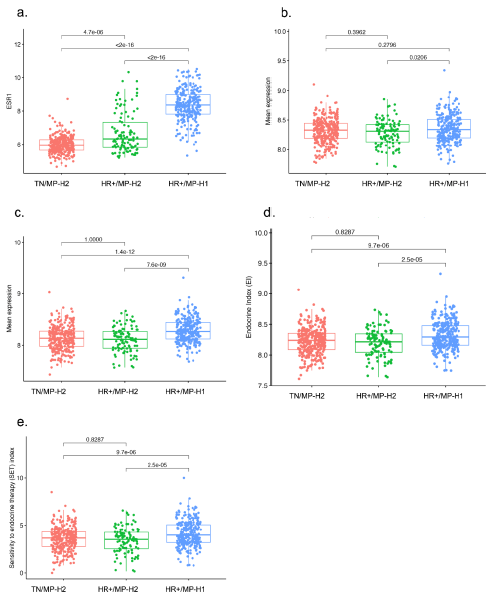
HR+/MP-H1肿瘤具有最高水平的ER相关和肥大细胞生物标志物。ESR mRNA表达在HR+/MP-H1中最高,其次是HR+/MP-H2,而在TN/MP-H2肿瘤中最低,具有统计性显著性差异(P<0.0001)(图3a)。HR+/MP-H2和TN/MP-H2肿瘤基因特征包括ESR1正相关基因,内分泌指数(EI),内分泌治疗敏感性(SET)指数较低,无显著性差异。2组都较HR+/MP-H1肿瘤具有显著更低的内分泌治疗敏感性特征表达水平(P<0.0001)(图3b-e)。数据提示HR+/MP-H2肿瘤的低内分泌敏感性。
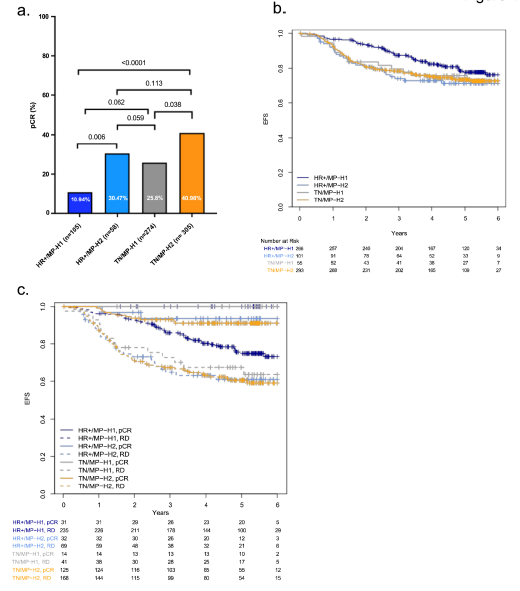
I-SPY2研究中各组临床结局
TN/MP-H2,HR+/MP-H2,TN/MP-H1,HR+/MP-H1肿瘤的pCR率分别是41%,30.5%,26%和11%。TN/MP-H2和HR+/MP-H1肿瘤间(P<0.0001)、HR+/MP-H2和HR+/MP-H1肿瘤间(P=0.038)差异具有统计学显著性,但是TN/MP-H2和HR+/MP-H2肿瘤间(P=0.0628)、HR+/MP-H2和TN/MP-H1肿瘤间(P=0.059)无显著性差异(图4a)。
中位随访4.7年,HR+/MP-H2和TN/MP-H2肿瘤的3年无事件生存(EFS)率分别是74%和78%。HR+/MP-H1肿瘤的3年EFS率显著更高,为87%(图4b)。达到pCR的患者具有更佳的EFS结局,新辅助治疗后具有残留疾病的HR+/MP-H2或TN/MP-H2肿瘤患者预后均不良(图4c)。结果提示不论HR状态,MP-H2肿瘤的临床行为具有相似性。
研究讨论
研究显示部分HR+/HER2-乳腺癌具有和TNBC类似的转录特征。HR+/MP-H2肿瘤和TN/MP-H2肿瘤具有最大相似性,HR+/MP-H1和TN/MP-H2肿瘤的转录差异也显著小于TN/MP-H2和TN/MP-H2癌症。
HR+/MP-H2肿瘤具有较低的ESR1表达,ER阳性比例和ER调节基因表达,因而内分泌敏感性不佳。HR+/MP-H2肿瘤的内分泌敏感(SET)指数也很低,类似于TNBC,提示这些ER阳性肿瘤中大多数为非功能性ER信号。
研究发现HR+/MP-H2肿瘤具有细胞周期调节,DNA修复,染色体分离和染色质重塑相关基因高表达,类似于TN/MP-H2肿瘤。这些结果和高增殖表型相符,具有更高复发风险和更大化疗敏感性。其他TN和HR+/MP-H2癌症相似的特征包括高免疫相关基因表达,高免疫细胞浸润和免疫相关基因表达,与更高的pCR率相关[5]。TN/MP-H2(41%)和HR+/MP-H2(30.5%)肿瘤具有最高总pCR率,其次是TN/MP-H1(26%),最低的是HR+/MP-H1(11%)。高水平的免疫基因表达和更高的免疫治疗敏感性相关[2,3]。I-SPY2免疫组的汇总分析显示HR+/MP-H2肿瘤中ICI加入标准新辅助化疗后pCR率显著改善,而HR+/MP-H1肿瘤中则无改善[6]。该研究人群的EFS分析进一步支持不论HR状态,MP-H2肿瘤的临床结局相似性。
总之,研究发现HR+/MP-H2和TN/MP-H2乳腺癌具有转录组和临床相似性。这些相似性提示可使TNBC获益的治疗方法如术前免疫和化疗也可使HR+/MP-H2肿瘤获益,目前正在随机Ⅲ期SWOG S2206研究(NCT06058377)中验证。
研究结论
HR+/MP-H2癌症的转录组和临床特征与TN/MP-H2类似,如具有高增殖,高免疫浸润和低雌激素受体相关转录活性,二者可能可获益于相同治疗策略。
[1] Rios-Hoyo A, et al. Hormone Receptor Positive HER2-negative/1 MammaPrint High-2 Breast Cancers Closely Resemble Triple Negative Breast Cancers. Clin Cancer Res. 2024 Nov 19.
[2] Nanda R, et al. Effect of Pembrolizumab Plus Neoadjuvant Chemotherapy on Pathologic Complete Response in Women With Early-Stage Breast Cancer: An Analysis of the Ongoing Phase 2 Adaptively Randomized I-SPY2 Trial. JAMA Oncol. 2020;6(5):676-684.
[3] Pusztai L, et al. Durvalumab with olaparib and paclitaxel for high-risk HER2-negative stage II/III breast cancer: Results from the adaptively randomized I-SPY2 trial. Cancer Cell. 2021;39(7):989-998.e5.
[4] Yersal O, et al. Biological subtypes of breast cancer: Prognostic and therapeutic implications. World J Clin Oncol. 2014;5(3):412-24.
[5] Danaher P, et al. Gene expression markers of Tumor Infiltrating Leukocytes. J Immunother Cancer. 2017:5:18.
[6] Huppert LA, et al. Pathologic complete response (pCR) rates for HR+/HER2- breast cancer by molecular subtype in the I-SPY2 Trial. 2022 ASCO abs 504.
声明:材料由阿斯利康支持,仅供医疗卫生专业人士参考
审批编号:CN-149535
过期日期:2025-12-09
责任编辑:肿瘤资讯-Kelly
排版编辑:肿瘤资讯-江江











 苏公网安备32059002004080号
苏公网安备32059002004080号


