急性髓系白血病(AML)是一种机制复杂的恶性血液病,其发生通常涉及多基因驱动及多步骤协同作用,尤其在伴有FLT3突变(FLT3m),NPM1m和CEBPAm等突变患者中,预后显著较差[1]。此外,继发性AML(sAML)患者不仅生存预后不良,还具有独特的基因组特征[2],进一步加大了治疗的复杂性和挑战。
即将召开的第66届美国血液学年会(ASH)将重点展示“7+3”方案(阿糖胞苷联合伊达比星或柔红霉素)在AML治疗中的最新研究进展。【肿瘤资讯】将系统梳理相关研究成果,探讨AML治疗领域的创新动态与未来方向。
以“7+3”方案为基础的强化疗方案强效出击,为新发AML患者保驾护航


精华速递:在新发AML患者中,“7+3”方案作为经典的诱导治疗手段,不仅在预后良好及中等风险患者中展现出卓越的疗效,也为实现长期缓解奠定了重要基础。
➢预后良好AML
O450:60~75岁伴有NPM1m的低风险AML患者接受IC vs VEN/HMA治疗回顾性分析[3]
主要研究目的
研究将比较强化疗(IC)与维奈克拉/低甲基化药物(Ven/HMA)在60~75岁伴有NPM1m低风险AML患者中的疗效差异。
主要研究方法
本项回顾性研究对55例60~75岁、低风险、伴有NPM1m的AML患者进行分析,比较了接受标准强化化疗(IC,n=36)与Ven/HMA(n=19)治疗患者的总生存期(OS)。
两组患者在性别、种族及基线特征方面无显著差异。然而,IC组患者的中位年龄较小(66.1岁vs69.6岁),且在首次缓解后接受移植治疗的患者比例更高。
主要研究结果
● 在AML患者的治疗中,IC组与Ven/HMA组的缓解率相似,但两组患者的中位总生存期(mOS)存在差异,分别为6.2年和4.9年。然而,在单变量模型分析中,两组的OS差异并未达到统计学显著性(p = 0.523)。
● 进一步分析显示,AML患者的性别、诊断时年龄、基因突变状态、PS评分和髓外疾病等基线特征与OS无显著相关性。另外,AML患者较高的基线WBC与较差的OS呈现一定关联(p = 0.05),而首次缓解时进行移植则与更优的OS显著相关(p = 0.01)。
主要研究结论
本项分析显示,60~75岁、NPM1m且低风险的AML患者在接受IC或Ven/HMA一线治疗后均取得了良好的治疗效果。
P2885:为期7天的VEN联合IC诱导治疗在新诊断AML患者中的疗效[4]
主要研究目的
研究旨在验证为期7天的VEN联合IC方案(柔红霉素[DNR]联合阿糖胞苷[Ara-c]、高三尖杉酯碱(HHT)联合Ara-c和阿克拉霉素[acla]或HHT联合DNR和Ara-c)作为新诊断AML患者诱导治疗的疗效和安全性。研究的次要目标是评估入组患者的OS率和无事件生存率 (EFS)。
主要研究方法
本研究共纳入247例AML患者(VEN+DA:108例;VEN+HAA:105例)和一项回顾性研究(VEN+HAD,34例),中位年龄为43岁。
治疗方案:
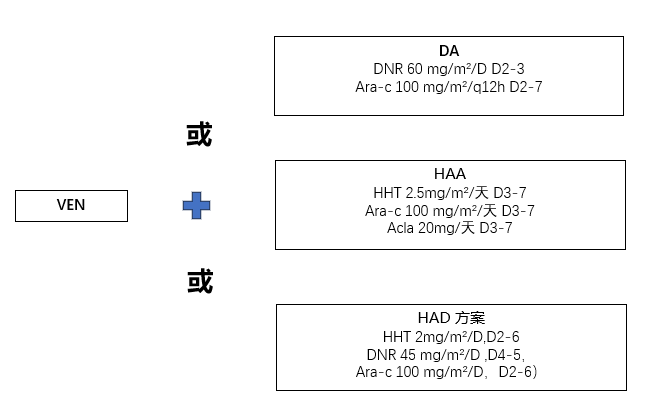
主要研究结果
● 研究的mOS和EFS尚未达到,预估12个月OS率和EFS率分别为80.7%和77.4%。
● EN+DA组、VEN+HAA组和VEN+HAD组的预估12个月OS率和EFS率无显著差异(12个月OS率:80.1%、77.3%和88.6%,p=0.36;EFS率:77.0%、76.0%和84.6%,p=0.53)。
● 研究的CRc(完全缓解+部分缓解)率为92.1%,MRD阴性率为93.7%。
● 在亚组比较分析中,VEN+DA组、VEN+HAA组和VEN+HAD组的cCR率同样无显著差异(92.3%、93.2%和88.2%,p =0.645)。但三组的MRD阴性率存在差异,VEN+HAD组MRD阴性率相对较低,分别为91.9%、98.9%和84.8%(p=0.013)。
● 研究中18.3%的AML患者接受了异基因造血干细胞移植(HCT)。其中,VEN+HAD 组接受HCT患者比例相对较高(35.3%),另外两组分别为12.0%和18.1%(p=0.012)。
● 研究中最常见的不良反应(AE)包括中性粒细胞减少症(100%)和血小板减少症(100%)等。此外,入组患者的中性粒细胞和血小板计数的中位恢复时间均为13天。
主要研究结论
VEN联合含Ara-C的IC方案是一种高效且安全的诱导治疗方案,能够显著改善含NPM1m的新诊断AML成年患者的生存预后。
➢ 预后中等AML
P4274:不同诱导治疗方案对CEBPAbZIP-Inf突变AML患者预后的影响[5]
主要研究目的
本研究回顾性分析了携带 CEBPAbZIP-inf AML患者的临床特征、共突变谱及不同诱导方案对其预后的影响。
主要研究方法
共有103例CEBPAbZIP-inf AML患者符合入组条件,其中44例患者采用常规“7+3” IC方案进行诱导治疗,20例患者采用VEN+HMA方案,27例患者采用VEN+IC方案。相对于IC组和VEN+IC组,VEN+HMA组患者的中位年龄相对更大。研究分析了入组患者的临床特征、共突变谱、总缓解率、CRc率、OS和EFS。
主要研究结果
● IC组、VEN+HMA组和VEN+IC组患者的中位随访时间分别为815.0天、599.0天和673.0天,三组的mOS分别为未达到、652.0天和未达到。与VEN+HMA组相比,IC组和VEN+IC组患者的mOS显著延长(IC组 vs. VEN+HMA组,p=0.0025;VEN+IC组 vs. VEN+HMA组,p=0.0183)。
● IC组、VEN+HMA组和VEN+IC组的中位EFS无显著差异(IC vs.VEN+HMA,p= 0.168;VEN+IC vs. VEN+HMA,p= 0.227;IC vs. VEN+IC,p= 0.915)。在按年龄分层的分析中,三组的OS和EFS也未展现出显著差异。
● 在1周期诱导治疗后的完全缓解或血细胞计数未完全恢复的缓解(CR/CRi)率方面,三组的结果较为相似(IC组:79.55%,VEN+IC组:96.3%,VEN/HMA组:80%),但VEN/HMA组的复发率相对较高(50%)。
主要研究目的
对于CEBPAbZIP-infAML患者,在诱导治疗1个周期后,IC、VEN+HMA、VEN+IC方案显示出相似的CRc率,而含IC诱导治疗方案可为CEBPAbZIP-inf患者带来更长的mOS。
➢预后不佳AML
针对预后不佳的AML患者,特别是伴FLT3m、FLT3-ITDm、复杂核型(如NPM1突变和KMT2Ar)以及染色体5和7异常的患者,研究表明,IC联合治疗展现出良好的疗效和可接受的安全性。该治疗方案在降低肿瘤负荷、提高CR率和延长EFS方面表现出显著优势,且AE发生率可控,为高危AML患者提供了有效的治疗选择。
FLT3m
O221:II期Precog 0905研究—吉瑞替尼联合“7+3”IC治疗伴有FLT3m新诊断AML的缓解率和移植率均更高[6]
主要研究目的
研究旨在比较吉瑞替尼(G)与米哚妥林(M)联合“7+3”IC方案在FLT3-ITD或TKDm新诊断AML患者诱导和巩固治疗中的FLT3m阴性率和CRc率。
主要研究方法
II期Precog 0905研究中共有177例(G组,n=90;M组,n=87)18~70岁,非M3型且未发现核心结合因子重排的AML患者接受治疗。G组和M组分别有80%和78.2% 的患者存在FLT3- ITD。研究者将按照突变类型(仅TKD与ITD[+/- TKD])、NPM1突变状态和 FLT3 -ITD等位基因比率对入组患者进行分层。
治疗方案:
诱导治疗
● Ara-c (100 mg/m2,D1~D7)+DNR(90 mg/m2,D1~D3)+G(120mg,每日1次,D8~D21)/M(50mg,每日2次,D8~D21)
巩固治疗
● Ara-c(1.5-3 g/m2,共6剂,D8~D21)+G/M(D8~D21)
研究的主要终点为诱导治疗后AML患者在FLT3 m MRD阴性情况下的CRc率。次要终点包括比较不同组患者的CRc、MRD率(灵敏度为10-3)以及生存率。
主要研究结果
●G组的CRc率高于M组(85.6%vs72.4%,p=0.042)。诱导治疗后,G组FLT3突变阴性(FLT3m-)患者的CR率为40%,M组为47.1%(p=0.366)。
● 在仅发生FLT3-TKDm患者和伴有FLT3-ITD、NPM1和DNMT3Am患者中,G组的CRc率和FLT3m- CRc率均相对更高。在FLT3-ITDm (+/- TKDm)患者中,G组CRc率较高,而M组FLT3m- CRc率相对较高。

● 在27例达FLT3m+ CRc患者中,1周期巩固治疗后,G组和M组的FLT3m转阴率分别为83%和44.4%。
● 探索性分析显示, G组和M组分别有66%和46%的AML患者在首次缓解后接受了HCT治疗。
● 在诱导治疗期间, G组和M组≥3级治疗相关不良事件(TRAE)发生率分别为73%和70%;在巩固治疗期间, 两组≥3级TRAE发生率分别为79%和73%。两组中未观察到与治疗相关不良事件导致的死亡。
主要研究结论
G联合“7+3”IC诱导治疗方案在 70 岁以下的新诊断FLT3m AML 患者中展现出优异的 CRc 率,且无治疗相关死亡。
P4282:在真实世界中,米哚妥林vs奎扎替尼联合“7+3”方案作为FLT3-ITDm AML患者强化诱导治疗的疗效[7]
主要研究目的
本研究旨在评估真实世界中接受“7+3”方案联合M或奎扎替尼治疗AML 患者的特征、治疗模式和相关结果。
主要研究方法
本项回顾性多中心队列研究纳入了110例接受”7+3”方案联合M或奎扎替尼一线治疗的新诊断AML患者。研究者对入组患者的基线人口统计学特征和疾病特征、治疗剂量和疗程、安全性事件和缓解率进行了描述性分析。 另外,研究者还比较了接受 90 mg/m2与 60 mg/m2 DNR治疗AML患者的数据结果。
主要研究结果
● 奎扎替尼联合“7+3”方案组的CRc率显著更高(85% vs 73%,p=0.004)。
● 两组患者的mOS均未达到。在M联合治疗组中,复发率为32%,中位复发时间为8.3个月。在随访期间,暂未观察到奎扎替尼联合治疗组患者复发。
● 奎扎替尼联合“7+3”方案组中无AML患者需要再诱导治疗,而M组中有17.3%的患者需要再诱导治疗(p=0.04)。
● 与奎扎替尼联合“7+3”方案治疗相比,M联合治疗后AML患者更可能发生剂量调整、中断或提前停药(26% vs 5%,p=0.04)。
● M联合治疗组的中位随访时间为48个月,奎扎替尼联合治疗组为4.1个月,前者有44例患者死亡,而后者仅有2例患者死亡。
● 二次分析发现,DNR不同剂量组的CRc、复发、移植和安全性事件的发生率没有显著差异。
主要研究结论
本项真实世界研究结果显示,接受奎扎替尼联合“7+3”方案治疗的FLT3-ITDm AML患者的CR率相对更高,且较少出现TKI剂量中断,亦不需要再次诱导治疗。
复杂核型NPM1m或KMT2Ar
O215:Ib期研究—Menin-KMT2A抑制剂联合IC诱导治疗伴有KMT2Ar或NPM1m新诊断AML的疗效[8]
主要研究目的
本研究旨在明确bleximenib联合“7+3”方案(DNR/伊达比星诱导治疗),随后进行Ara-c巩固治疗,在符合条件的新诊断NPM1m或KMT2Ar AML患者中的安全性和初步疗效。
主要研究方法
本项Ib期研究共包含22例新诊断AML患者,中位年龄为58岁。入组患者中各有11例患者伴有NPM1和KMT2Ar。
治疗方案:
剂量递增阶段:
“7+3”方案(Ara-c[200mg/m2/D]+DNR[60mg/m2/D]或伊达比星[12mg/m2/D])+Bleximenib(每日2次)
巩固治疗阶段:
● Ara-c+Bleximenib:最多4个周期
主要研究结果
● 在获得缓解的AML患者中,从诱导治疗第1天至血小板计数恢复(50x109/L)的中位时间为32天,至中性粒细胞计数恢复(0.5x109/L)的中位时间为32天。
● 在疗效可评估的患者中(8例NPM1m,6例KMT2Ar)中,总缓解率(ORR:≥PR)为93%(79% CR;86% CR/CRh),达CR的中位时间为30天。
● 按基因型划分,KMT2Ar AML患者的ORR为83%(83% CR/CRh),NPM1m AML患者的ORR为100%(88% CR/CRh)。
● 研究中有14%的AML患者出现≥3级TRAE。研究中暂未未观察到分化综合征(DS)或剂量限制性毒性(DLT)。尽管研究中观察到2例1级QTcF延长,但并非由Bleximenib引起。
主要研究结论
初步研究结果显示,在新诊断AML患者特别是复杂核型NPM1m或KMT2Ar患者中,“7+3”方案联合Bleximenib诱导治疗具有初步的抗白血病活性和可接受的安全性,且未观察到DS或DLT。
P214:KOMET-007研究Ia期中期结果—“7+3”方案联合Ziftomenib诱导治疗新诊断的NPM1m或KMT2Ar AML患者的疗效[9]
主要研究目的
Ia期KOMET-007研究探索了“7+3”方案联合ziftomenib用于新诊断NPM1-m 或 KMT2A-r AML患者的疗效。)
主要研究方法
截至2024年6月21日,Ia期KOMET-007研究将34例新诊断、高危NPM1m(44%)或KMT2A-r (56%)AML的成人患者(年龄≥18岁)分别纳入对应的剂量递增队列中。Ia 期研究的主要终点是 DLT和AE;关键次要终点包括AML患者的CRc和MRD状态。
治疗方案:
Ziftomenib(200、400或600mg/D,C1D8开始持续服用)联合“7+3”方案(Ara-c联合DNR)
主要研究结果
● 在Ziftomenib 200mg和400mg剂量水平下,NPM1m患者的CRc率分别为100%和86%。其中,获得缓解患者的MRD阴性率分别为100%和80%。对于KMT2A-r患者,该剂量水平下的CRc率分别为90%和63%,获得缓解的患者的MRD阴性率分别为83%和100%。
● 相对于NPM1m患者,C1结束时未出现持续性AML的KMT2A-r患者在200mg和400mg剂量水平下,中性粒细胞恢复(ANC≥1K)和血小板恢复(≥100K)的中位时间均相对较短。
● 在200mg或400mg剂量水平下,未观察到DS、Ziftomenib相关QTc延长或剂量限制性毒性(DLT)。
主要研究结论
KOMET-007研究证实,“7+3”方案联合Menin抑制剂Ziftomenib作为诱导治疗,在复杂核型NPM1m或KMT2ArAML患者中耐受性良好,各剂量水平的安全性一致,且具有强大的临床活性。
染色体5和7异常
P4281:VEN+MA vs IC诱导治疗染色体5和7异常AML患者的疗效[10]
主要研究目的
研究比较了采用 IC (“7+3”或CPX-351)与 VEN+HMA治疗的del(7)/del(7q) 和/或 -5/del(5q) AML患者的预后。
主要研究方法
本项回顾性研究纳入1125例新诊断AML的患者,228例入组患者(20%)有del(7)/del(7q)(61%)和/或del(5)/del(5q)(64%)。所有患者均接受IC(38%)或VEN+HMA的治疗(62%)。VEN+HMA组患者中位年龄较大,且更有可能携带TP53m和复杂核型; IC 组存在MDS疾病史、HMA 暴露史、RUNX1、BCOR、RAS通路等突变的患者比例均较高。
主要研究结果
● 在整个研究中,伴有del(7)/del(7q)和/或del(5)/del(5q)的患者的mOS显著短于无这些基因异常的患者(7.4个月 vs 27个月,p<0.001)。在这类患者中,IC组的mOS更长(10个月 vs 6.1个月,p=0.0032)。IC治疗组与VEN+HMA治疗组在60-75岁AML患者中的mOS相当(7.6个月 vs 6.4个月,p=0.67)。
● 研究还发现,接受allo-SCT的AML患者的mOS显著长于未接受移植的患者(24个月 vs 5.5个月,p<0.0001),且不受移植前治疗影响(21个月 vs 25个月,p=0.49)。
● 在出现继发共突变的AML患者中,IC治疗组的mOS更长(14个月 vs 5.7个月,p=0.045)。然而,在新发和TP53共突变患者中,IC组和VEN+HMA组的mOS无显著差异(13个月 vs 13个月,p=0.49;8.3个月 vs 6个月,p=0.11)。
● 在IC组和HMA+Ven组中,CRc率相当,分别为40%和41%。两组实现形态学无白血病的患者比例分别为 5% vs 14%。
● IC治疗后的allo-SCT率更高(53% vs 18%,p<0.001)且复发率更低(35% vs 76%)。
主要研究结论
在本研究中,携带del(7)/del(7q)和/或del(5)/del(5q)的AML患者总体生存结果较差。IC诱导治疗可显著改善该类患者的OS,特别是对于伴有继发共突变的患者。另外,IC治疗后患者接受移植的比例更高,且复发率更低。总体而言,IC或可为del(7)/del(7q)和/或del(5)/del(5q)的AML患者带来更大的生存获益。
“7+3”为代表的强化疗方案助力sAML老年患者突破生存瓶颈,缓解率大幅提升


精华速递:虽然低强度治疗方案通常被认为对AML老年患者较为适宜,但本次ASH中的研究表明,IC诱导治疗可以显著提高患者的治疗效果和生存期以及后续的移植成功率,尤其是对于能够耐受强化治疗的患者效果显著。
P4236:经HMA治疗的sAML后续治疗策略[11]
主要研究目的
回顾性研究旨在比较IC与低强度 (LI) 方案在sAML患者中的疗效差异。
主要研究方法
本研究对105例2005年6月~2024年1月新诊断的sAML成年患者数据进行回顾性分析。入组患者至少接受过1周期单药HMA治疗。sAML患者的诱导治疗方案分为IC(“7+3”、CLAG+/-M[克拉屈滨、高剂量Ara-c、粒细胞集落刺激因子[G-CSF]和米托蒽醌]、FLAG[氟达拉滨、Ara-c、G-CSF]、CPX-351)和低强度诱导(LI,VEN、靶向药物、其他)方案。研究中分别有50%的AML患者接受了IC诱导和LI诱导治疗。
主要研究结果
● 在接受IC诱导化疗的sAML患者中,ORR为60%,其中CR率为27%。相比之下,接受LI诱导治疗的患者缓解率较低,ORR为20%,其中CR率为9%。
● 所有入组患者的mOS为7.7个月。接受IC和LI治疗的患者OS存在差异,IC组为9.8个月,LI组为5.3个月(p=0.02)。
● 接受基于VEN的LI作为一线和二线诱导治疗的sAML患者接受HCT的比例较低(9%)。另外,接受allo-SCT治疗可延长sAML患者的mOS(13.3个月 vs 5.5个月[仅化疗],p=0.0001)。
● 研究中30天和60天的死亡率分别为6.67%和18.1%。
主要研究结论
本项单中心回顾性分析结果表明,与LI疗相比,先前接受过HMA治疗的sAML老年患者可从IC诱导治疗中获益更大,患者的中位生存期延长,后续移植的成功率也较高。
总结
经典的“7+3”方案作为AML治疗的基石,其卓越疗效已在新发AML患者中得到广泛验证,尤其对于伴有特殊突变和不良预后的患者群体,展现出重要的临床价值。
在预后良好的AML患者中,“7+3”方案作为标准诱导治疗,仍为缓解病情和延长生存的首选。对于高风险AML患者,“7+3”方案不可或缺。结合靶向治疗的“7+3”联合治疗方案提高了FLT3-ITDm患者的CR率和移植率,降低了复发风险。在sAML老年患者中,尽管治疗挑战较大,“7+3”方案仍展现出较为可靠的疗效,尤其对于体力和耐受性较差的患者,该方案为缓解病情和后续移植奠定了基础。
总体而言,随着个体化治疗策略的不断发展,基于“7+3”方案的强化治疗将继续为AML患者,特别是伴特殊突变和不良预后的高风险患者,提供强有力的治疗支持。
1.赵晨曦,张岚.FLT3-ITD突变在急性髓系白血病中的研究进展[J].中华转移性肿瘤杂志, 2024, 07(01):74-78.DOI:10.3760/cma.j.cn101548-20231120-00121.
2.Dou X, Dan C, Zhang D, et al.Genomic mutation patterns and prognostic value in de novo and secondary acute myeloid leukemia: A multicenter study from China. Int J Cancer. 2024;1‐12. doi:10.1002/ijc.35125
3.https://ash.confex.com/ash/2024/webprogram/Paper210320.html
4.https://ash.confex.com/ash/2024/webprogram/Paper198844.html
5.https://ash.confex.com/ash/2024/webprogram/Paper211698.html
6.https://ash.confex.com/ash/2024/webprogram/Paper201595.html
7.https://ash.confex.com/ash/2024/webprogram/Paper205931.html
8.https://ash.confex.com/ash/2024/webprogram/Paper207072.html
9.https://ash.confex.com/ash/2024/webprogram/Paper198218.html
10.https://ash.confex.com/ash/2024/webprogram/Paper204467.html
11.https://ash.confex.com/ash/2024/webprogram/Paper206258.html
排版编辑:肿瘤资讯-Rex











 苏公网安备32059002004080号
苏公网安备32059002004080号


