复发/难治性急性淋巴细胞白血病(R/R ALL)患者的预后普遍较差,治疗面临着严峻挑战。我国R/R ALL成人患者的临床治疗常采用挽救化疗及±造血干细胞移植方案,尽管这一策略能够提供短期缓解,但其总生存期(OS)仍较短,预后较为不良。近年来,免疫治疗的进展为R/R ALL患者带来了新的治疗希望,显著提高了患者的生存率。其中,奥加伊妥珠单抗(InO)作为一种靶向CD22的新型抗体-药物偶联物(ADC)已在国内获批用于治疗成人R/R B-ALL患者。同时,InO也于2024年获得FDA批准用于治疗CD22阳性R/R B-ALL儿童患者。这也证实了InO在R/R在ALL治疗领域出色的表现,对于改善该类患者生存预后的重要意义。含InO的治疗方案多元且支付可及性高,为R/R ALL患者带来了更丰富的治疗选择。多项研究证实,含InO的治疗方案不仅在复发难治领域展示出良好的疗效,在ALL的全病程管理方面也表现卓越。
2024年12月7日~10日,第66届美国血液学会(ASH)年会将在圣地亚哥隆重举行。本届大会上,与R/R ALL治疗相关的最新研究成果备受关注,多项前沿进展展示了以InO为首的免疫疗法的潜力与发展方向,令人期待。【肿瘤资讯】特别整理了本次大会上与R/R ALL相关的部分前沿研究疗效结果,详情如下。
高效低毒:InO联合治疗为R/R B-ALL患者提供更广阔的治愈前景


精华速递:InO联合治疗方案作为桥接治疗或预处理治疗,有望进一步提高R/R B-ALL患者的生存预后,尤其是在细胞免疫治疗和干细胞移植等治疗手段的应用中,InO为患者提供了更好的治疗窗口,改善了其临床结局。
P3458:Ib/II期FELIX研究—含InO桥接治疗对于obe-cel CAR-T细胞在R/R B-ALL成人患者中扩增和持久性的影响[1]
主要研究目的
Ib/II期FELIX研究探索了含InO的桥接治疗、不含InO的桥接治疗、以及不进行桥接治疗对R/R B-ALL患者预后的影响,重点评估其对肿瘤负荷、CAR-T细胞扩增能力及持久性的潜在作用。
主要研究方法
研究中共有127例18岁以上且CD19+ R/R B-ALL患者符合入组条件。在入组患者中,接受含InO桥接治疗的患者筛查时的骨髓(BM)原始细胞百分比在数值上显著高于接受不含InO桥接治疗的患者,而后者又高于未接受桥接治疗的患者(分别为82%、40%和20%)。
治疗方案:
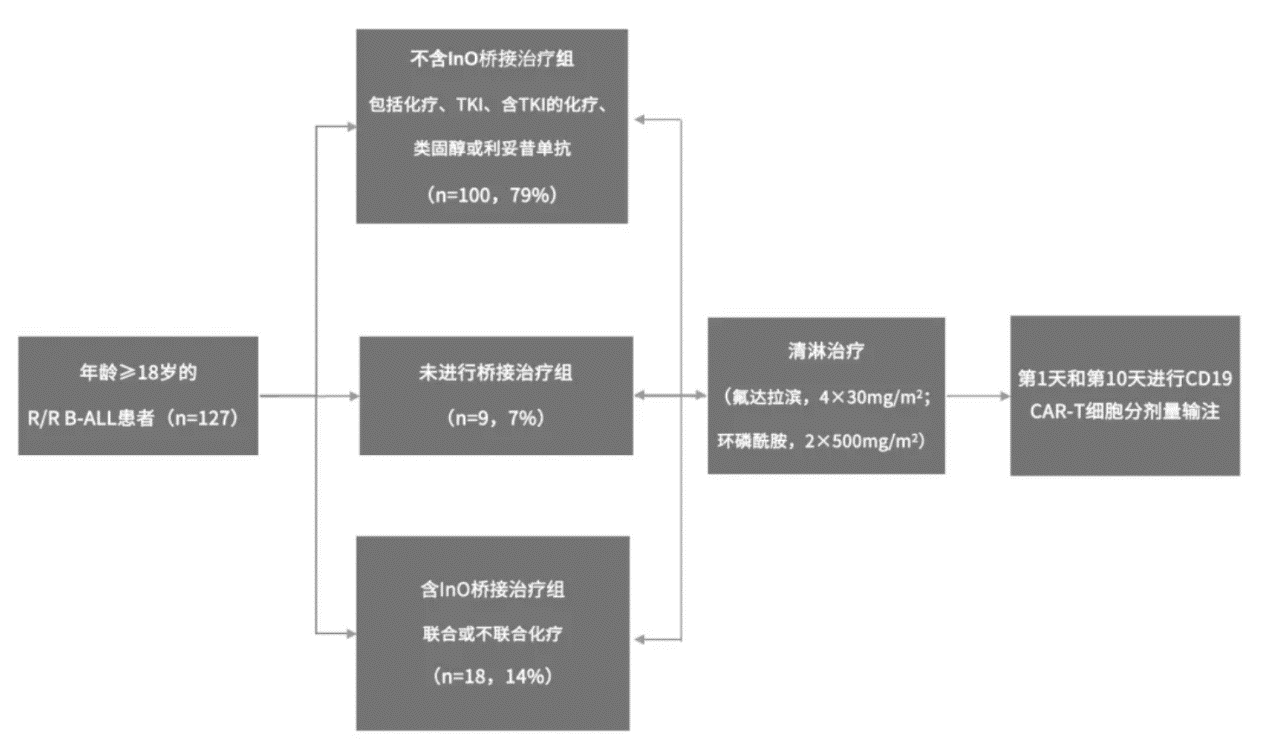
主要研究结果
● 含InO 桥接治疗可有效减轻B-ALL患者在清淋(LD)时的肿瘤负荷。在接受预处理时,含InO 桥接治疗组,不含InO桥接治疗组和不接受桥接治疗组患者的骨髓原始细胞百分比的中位数分别降至2%,52%和30%。
● 所有组CAR-T细胞扩增率均较高,且从含InO 桥接治疗组到不含InO 桥接治疗组,再到未进行桥接治疗组,CAR-T细胞扩增率呈逐渐上升趋势。此现象可能与含InO桥接治疗患者在筛查时BM原始细胞比例较高、肿瘤负荷较大有关,与桥接治疗方案无关。
● 中位随访时间为21.5个月,含InO 桥接治疗组、不含InO 桥接治疗组和未进行桥接治疗组的中位无事件生存期(EFS)分别为22.1个月、9.0个月和未达到;中位总生存率(OS)分别为23.8个月、14.1个月和未达到。
主要研究结论
在CAR-T细胞输注前,含InO 桥接治疗可有效减轻R/R B-ALL患者的疾病负担,尽管接受含InO桥接治疗的患者在筛查时BM原始细胞比例较高、肿瘤负荷较大,但该组的治疗结果仍非常出色。与不含InO桥接的治疗组相比,含InO桥接治疗组患者显示出更长的EFS和OS(均超过20个月),为患者带来长期生存获益。同时,该项研究强调了在CAR-T细胞治疗R/R B-ALL患者前选择适当的桥接治疗方案的重要性。根据目前的研究结果,三组的CAR-T细胞的扩增和长期持续性没有明显差异,这表明CAR-T细胞的长期持续性与桥接治疗和LD时的初始肿瘤负荷均无关。


精华速递:除细胞免疫治疗外,异基因造血干细胞移植(allo-HCT)是R/R ALL患者的重要治疗方案之一。然而,移植后的肝窦阻塞综合征(SOS)/肝小静脉闭塞症(VOD)严重影响ALL患者的生存预后。在ALL患者allo-HCT的预处理方案中加入InO不仅可进一步提高疗效,且安全性良好。
P2124:II期前瞻性试验—在ALL和侵袭性淋巴恶性肿瘤患者的allo-HCT预处理方案中加入InO的疗效[2]
主要研究目的
II期前瞻性研究探索了含InO的allo-HCT预处理方案在ALL和侵袭性淋巴恶性肿瘤患者中的疗效。
主要研究方法
9例年龄在18~70岁之间, CD22(+)且需要进行造血干细胞移植的ALL患者符合入组标准。此外,入组患者必须有1位HLA相合的同胞供体,如无同胞供体,则必须有1位HLA-A、HLA-B、HLA-C和DRB1相匹配的非亲属供体(MUD)。在入组患者中,主要采用的前期疗法包括InO和贝林妥欧单抗(Blina)。另外,在移植前ALL患者接受的InO最大剂量为1.2、1.5、2.7和2.7 mg/m2,还有1例ALL患者在外部机构接受了未知剂量的InO治疗。
治疗方案:
● 移植前:InO(0.3 mg/m2,第13天[D13]门诊静脉注射)+氟达拉滨(30 mg/m2,D2~D5)+美法仑(140 mg/m2,D2)+兔抗人胸腺细胞免疫球蛋白(1 mg/kg,D1~D2)
● 移植后:接受MUD移植的ALL患者将接受额外剂量的甲氨蝶呤(5 mg/m2,D11)
主要研究结果
● 中位随访时间为13个月,研究的2年总生存(OS)率和无进展生存(PFS)率分别为62%和60%。
● 在HCT后,ALL患者中性粒细胞计数恢复至0.5 x 109/L以上的中位时间为12天,血小板计数恢复至20 x 109/L以上的中位时间为13天。
● 所有ALL患者均成功实现供体细胞植入,且未发生继发性移植物衰竭。
● 研究中有2例ALL患者复发。
主要研究结论
现有研究数据显示,InO联合美法仑和氟达拉滨作为ALL患者HCT预处理方案,显示出令人鼓舞的疗效。然而,该方案的有效性和安全性仍需在更大规模患者群体中进一步验证。
灵活可及,InO联合化疗方案为R/R B-ALL患者提供多元化治疗选择


精华速递:近年来,InO在R/R B-ALL患者中的临床应用取得了令人瞩目的成果。在今年的ASH大会上,最新研究数据显示,InO联合化疗方案在R/R B-ALL患者中的应用也展现了其显著的治疗优势,且能够为不同支付水平的患者提供灵活的治疗选择,对于该类患者的治疗具有重要临床意义。
P4209: DA-EPOCH联合InO可作为R/R B-ALL成年患者安全有效的挽救疗法[3]
主要研究目的
II期研究探索了DA-EPOCH(剂量调整的依托泊苷联合泼尼松,长春新碱,环磷酰胺和多柔比星)联合InO挽救治疗在R/R B-ALL患者中的长期疗效。
主要研究方法
共有33例年龄≥18岁,器官功能正常,体能状态良好的R/R CD22+ B-ALL符合入组条件。研究者对比了2019年10月~2022年9月接受DA-EPOCH-InO治疗的患者与2023年1月~2024年5月接受标准治疗(SOC)的患者的数据。
治疗方案:
● DA-EPOCH(D1~D5)+InO(以3个剂量水平[DL]给药:DL1给予0.3mg/m2, D8和D15;DL2给予0.6mg/m2,D8和0.3mg/m2,D15;DL3给予0.6mg/m2,D8和D15)。
● 所有患者均接受了熊去氧胆酸和抗感染预防治疗。
主要研究结果
● 研究的总缓解率(ORR;形态学CR率+影像学CR率/部分缓解[PR]率)为82%。在治疗前血细胞/骨髓细胞数量超过5%的B-ALL患者中,形态学CR率为85%,其中82%的患者达到MRD阴性。
● 在伴有髓外疾病的B-ALL患者中,ORR为75%,其中CR率为62.5%(5/8)。
● 对于存活的B-ALL患者,中位随访时间为21.7个月,中位OS为17.0个月,中位EFS为10.0个月。
● 在缓解期接受巩固治疗的B-ALL患者中,有44%的B-ALL患者接受了HCT,其中33%的患者复发,而未接受HCT治疗患者中有62%的患者复发。
主要研究结论
随着随访时间的延长和纳入患者数量的增加,研究显示DA-EPOCH-InO方案在R/R B-ALL患者中的缓解率保持在历史最高水平,同时显著提高了缓解患者接受后续移植治疗的可能性。此外,InO具有可在门诊给药的优势,无需住院,大大提升了治疗的便捷性和可及性。这一特点在B-ALL的临床实践中具有重要意义,为患者提供了更灵活的治疗选择,并为改善其生存预后带来了新的希望。
P2811:mini-hyper-CVD联合剂量密集InO和Blina治疗R/R B-ALL患者的长期随访结果结果[4]
主要研究目的
II期研究探索了低剂量化疗联合剂量密集(D-D)InO 和Blina治疗在R/R B-ALL中的疗效。
主要研究方法
2013年2月~2024年2月,共有133例≥18岁的R/R B-ALL的患者符合入组条件,其中第1~67例患者属于队列1,第68~110例患者属于队列2,第111~133例患者属于剂D-D组。74%的入组患者处于挽救治疗 (S)1阶段,14%的患者处于S2阶段,12%的患者处于S3+阶段。
治疗方案:
队列1(第1~67例患者):
● 诱导治疗:mini-HCVD(C1~C8)+InO(1.3-1.8 mg/m2,C1D3;0.8-1.3 mg/m2,C2~C4)
● 维持治疗:POMP
队列2(第68~110例患者):
● 诱导治疗:InO(0.6 mg/m2和 0.3 mg/m2,C1D2和D8;0.3mg/m2,C2~C4的D1和D8,累积剂量为 2.7mg/m2)
● 巩固治疗:Blina(4 个周期)
● 维持治疗:18 个月的POMP方案治疗,且每 3 个月交替使用Blina
队列3(第111~133例):
● 诱导治疗:mini-HCVD +InO (0.6 mg/m2和 0.3 mg/m2,C1D2和D8;0.3mg/m2,C2~C4的D1和D8) +Blina(每个周期的D4 ~D21,最多 6 个周期)
● 巩固治疗:Blina(4 个周期)
● 维持治疗:18 个月的POMP方案治疗,且每3个月交替使用Blina
主要研究结果
● 在所有疗效可评估的R/R B-ALL患者中(n=132),ORR为86%(CR率为65%)。而队列1,队列2和D-D组患者的ORR分别为76%(CR率为60%),93%(CR率为66%)和100%(CR率为81%)。
● 对于C1后MRD阴性率和总体治疗后MRD阴性率,分别为53%和85%,队列1中分别为51%和82%,队列2中分别为46%和85%,D-D组中分别为74%和95%。此外,94%的D-D组患者在接受更精准MRD检测时仍维持MRD阴性状态。
● 中位随访时间为40个月,研究整体的3年OS率为45%,RFS率为44%。与处于S2+阶段的R/R B-ALL患者相比,处于S1阶段的患者OS获益更大(3年OS率:54%vs20%;P=0.0001)。在4个月的里程碑分析中,接受移植的患者3年OS率为60%,而未接受移植的患者为56%(P=0.61)。
● 与其他组相比,D-D组患者的生存获益显著更大。(第1组1年OS率:51%,第2组1年OS率:66%,D-D组1年OS率:90%[P=0.006])。在三组中,处于S1阶段的患者的1年OS率分别为63%、66%和94%(P=0.08)。
主要研究结论
Mini-HCVD联合InO和Blina治疗方案在R/R B-ALL患者中显示了良好的有效性。InO分次给药以及引入Blina的策略,有助于进一步提高该联合治疗方案在R/R B-ALL患者中的疗效。进一步分析表明,采用早期D-D给药方案能够为R/R B-ALL患者带来更高的深度缓解率,并且改善了其长期生存预后。
总结
基于本次ASH大会公布的研究结果,含InO的治疗方案在R/R ALL患者中展现出卓越疗效,特别是在桥接治疗、移植预处理及挽救治疗中的应用均取得显著成果。InO的使用不仅有效降低肿瘤负荷,还显著提高后续治疗的可能性及疗效,为改善患者长期生存获益带来希望。此外,InO治疗可在门诊实施,显著减轻住院治疗负担,多元化的治疗方案为不同支付能力的患者提供灵活且多样化的治疗选择。
自2021年在中国上市以来,InO已惠及数千名患者,VOD发生率约为2%,其优异疗效与安全性已在中国真实世界中得到验证。随着研究的深入推进,含InO的治疗方案有望成为R/R ALL领域的重要选择,为更多患者提供改善长期生存的机会。同时,ADC的广泛应用也将助力ALL全程管理的优化,期待这一领域进一步突破,为患者带来更大获益。
1. https://ash.confex.com/ash/2024/webprogram/Paper201514.html
2. https://ash.confex.com/ash/2024/webprogram/Paper203864.html
3. https://ash.confex.com/ash/2024/webprogram/Paper208875.html
4. https://ash.confex.com/ash/2024/webprogram/Paper210501.html
排版编辑:肿瘤资讯-Melody











 苏公网安备32059002004080号
苏公网安备32059002004080号


