
诺贝尔奖得主、德国科学家Paul Ehrlich教授在百余年前首次提出“魔法子弹”的概念,希望有一种系统治疗药物能特异性杀伤肿瘤细胞而不损伤正常组织细胞。抗体偶联药物(ADC)通过将单克隆抗体与细胞毒药物偶联,使这一愿望成为现实。目前ADC药物已发展至成熟阶段并进入临床应用。
【肿瘤资讯-HER2大师课】特邀哈尔滨医科大学附属肿瘤医院于雁教授深度解析新型ADC药物的结构和作用机制。
内科教研室主任 博士生导师
中国临床肿瘤学会(csco)理事
黑龙江省抗癌协会常务理事
黑龙江省医学发展基金理事
黑龙江省医学会理事会理事
中国抗癌协会化疗专业委员会常委
中国临床肿瘤学会肿瘤支持与康复治疗委员会常委
中国医促进会肿瘤肿瘤舒缓治疗学分会常委
中国医药教育协会肺部肿瘤专业委员会常委
中国抗癌协会癌症康复与姑息治疗委员会常委
中国抗癌协会肺癌专业委员会委员
中国抗癌协会肿瘤异质性与个体化治疗专委会常委
黑龙江省医师协会肺癌专业委员会主任委员
黑龙江省医学会癌症姑息息治疗委员会主任委员
黑龙江省抗癌协会癌症康复与姑息治疗专业委员会主任委员
黑龙江省抗癌协会肿瘤药物临床研究专委会候任主任委员
中华转移性肿瘤杂志编委
中国肿瘤临床与康复杂志编委
魔法子弹的实现与发展
从襁褓到成熟阶段
ADC药物的发展主要分为三个阶段:
第一个阶段从理念的提出到多种技术实现逐一突破,最终于2000年首个ADC药物Gemtuzumab ozogamicin得以上市,用于血液系统恶性肿瘤的治疗。在此期间,研究者发现鼠源抗体具有较高的免疫原性;科学家首次将甲氨蝶呤与抗体成功连接,使其能直接作用于细胞;单克隆抗体技术解决了抗体纯化和免疫原性的问题;新靶标和高效细胞毒药物的发现为ADC的发展提供了更多可能性。
第二个阶段,ADC药物结构不断升级,科学家解决了ADC的异质性和不稳定性等问题。值得一提的是,Gemtuzumab ozogamicin此前因安全性问题退市,在调整剂量后于2017年重新上市。
2010年之后,ADC药物进入蓬勃发展的第三阶段,多种ADC药物相继获批上市并进入临床应用。截至目前全球范围内约有16种ADC药物上市,2000多种ADC药物正在研发中。新一代ADC药物HER2 ADC德曲妥珠单抗于2023年首次在中国获批上市。
 图1 ADC药物的三个发展阶段
图1 ADC药物的三个发展阶段
精准与强效的融合:
塑造高效低毒新一代ADC药物
传统化疗具有缺乏肿瘤特异性、剂量依赖性细胞毒性和治疗窗窄等的局限性。与“杀敌一千,自损八百”的化疗药物相比,ADC药物即精准“导弹”,在达到靶病灶后才发挥作用,可减少对正常组织细胞的大规模杀伤。靶向疗法通常缺乏更强的细胞毒性,容易耐药,且在克服异质性肿瘤、合并突变肿瘤细胞等方面疗效较差。相较而言,ADC药物同时克服了两种传统疗法的局限性,通过单抗靶向作用,高效杀伤肿瘤细胞的同时,拓宽了最低有效剂量和最大耐受剂量的治疗窗,是精准和强效的完美结合。
经过百年来的发展,ADC药物不断迭代,在结构和组成方面不断优化,第三代ADC药物的抗体主要采用全人源/工程化单克隆抗体,连接子主要为可裂解连接子,载药采用专为ADC定制的更强细胞毒载荷,且具有旁观者效应。因此,第三代ADC药物具有高效、低毒的特点和优势。
新型ADC的三大作用机制
新型ADC可以通过ADC通过精准、高效杀伤肿瘤细胞,靶向信号通路、及抗体介导的抗肿瘤免疫反应等作用机制,发挥高效抗肿瘤作用机制。
①核心作用机制:ADC药物通过结合抗原、内化进入细胞,由溶酶体特异性裂解释放高效细胞毒药物,扰乱癌细胞的DNA及微管蛋白功能,而发挥抗肿瘤效应。
②ADC通过旁观者效应,能杀死肿瘤周围的异质性肿瘤细胞和转移瘤细胞(无论是否表达靶抗原)。只有具有较好细胞膜通透性的载药才能产生旁观者效应。
③ADC药物介导肿瘤免疫效应:ADC的抗体成分与免疫效应细胞结合,引发抗肿瘤免疫,包括补体依赖的细胞毒性(CDC)、抗体依赖的细胞介导的细胞毒性作用(ADCC效应)、抗体依赖的细胞介导的吞噬作用(ADCP)。
④ADC药物抑制下游信号通路:ADC的抗体成分自身可靶向抗原,可以干扰目标受体的生物学功能,抑制下游信号传导以抑制肿瘤生长。
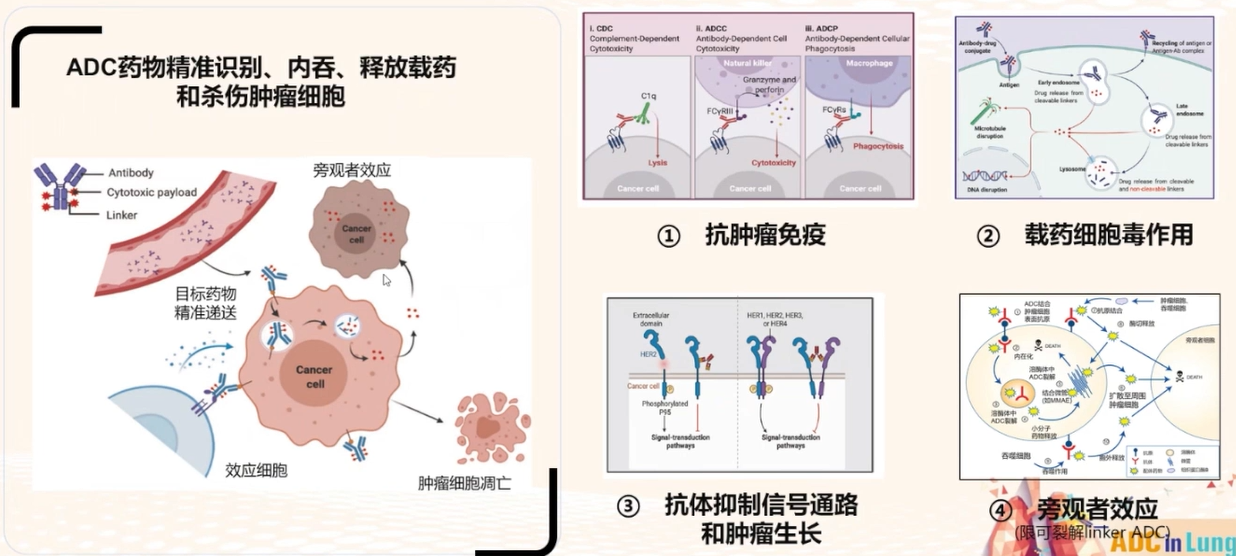 图2 新型ADC药物的多重作用机制
图2 新型ADC药物的多重作用机制
一枝独秀,德曲妥珠单抗的
结构优势和作用机制
德曲妥珠单抗由精准靶向HER2曲妥珠单抗、肿瘤选择性可裂解四肽连接子和高活性细胞毒载药偶联而成。
德曲妥珠单抗采用人源化
抗HER2 IgG1单抗——曲妥珠单抗:
①德曲妥珠单抗保留了抗HER2单抗曲妥珠单抗的生物学活性;
②偶联DXd未影响可介导免疫反应的ADCC效应。
药物抗体比(DAR)为8,达到理论最高值:
DAR值超越现有的ADC药物。DAR=8值即每个单抗携带8个细胞毒载药,即每个导弹一次能打出8发子弹,可高效杀伤肿瘤细胞。
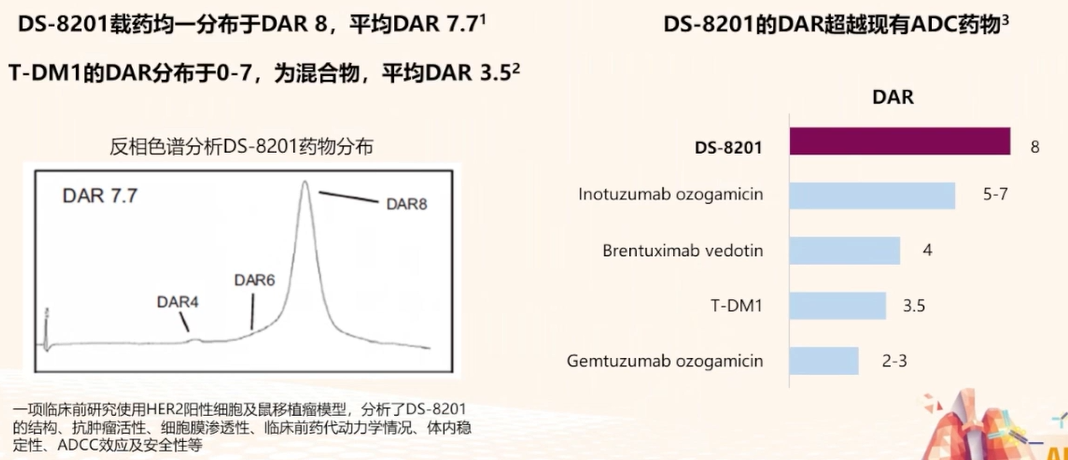
图3 DAR值为8
细胞毒载药-高毒性、高效旁观者效应:
德曲妥珠单抗的载药为新型拓扑异构酶I抑制剂DXd,DXd是由喜树碱衍生而来的高活性抗肿瘤药物,其抗肿瘤活性是传统化疗药物的100-1000倍,是SN38的10倍;且与常见紫杉类或微管抑制剂类药物具有不同的作用机制,能避免交叉耐药。
游离DXd具有高效旁观者效应:DXd具有良好的膜通透性,易穿过细胞膜,高效杀伤不表达特异性抗原的邻近异质性肿瘤细胞。
游离DXd半衰期短:动物实验中单次注射游离DXd能被快速代谢,半衰期仅约1.37h,利于释放载药后的系统毒性控制;而半衰期长的游离载药易在正常组织累积而对正常组织造成损伤。
 图4 DXd与其他ADC载药
图4 DXd与其他ADC载药
连接子-血浆中高度稳定,释放后快速代谢:
德曲妥珠单抗采用可裂解的四肽连接子,在血液循环中高度稳定,脱落率极低,仅在进入特异性肿瘤细胞后,被溶酶体酶特异性裂解。一项临床前研究显示,德曲妥珠单抗与总体抗体代谢相似,表面连接子在血浆中稳定,在人、猴、鼠血浆中,21天血浆中DXd释放率不到4%,人血浆中释放率约2%。
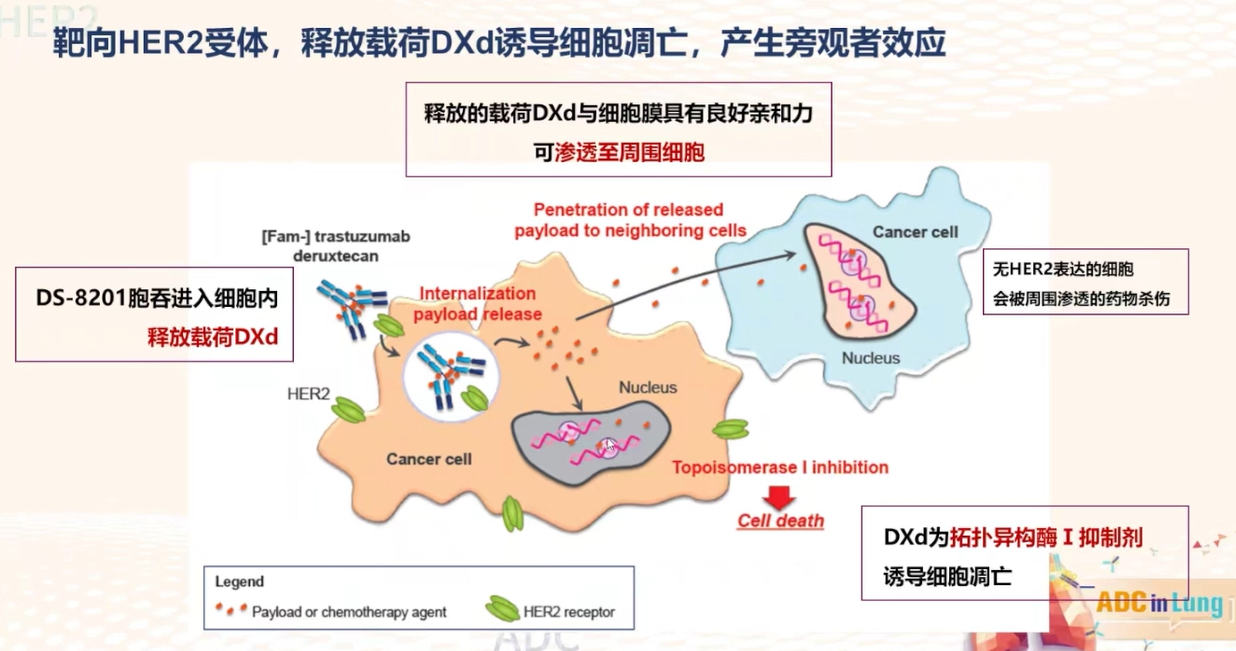 图5 德曲妥珠单抗作用机制
图5 德曲妥珠单抗作用机制
总而言之,德曲妥珠单抗在血液循环中高度稳定,与HER2抗原特异性结合后内吞进入肿瘤细胞。胞内溶酶体酶可特异性识别连接子GGFG位点,使DXd在肿瘤细胞内快速释放载药;DAR值为8使得一个抗体同时释放8个载荷,是现有ADC药物满载荷状态,保证了对肿瘤细胞最大程度地高效杀伤。被释放的游离DXd易于穿透细胞膜,可杀伤邻近异质性肿瘤细胞,发挥强效旁观者效应。另外,德曲妥珠单抗的特异性抗体部分具有抗肿瘤免疫效应,同时能抑制肿瘤相关信号传导通路。从作用机制来看,德曲妥珠单抗不单纯是仅释放有效载荷发挥抗癌作用,同时还有免疫效应和阻滞信号传导通路的作用。
总结
化疗是抗肿瘤治疗领域的主要治疗手段,开发出能选择性靶向目标肿瘤细胞的系统疗法一直以来是肿瘤学家和科学家的愿望。在“魔法子弹”思想的影响下,随着新技术的进步,ADC药物研发迎来不断的创新和突破,目前已有多种ADC药物进入临床应用。德曲妥珠单抗作为全球和国内肺癌领域目前首个且唯一获批的ADC药物,优选抗体、连接子和载荷,结构设计优化升级,能通过三大作用机制发挥高效低毒的抗肿瘤作用。期待随着临床的广泛应用,ADC药物改善患者预后,造福广大肺癌患者。
排版编辑:肿瘤资讯-Ale











 苏公网安备32059002004080号
苏公网安备32059002004080号


