
研究背景
乳腺癌是全球女性中最常见的癌症,也是癌症相关死亡的第二大原因。据统计,2022年美国报告了287,000例新发病例和约43,000例死亡病例[2],其中HER2阳性乳腺癌约占新发患者的20%。HER2-neu基因编码的癌蛋白属于表皮生长因子受体(EGFR)家族的一员。未经治疗的HER2阳性乳腺癌通常表现出更具侵袭性的表型,具有较高的复发率和较差的预后。
抗HER2单克隆抗体的发展极大改善了HER2阳性乳腺癌的预后。曲妥珠单抗自1998年起被批准用于HER2阳性转移性乳腺癌患者,后来也被批准用于新辅助和辅助治疗。帕妥珠单抗是一种人源化HER2靶向单克隆抗体,与化疗和曲妥珠单抗联合使用成为转移性HER2阳性乳腺癌一线治疗的金标准。这一方案也被批准用于新辅助治疗,证明了其在改善无进展生存期(PFS)和总生存期(OS)方面的显著疗效。尽管如此,HER2靶向药物的疗效受限于耐药性的出现。ADC作为一种新兴治疗策略,其目标是延缓或预防耐药性的产生,并提高转移性乳腺癌患者的疗效。
ADC的结构
ADC由靶向肿瘤特异性抗原的人源化单克隆抗体和通过连接子连接的细胞毒药物载荷组成。ADC中的抗体通常为IgG1型,因其相较于其他IgG亚型更易于制造且具有更强的免疫原性。抗体结构包含两个负责识别抗原的可变区(Fabs)和一个负责与效应免疫细胞相互作用的恒定区(Fc)[3]。理想的抗体应具有高亲和力、低免疫原性、良好的内吞性能以及相对较长的血浆半衰期。其主要免疫效应功能包括激活免疫细胞、补体依赖细胞毒性(CDC)、抗体依赖细胞介导的细胞毒性(ADCC)以及抗体依赖的细胞吞噬作用(ADCP)。
有效载荷是ADC杀伤肿瘤细胞的关键因素,细胞毒载荷可分为几类,包括抗微管蛋白(例如maytansine类、auristatin类)、拓扑异构酶I抑制剂(如deruxtecan、govitecan)、DNA损伤剂(如calicheamicins、duocarmazine、pyrrolobenzodiazepines)以及RNA聚合酶II抑制剂(如amanitin)。这些药物单独使用时可能具有高毒性,因此与抗体结合以实现选择性递送和靶向杀伤[4]。
ADC的连接子在ADC的稳定性和药代动力学特性中起到关键作用。连接子可以是可裂解的或不可裂解的。可裂解的连接子通常对肿瘤特异性的环境因子敏感,如pH变化、氧化还原条件或溶酶体酶活性,而不可裂解的连接子则需要更复杂的加工过程来释放细胞毒载荷。
作用机制与临床活性
恩美曲妥珠单抗(T-DM1)是获批用于治疗转移性乳腺癌的抗HER2 ADC,由曲妥珠单抗(HER2靶向IgG1单克隆抗体)和emtansine(DM1,一种微管抑制剂)通过不可裂解的连接子构成。T-DM1的药物-抗体比率(DAR)为3.5。T-DM1的作用机制主要包括以下几方面起效:将美坦辛选择性释放到HER2阳性肿瘤细胞中,抑制HER2信号通路,并促进HER2细胞外结构域的脱落。T-DM1还可以通过抗体依赖的细胞介导的细胞毒性(ADCC)起作用,类似于曲妥珠单抗。T-DM1的临床活性在EMILIA III期临床研究中得到了评估[5]。该研究显示,T-DM1在二线治疗中相较于卡培他滨联合拉帕替尼具有显著的优越性,T-DM1组的中位PFS为9.6个月,而对照组为6.4个月(P < 0.001);中位OS为30.9个月,而对照组为25.1个月(P < 0.001)。基于该研究结果,FDA在2013年批准T-DM1作为HER2阳性转移性乳腺癌的二线治疗药物。然而,在MARIANNE III期研究中,T-DM1单药或与帕妥珠单抗联合使用相比紫杉类药物联合曲妥珠单抗并未显示出优越性,因而未能成为一线治疗[6]。最近,T-DM1在KATHERINE III期研究中被定位为辅助治疗药物,用于接受过抗HER2新辅助治疗后仍残留病灶的患者。该研究结果显示,与单独使用曲妥珠单抗相比,T-DM1显著降低了50%的复发或死亡风险[7]。
德曲妥珠单抗(T-DXd)是第三代ADC,由曲妥珠单抗与强效拓扑异构酶I抑制剂通过可裂解的连接子构成,DAR为8,并具有旁观者效应。在DESTINY-Breast01 II期临床试验中,T-DXd在HER2阳性转移性乳腺癌患者中显示出显著的临床活性,客观缓解率(ORR)为61%,中位PFS为19.4个月[8]。T-DXd的一个显著优势在于其具有较短的系统半衰期,从而减少了系统毒性。此外,其独特的旁观者效应可使药物渗透至HER2表达异质的肿瘤区域,提高整体疗效。基于这些结果,T-DXd被美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)批准用于治疗已接受过两种或以上抗HER2治疗方案(包括T-DM1)HER2阳性转移性乳腺癌的治疗。
最近,DESTINY-Breast02研究确认了T-DXd相较于曲妥珠单抗或拉帕替尼联合卡培他滨在HER2阳性转移性乳腺癌患者中表现出显著的优越性,且没有出现新的安全性信号。T-DXd组的中位PFS为17.8个月,而对照组为6.9个月(P < 0.0001)[9]。在DESTINY-Breast03 III期研究中,T-DXd与T-DM1在经过紫杉类药物和曲妥珠单抗治疗的转移性乳腺癌患者中进行了直接比较,研究达到了其主要终点PFS[10]。
T-DXd的不良反应中,最常见的3级及以上治疗相关不良事件(TRAEs)为中性粒细胞减少症(19.1%)和血小板减少症(7%),ILD的发生率为10.5%,无死亡病例报告。基于这些结果,T-DXd被定位为HER2阳性转移性乳腺癌患者的标准二线治疗,T-DM1则退居后续治疗选项,关于其在后续治疗中的作用引发了广泛讨论。
此外,T-DXd还在HER2低表达转移性乳腺癌患者中进行了评估,这些患者至少接受过一次化疗失败。在DESTINY-Breast04 III期临床试验中,与医生选择的化疗方案相比,T-DXd在激素受体阳性患者群体中达到了其主要终点PFS[11]。T-DXd组的中位PFS为10.1个月,而对照组为5.4个月(P < 0.001)。中位OS为23.9个月,而对照组为17.5个月(P = 0.003)。研究未报告新的安全性问题。该试验促使FDA批准T-DXd用于治疗接受过至少一次化疗失败的HER2低表达转移性乳腺癌成人患者。
抗HER2 ADC的耐药机制
由于ADC的结构和作用机制的复杂性,耐药可以在多个阶段发生。抗原相关的耐药机制是抗HER2 ADC耐药的关键因素[12]。长期暴露于治疗可能导致HER2受体表达水平的降低或结构改变,从而影响ADC的疗效。例如,KRISTINE试验报告显示,HER2表达异质性的患者在接受T-DM1治疗时显示出较低的病理完全缓解率。此外,抗原细胞外结构域可能存在截短形式,这被认为是导致耐药的潜在机制之一。
有效载荷相关的耐药机制主要与药物转运蛋白的上调有关,这会导致ADC的细胞毒载荷被过度排出细胞。例如,研究表明,耐药细胞通常会表现出ABCC2和ABCG2转运蛋白的过表达,而这些转运蛋白的抑制可以部分恢复T-DM1的效力。此外,内在耐药机制还包括HER2内吞失败及溶酶体功能的受损,这会影响ADC的细胞毒性发挥。抑制SH3GL1基因可以降低HER2的内吞,进而导致T-DM1介导的细胞毒性下降[13]。
克服耐药性的策略
为应对ADC药物的耐药性问题,研究人员正在探索多种策略。这些策略包括开发新一代ADC、改变目标或有效载荷、调整DAR,以及与其他药物如酪氨酸激酶抑制剂(TKIs)、免疫检查点抑制剂(ICIs)和合成DNA损伤剂联合使用。新一代ADC如trastuzumab duocarmazine(SYD985)和SHR-A1811显示出在T-DM1耐药情况下恢复疗效的潜力。具体的联合治疗试验如表1所示,提供了多靶点、多机制的策略,旨在增强抗肿瘤效果。例如T-DM1与图卡替尼、阿替利珠单抗联用的研究显示出积极的结果。尽管T-DXd的临床活性显著,但耐药性的出现以及治疗后进展患者的标准化治疗仍然是挑战。未来的研究需要深入探讨ADC的作用机制、耐药机制和优化组合治疗策略,以提高治疗效果并延缓耐药性的产生。
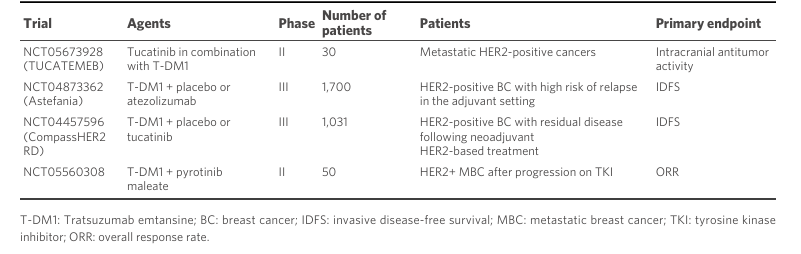
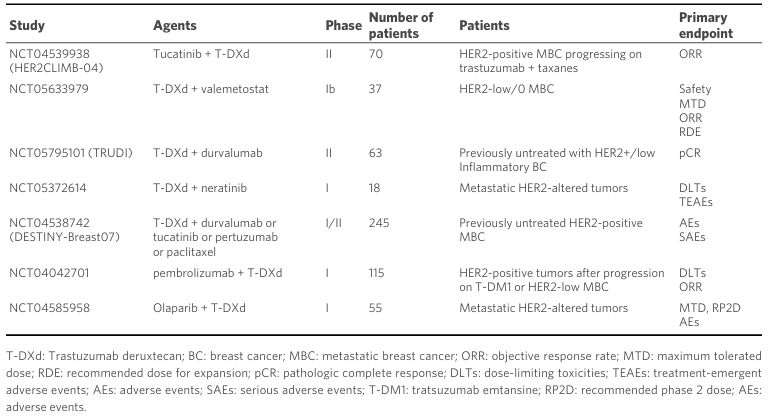 表1. 正在进行的ADC与其他治疗药物联合的临床试验
表1. 正在进行的ADC与其他治疗药物联合的临床试验
下一代ADC
随着研究的深入,新一代的ADC正不断被研发中,以解决当前ADC在临床应用中遇到的耐药性和毒性问题。这些新一代ADC通过优化抗体、连接子和细胞毒载荷,旨在提高药物的选择性、有效性和安全性。
1.Trastuzumab Duocarmazine(SYD985)
Trastuzumab duocarmazine(SYD985)是一种新型HER2靶向ADC,其使用了一种烷基化剂作为细胞毒载荷,通过C型连接子与抗体结合。SYD985在一项I期研究中展示出对HER2阳性和HER2低表达转移性乳腺癌患者的良好疗效。在TULIP III期试验中,SYD985在HER2阳性转移性乳腺癌患者中显示出较好的PFS,与医生选择的治疗方案相比,显著延长了患者的PFS[14]。这表明SYD985有潜力在T-DM1耐药的情况下恢复疗效,并且其安全性特征是可接受的。
2. SHR-A1811
SHR-A1811是一种新一代HER2靶向ADC,由曲妥珠单抗与一种新型拓扑异构酶I抑制剂通过稳定可裂解的连接子结合而成。在一项I期研究中,SHR-A1811在HER2阳性和HER2低表达转移性乳腺癌患者中表现出显著的抗肿瘤活性,特别是在先前接受过T-DM1治疗的患者中。该药物表现出较高的ORR,且不良反应在可控范围内[15]。
3. Disitamab Vedotin(RC48)
Disitamab vedotin(RC48)是一种人源化抗HER2 ADC,与单甲基奥瑞他汀E(MMAE)通过可裂解连接子偶联。RC48显示出旁观者效应,即其可以作用于HER2异质性表达的肿瘤细胞。在一项临床试验中,RC48在HER2阳性和HER2低表达的乳腺癌患者中显示出较高的ORR[16]。其安全性和耐受性也令人鼓舞,目前正在开展多项III期临床试验,以进一步验证其疗效。
4. ARX788
ARX788是一种新型ADC,结合了一种高效的细胞毒性药物amberstatin(AS269)。在临床前研究中,ARX788在HER2表达的乳腺癌和胃癌模型中表现出良好的抗肿瘤活性,包括在对T-DM1产生耐药的模型中。I期临床试验的初步结果显示,ARX788在先前治疗经验丰富的HER2阳性转移性乳腺癌患者中具有良好的疗效[17]。
5. Zanidatamab Zovodotin(ZW49)
Zanidatamab zovodotin(ZW49)是一种双特异性ADC,能够同时靶向两个非重叠的HER2抗原,并通过一种可裂解的连接子连接到auristatin类细胞毒药物。在I期剂量递增试验中,ZW49在HER2阳性实体瘤患者中显示出一定的疾病控制率(DCR),尽管在某些患者中观察到治疗相关的角膜炎[18]。
结论
总体而言,抗HER2 ADC在乳腺癌治疗中的应用不断扩展,未来的发展方向应着重于优化药物结构、理解耐药机制以及探索新的组合治疗方案,以提高治疗效果并延缓耐药性的产生。通过这些努力,抗HER2 ADC有望为乳腺癌患者提供更有效的治疗选择,改善患者的生存预后。
1. Saleh K, Khoury R, Khalife N, Chahine C, Ibrahim R, Tikriti Z, Le Cesne A. Mechanisms of action and resistance to anti-HER2 antibody-drug conjugates in breast cancer. Cancer Drug Resist 2024;7:22. https://dx.doi.org/10.20517/ cdr.2024.06
2. Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2022. CA Cancer J Clin 2022;72:7-33.
3. Criscitiello C, Morganti S, Curigliano G. Antibody-drug conjugates in solid tumors: a look into novel targets. J Hematol Oncol 2021;14:20.
4. Diamantis N, Banerji U. Antibody-drug conjugates - an emerging class of cancer treatment. Br J Cancer 2016;114:362-7
5. Verma S, Miles D, Gianni L, et al; EMILIA Study Group. Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med 2012;367:1783-91.
6. Perez EA, Barrios C, Eiermann W, et al. Trastuzumab emtansine with or without pertuzumab versus trastuzumab plus taxane for human epidermal growth factor receptor 2-positive, advanced breast cancer: primary results from the phase III MARIANNE study. J Clin Oncol 2017;35:141-8
7. von Minckwitz G, Huang CS, Mano MS, et al; KATHERINE Investigators. Trastuzumab emtansine for residual invasive HER2 positive breast cancer. N Engl J Med 2019;380:617-28
8. Modi S, Saura C, Yamashita T, et al; DESTINY-Breast01 Investigators. Trastuzumab deruxtecan in previously treated HER2-positive breast cancer. N Engl J Med 2020;382:610-21
9. André F, Hee Park Y, Kim SB, et al. Trastuzumab deruxtecan versus treatment of physician’s choice in patients with HER2-positive metastatic breast cancer (DESTINY-Breast02): a randomised, open-label, multicentre, phase 3 trial. Lancet 2023;401:1773-85
10. Cortés J, Kim SB, Chung WP, et al; DESTINY-Breast03 Trial Investigators. Trastuzumab deruxtecan versus trastuzumab emtansine for breast cancer. N Engl J Med 2022;386:1143-54.
11. Modi S, Jacot W, Yamashita T, et al; DESTINY-Breast04 Trial Investigators. Trastuzumab deruxtecan in previously treated HER2 low advanced breast cancer. N Engl J Med 2022;387:9-20.
12. Venetis K, Crimini E, Sajjadi E, et al. HER2 Low, Ultra-low, and novel complementary biomarkers: expanding the spectrum of HER2 positivity in breast cancer. Front Mol Biosci 2022;9:834651.
13. Baldassarre T, Truesdell P, Craig AW. Endophilin A2 promotes HER2 internalization and sensitivity to trastuzumab-based therapy in HER2-positive breast cancers. Breast Cancer Res 2017;19:110.
14. Aftimos P, Turner N, O'shaughnessy J, et al. 386MO Trastuzumab duocarmazine versus physician’s choice therapy in pre-treated HER2-positive metastatic breast cancer: Final results of the phase III TULIP trial. Ann Oncol 2023;34:S340-1.
15. Yao H, Yan M, Tong Z, et al. Abstract CT175: Safety, tolerability, pharmacokinetics, and antitumor activity of SHR-A1811 in HER2 expressing/mutated advanced solid tumors: a global phase 1, multi-center, first-in-human study. Cancer Res 2023;83:CT175.
16. Yao H, Yan M, Tong Z, et al. Abstract CT175: Safety, tolerability, pharmacokinetics, and antitumor activity of SHR-A1811 in HER2 expressing/mutated advanced solid tumors: a global phase 1, multi-center, first-in-human study. Cancer Res 2023;83:CT175.
17. Skidmore L, Sakamuri S, Knudsen NA, et al. ARX788, a site-specific anti-HER2 antibody-drug conjugate, demonstrates potent and selective activity in HER2-low and T-DM1-resistant breast and gastric cancers. Mol Cancer Ther 2020;19:1833-43
18. Jhaveri K, Han H, Dotan E, et al. 460MO Preliminary results from a phase I study using the bispecific, human epidermal growth factor 2 (HER2)-targeting antibody-drug conjugate (ADC) zanidatamab zovodotin (ZW49) in solid cancers. Ann Oncol 2022;33:S749-50.
审批编号:CN-143534 有效期至2025-11-15
排版编辑:肿瘤资讯-Julian











 苏公网安备32059002004080号
苏公网安备32059002004080号


