
背景
HER2阳性乳腺癌占全部乳腺恶性肿瘤的20%~25%,其中半数表达HR[2]。约45%的HER2阳性/HR阳性乳腺癌ER和PgR均阳性,也就是TPBC[3]。和HER2阳性/HR阴性乳腺癌相比,HER2阳性/HR阳性乳腺癌组织学分级更低,具有更高比例的浸润性小叶癌,更高比例的骨转移,更低比例的脑转移,总生存(OS)更优[4]。因此,TPBC可能具有独特的临床和分子特征。
HR和HER2通路的交互作用
HER对于ER信号通路具有双重影响,可通过抑制性调节因子如ER β促进ER释放,调节下游转录因子,还可直接影响ER浓度。因此HER2信号通路可能可克服内分泌治疗(ET)阻滞作用。ER也可直接或通过G蛋白相互作用间接活化HER2,影响下游HER2调节因子,并直接下调HER2表达(图1)。
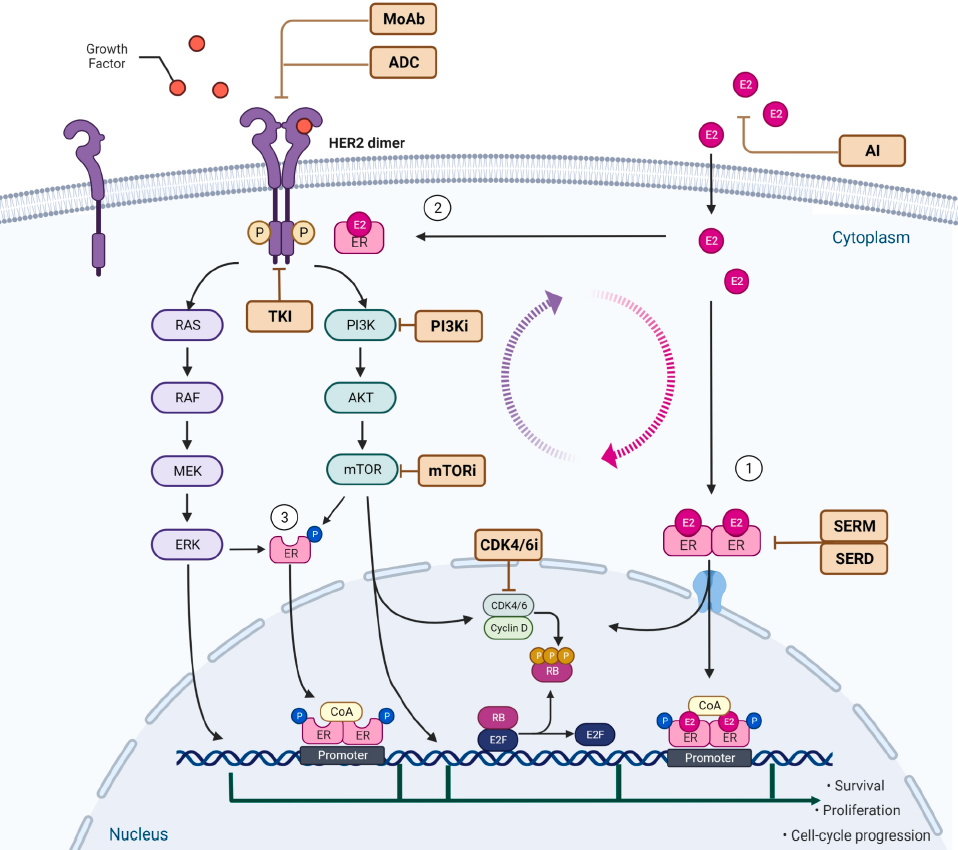 图1 ER和HER2信号通路交互作用
图1 ER和HER2信号通路交互作用
HER2阳性/ER阳性乳腺癌的固有亚型
既往HER2阳性乳腺癌分为腔面B(LumB)和HER2-E样。HER2-E肿瘤占50%~60%, HER2-E占到HER2阳性/HR阴性肿瘤的80%,占TPBC的30%[3]。而腔面型在TPBC中比例更高。HER2阳性乳腺癌中HR和PgR的相对表达具有预后意义,HER2阳性/ER阳性/PgR阴性和HER2阳性/ER阴性/PgR阳性肿瘤预后均劣于TPBC[4]。ER和PgR的相对表达还可以影响PAM50分布,TPBC中具有更低比例的HER2-E亚型[5]。
此外,HER2阳性肿瘤中,HR还提示独特的转录组、磷酸化蛋白质组学和基因表达特征。因此,HR表达可进一步定义HER2阳性乳腺癌的分子异质性,包括ERBB2成瘾性更低。
转移性TPBC的治疗
优化ET使用
目前HER2阳性肿瘤的一线治疗推荐是化疗联合双靶抗HER2治疗。多项临床研究显示单纯HR状态还不足以预测抗HER2治疗的疗效。而在诱导化疗后的一线维持治疗阶段,ET联合抗HER2治疗较单纯抗HER2治疗带来更好结局,因此对于HER2阳性/HR阳性乳腺癌,诱导化疗后常规推荐使用ET。
ET联合抗HER2双靶治疗具有更多证据。Ⅱ期PERTAIN研究中,帕妥珠单抗+曲妥珠单抗+芳香化酶抑制剂(AI)的中位无进展生存期(PFS)为26.6个月,中位OS为60.2个月[6]。但是研究进行OS和亚组分析效力不足。ALTERNATIVE研究中,拉帕替尼加入曲妥珠单抗和AI后也具有更佳的中位PFS(11.0 vs 5.6个月)[7]。
Ⅱ期SYSUCC-002研究显示曲妥珠单抗+ET疗效不劣于曲妥珠单抗+化疗[8]。但是研究纳入患者肿瘤侵袭性较低,且亚组分析显示具有更短无病间歇(<24个月)的患者未达到非劣效终点。因此一线无化疗方案还缺乏充分支持。Ⅲ期DETECT V研究中,一线至三线治疗HER2阳性患者随机接受曲妥珠单抗+帕妥珠单抗联合化疗或ET,之后使用双靶及ET维持。中期分析显示两组PFS和OS无显著差异[9]。
因此,ET联合抗HER2治疗可带来获益,特别是在维持治疗中。但是去化疗方案依旧存在争议,临床证据有限。
靶向PI3K/AKT/mTOR通路
PI3K/AKT/mTOR通路异常可导致抗HER2治疗耐药。Ⅲ期BOLERO-1和BOLERO-3研究显示mTOR抑制剂依维莫司的加入未带来PFS获益,但是联合探索性分析显示PI3K/AKT通路异常可预测依维莫司更佳的PFS[10]。EPIK-B2研究的第1部分中,诱导化疗后Alpelisib联合曲妥珠单抗和帕妥珠单抗治疗携带PIK3CA突变的患者客观反应率(ORR)为50%,临床获益率(CBR)100%[11]。
PIK3CA突变是ET耐药的生物标志物,而PIK3CA突变在LumA肿瘤中较LumB、HER2-E和基底样(BL)肿瘤中更为富集。考虑到TPBC中具有更高比例的LumA肿瘤,靶向PI3K/AKT通路可能在TPBC中具有更佳获益。然而在BOLERO-1研究中,HR阴性患者比HR阳性患者获益更多[10]。因此还需要更多生物标志物来优化靶向PI3K/AKT/mTOR通路药物的使用。正在开展的EPIK-B2和ALPHABET研究有望进一步发现预测生物标志物。
CDK4/6抑制剂
PATRICIA研究显示哌柏西利可为TPBC患者带来获益[12]。目前DETECT V和PATINA等一线治疗研究正在进行。
HER2阳性/HR阳性乳腺癌的基因组特征
关于多组学工具的探索正在进行。HER2DX结合了临床和分子因素,在HER2阳性乳腺癌中显示出早期预后和预测价值。PerELISA研究中,ERBB2 mRNA评分可预测病理完全缓解(pCR)率[13]。但是尚无晚期乳腺癌数据。
HR表达可影响基因表达特征,因此HR可提示不同PAM50亚型。PATRICIA和MonarchHER等研究中,腔面亚型肿瘤患者接受CDK4/6抑制剂具有更好获益。目前Ⅲ期HARMONIA研究正在进行,探索是否HER2-E可预测哌柏西利活性。
抗体偶联药物(ADC)
ADC显著改善了HER2阳性乳腺癌患者预后。T-DXd显示出优于T-DM1的疗效,且不同HR患者结果无差异[14]。因此对于HER2阳性/HR阳性患者来说,T-DXd应作为优选二线治疗。目前尚无ADC联合ET的治疗数据,有必要开展临床研究。
结论
TPBC显示出独特的生物学特征,ET有效,而化疗敏感性有限,预后较好。理解HER和HR的交互作用是TPBC特异性治疗的关键。靶向抗HER2药物耐药相关通路和ET的联合可能可进一步改善患者结局。基因组学和多组学工具有助于进一步明确HER2阳性肿瘤生物学,优化靶向药物和ADC的应用。还需要更多研究确定患者筛选和疗效预测生物标志物,以进行个体化治疗。
[1] Boscolo Bielo L, et al. The evolving landscape of metastatic HER2-positive, hormone receptor-positive Breast Cancer. Cancer Treat Rev. 2024:128:102761.
[2] Konecny G, et al. Quantitative association between HER-2/neu and steroid hormone receptors in hormone receptor-positive primary breast cancer. J Natl Cancer Inst. 2003;95(2):142-53.
[3] Pereira B, et al. The somatic mutation profiles of 2,433 breast cancers refine their genomic and transcriptomic landscapes. Nat Commun. 2016:7:11908.
[4] Han Y, et al. The impact of hormone receptor on the clinical outcomes of HER2-positive breast cancer: a population-based study. Int J Clin Oncol. 2022;27(4):707-716.
[5] Fernandez-Martinez A, et al.Survival, Pathologic Response, and Genomics in CALGB 40601 (Alliance), a Neoadjuvant Phase III Trial of Paclitaxel-Trastuzumab With or Without Lapatinib in HER2-Positive Breast Cancer. J Clin Oncol. 2020;38(35):4184-4193.
[6] Arpino G, et al. Pertuzumab, Trastuzumab, and an Aromatase Inhibitor for HER2-Positive and Hormone Receptor-Positive Metastatic or Locally Advanced Breast Cancer: PERTAIN Final Analysis. Clin Cancer Res. 2023;29(8):1468-1476.
[7] Johnston SRD, et al. Phase III, Randomized Study of Dual Human Epidermal Growth Factor Receptor 2 (HER2) Blockade With Lapatinib Plus Trastuzumab in Combination With an Aromatase Inhibitor in Postmenopausal Women With HER2-Positive, Hormone Receptor-Positive Metastatic Breast Cancer: Updated Results of ALTERNATIVE. J Clin Oncol. 2021;39(1):79-89.
[8] Hua X, et al. Trastuzumab Plus Endocrine Therapy or Chemotherapy as First-line Treatment for Patients with Hormone Receptor-Positive and HER2-Positive Metastatic Breast Cancer (SYSUCC-002). Clin Cancer Res. 2022;28(4):637-645.
[9] Janni W, et al. Omission of chemotherapy in the treatment of HER2-positive and hormone-receptor positive metastatic breast cancer – interim results from the randomized phase 3 DETECT V trial. 2023 SABCS PD18-07.
[10] André F, et al. Molecular Alterations and Everolimus Efficacy in Human Epidermal Growth Factor Receptor 2-Overexpressing Metastatic Breast Cancers: Combined Exploratory Biomarker Analysis From BOLERO-1 and BOLERO-3. J Clin Oncol. 2016;34(18):2115-24.
[11] Hurvitz SA, et al. Alpelisib in combination with trastuzumab and pertuzumab as maintenance therapy in patients with HER2+, PIK3CA -mutant advanced breast cancer: EPIK-B2 Study Part 1 safety and efficacy results. 2023 SABCS 4926.
[12] Ciruelos E, et al. Palbociclib and Trastuzumab in HER2-Positive Advanced Breast Cancer: Results from the Phase II SOLTI-1303 PATRICIA Trial. Clin Cancer Res. 2020;26(22):5820-5829.
[13] Guarneri V, et al. HER2DX genomic test in HER2-positive/hormone receptor-positive breast cancer treated with neoadjuvant trastuzumab and pertuzumab: A correlative analysis from the PerELISA trial. EBioMedicine. 2022:85:104320.
[14] Hurvitz SA, et al. Trastuzumab deruxtecan versus trastuzumab emtansine in patients with HER2-positive metastatic breast cancer: updated results from DESTINY-Breast03, a randomised, open-label, phase 3 trial. Lancet. 2023;401(10371):105-117.
审批编号:CN-142676 过期日期:2025-9-10
排版编辑:肿瘤资讯-Julian











 苏公网安备32059002004080号
苏公网安备32059002004080号


