
神经营养酪氨酸受体激酶(NTRK)基因融合是多种成人和儿童肿瘤的致癌驱动因素,在中国(或亚洲)癌症患者中,NTRK基因融合阳性率为 0.4%1,在某些罕见的儿童肿瘤如婴儿纤维肉瘤中发病率>90%2。拉罗替尼是一种first-in-class、高选择性的中枢神经系统活性的TRK抑制剂,基于在各种肿瘤类型患者中显示的稳健和持久的疗效,2022年在国内获批用于治疗患有NTRK基因融合的局晚期或转移性实体瘤成人和儿童患者。拉罗替尼的研究数据不断更新,为拉罗替尼的临床应用提供有价值的指导。本文解读拉罗替尼在2024CTOS大会的相关研究数据的更新,探讨拉罗替尼在TRK融合肉瘤治疗领域的价值及发展前景。
特邀专家
首都医科大学附属北京同仁医院儿科
中国抗癌协会小儿血液肿瘤分会委员
北京抗癌协会小儿血液肿瘤分会委员
中国研究型医院学会儿科肿瘤专委会常委
中国抗癌协会儿童肿瘤整合康复专委会常委
中华医学会儿科学分会精准医学委员会委员
北京医学会儿科分会委员
中国优生科学协会罕见病及精准医学组委员
北京医学会罕见病分会委员
中国生物医学工程学会靶向治疗技术分会
儿童肿瘤精准治疗专委会常委
世界华人医师儿科协会血液与肿瘤专家委员会委员
中国女医师协会儿科学分会委员
国际儿科杂志编委
中国医学前沿杂志编委
美国M.D. Anderson肿瘤中心病理科访问学者
国家卫生健康委儿童血液病、恶性肿瘤专家委员会青委
天津市抗癌协会儿童肿瘤专委会委员
天津医学会妇科肿瘤肿瘤学分会青委
中国抗癌协会肿瘤病理专委会、妇科肿瘤专委会会员
主持国家自然科学基金课题1项,天津市科委课题1项,天津医科大学课题1项并参与多项国家自然科学基金课题,以第一作者或通讯作者发表SCI收录论文十余篇
从事女性生殖系统肿瘤、泌尿系统肿瘤及儿童肿瘤病理诊断工作
研究速递:拉罗替尼一线治疗TRK融合肉瘤的疗效和安全性3
研究概述:
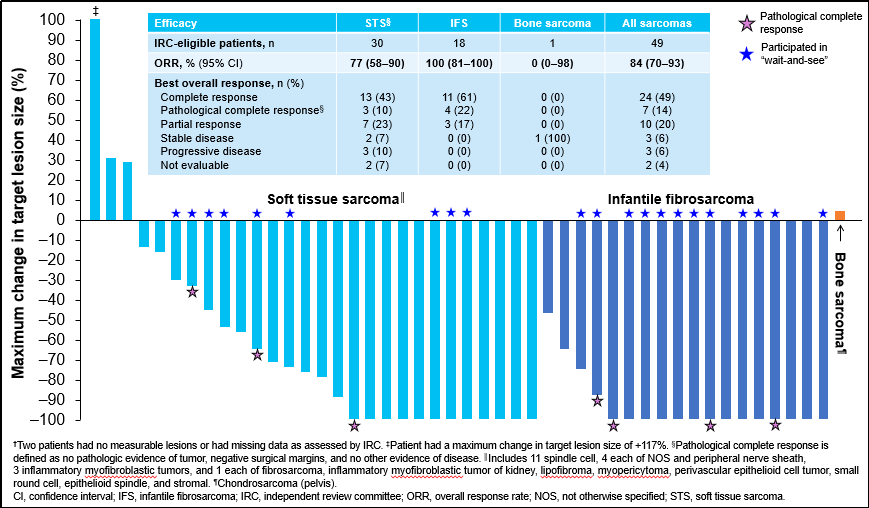
本研究纳入了3项临床试验(NCT02122913、NCT02576431[NAVIGATE]、NCT02637687[SCUT])中的TRK融合肉瘤患者,这些患者既往未接受过转移性或不可切除疾病的全身治疗。大部分成人患者接受拉罗替尼 100mg BID,大部分儿童患者接受拉罗替尼100 mg/m2 。主要终点为IRC根据RECIST v1.1标准评估的ORR。
截止2023年7月20日,共有49例TRK融合肉瘤患者在一线接受拉罗替尼治疗并符合IRC评估标准。
疗效结果:
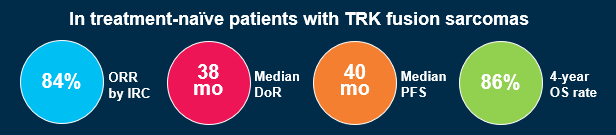
在所有IRC可评估患者中,ORR为84%,其中24 例(49%)为完全缓解(CR),7 例(14%)为病理完全缓解(pCR),10例 (20%)为部分缓解(PR)。在30例IRC可评估的STS患者和18例IRC可评估的IFS患者中,ORR分别为77%和100%。
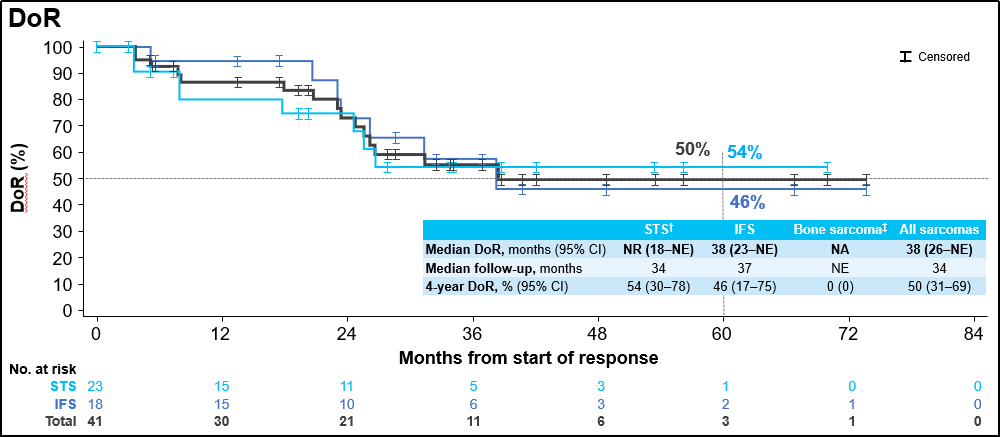
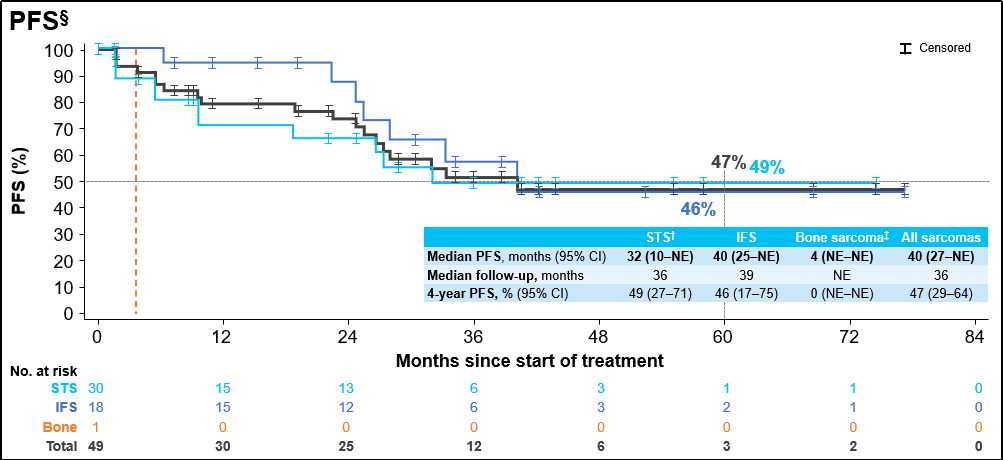
中位随访34个月后,中位缓解持续时间 (DoR)为38个月,4年DoR率为50%;中位随访36个月后,中位无进展生存期 (PFS)为40个月,4年PFS率为47%;中位随访52个月后,中位总生存期(OS)仍未达到,4年OS率为86%。
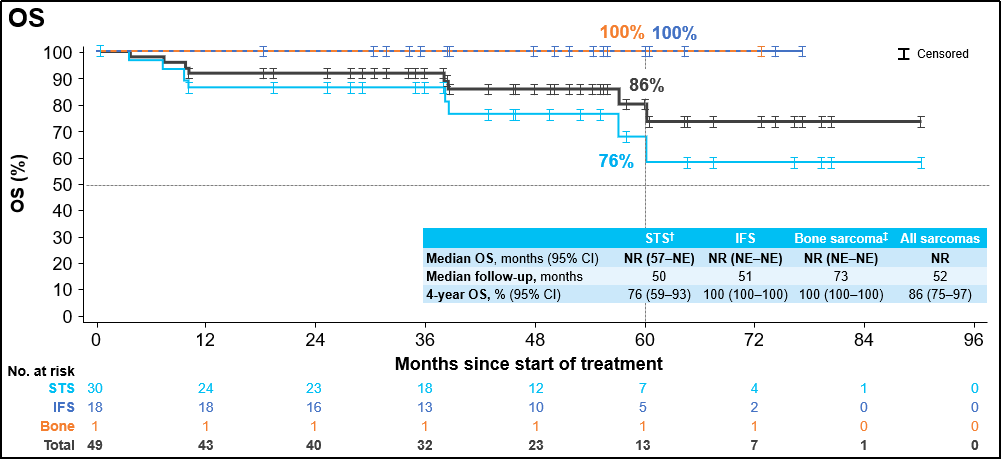
安全性结果:
治疗相关不良事件(TRAEs)以1/2级为主,16例(33%)患者发生3/4级TRAEs,其中最常见的是体重增加4例(8%)、中性粒细胞计数减少3例(6%)。1例(1%)患者因TRAE (低通气)而停药,没有患者因TRAE死亡。
研究速递:拉罗替尼在儿童TRK融合肉瘤患者中的疗效、安全性和停药结果的更新4
研究概述:
本研究报告了拉罗替尼在TRK融合肉瘤儿童患者中的最新疗效和安全性,以及在没有疾病进展的情况下允许选择性停止拉罗替尼治疗的一部分患者的结果。
截止2023年7月20日,共纳入91例儿童TRK融合肉瘤患者。
研究结果:
在91例IRC可评估患者中,ORR为87%,其中IFS患者的ORR为94%。所有患者的中位至缓解时间为1.8个月(范围0.9-7.3)。
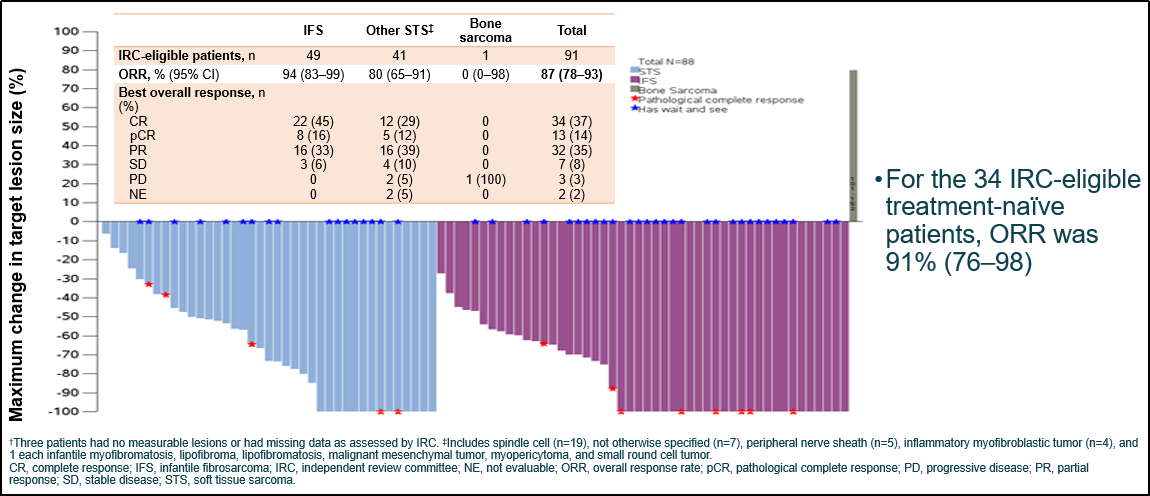
中位随访37个月后,mDoR为43个月,4年DoR率为47%;中位随访39个月后,mPFS为40个月,4年PFS率为45%;中位随访53个月后,mOS仍未达到,4年OS率为89%。
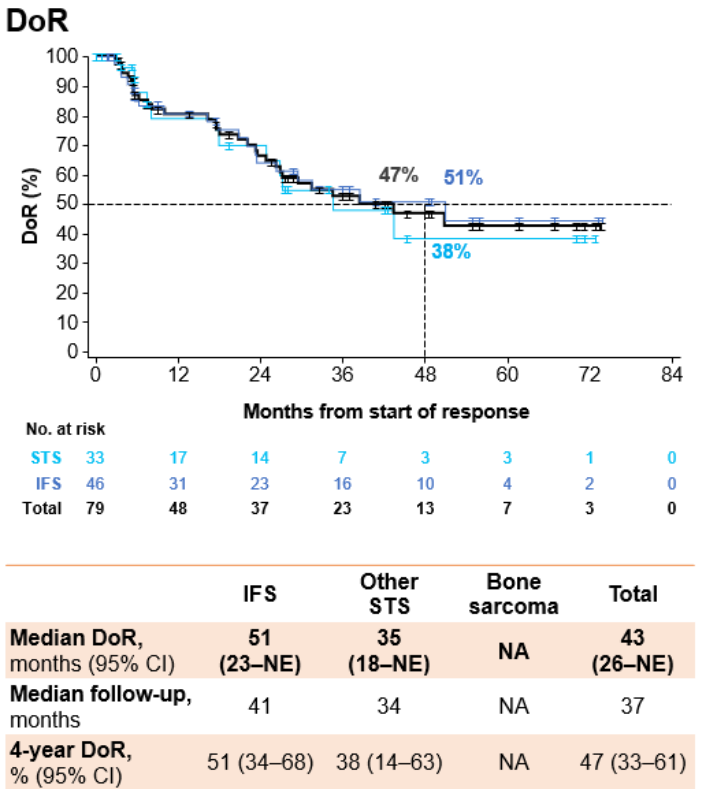
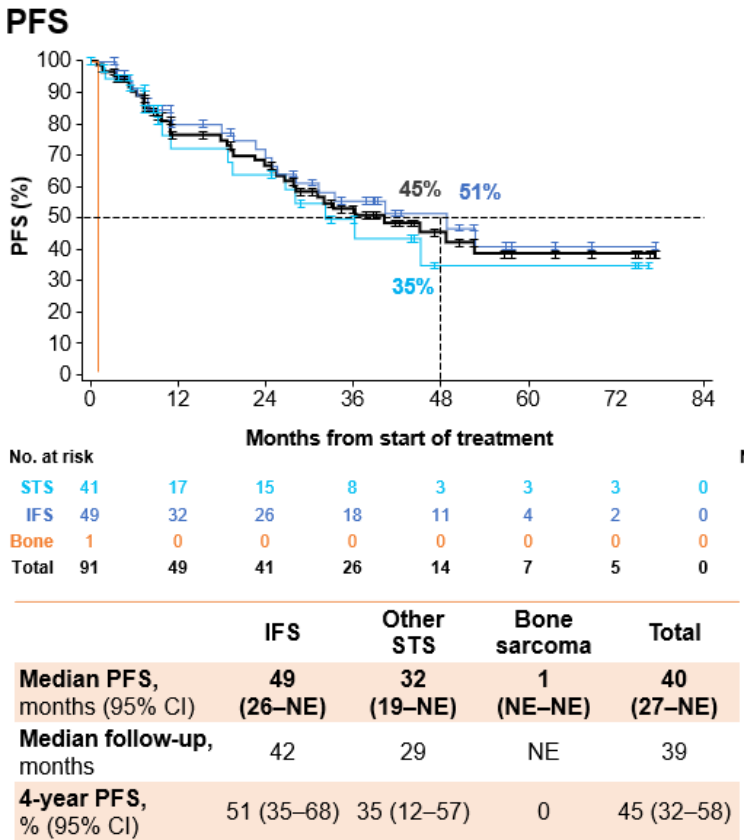
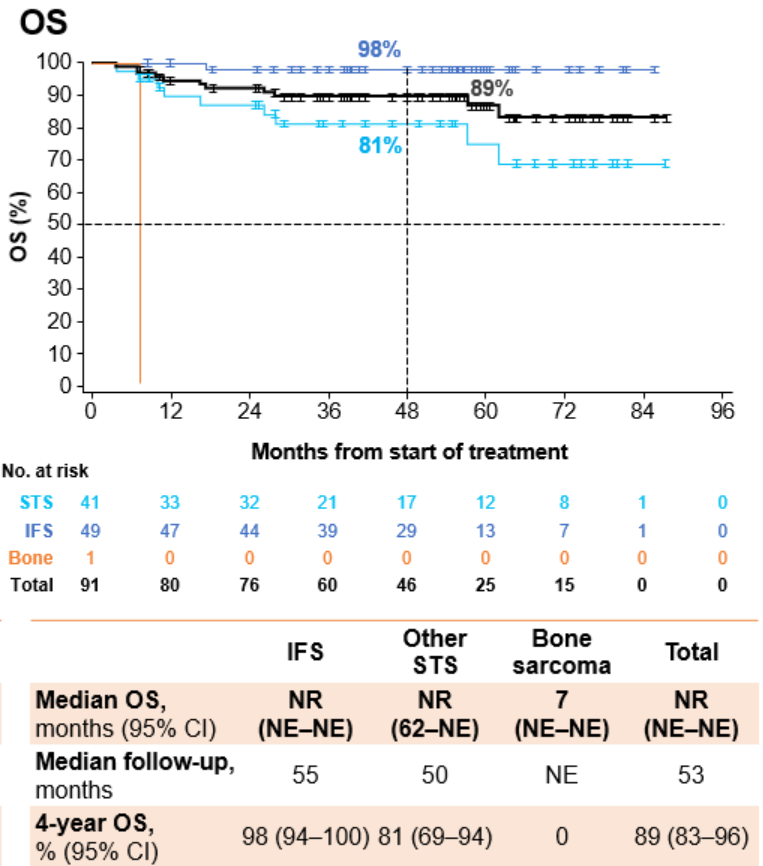
观望期分析:
在观望期分析中,47例患者在无治疗进展的情况下停止拉罗替尼,其中21例患者仍在进行观望,16例患者记录到后续进展。16例患者均恢复治疗,有5例CR,6例PR。在数据截止时,所有47例患者均存活。
安全性结果:
TRAEs主要为1/2级,32例(35%)患者发生3/4级TRAEs,其中最常见的是中性粒细胞计数减少为11例(12.1%)。3例患者因发生TRAEs停药,分别为情感麻木、右肺尖通气不足、中性粒细胞计数减少;没有患者因TRAE死亡。
研究速递:拉罗替尼治疗成人TRK融合肉瘤患者的长期随访疗效和安全性5

研究概述:
本研究纳入了3项临床试验(NCT02122913、NCT02576431[NAVIGATE]、NCT02637687[SCUT])中的TRK融合肉瘤成人患者(≥18岁),大部分患者接受拉罗替尼 100mg BID,主要终点为IRC根据RECIST v1.1标准评估的ORR。
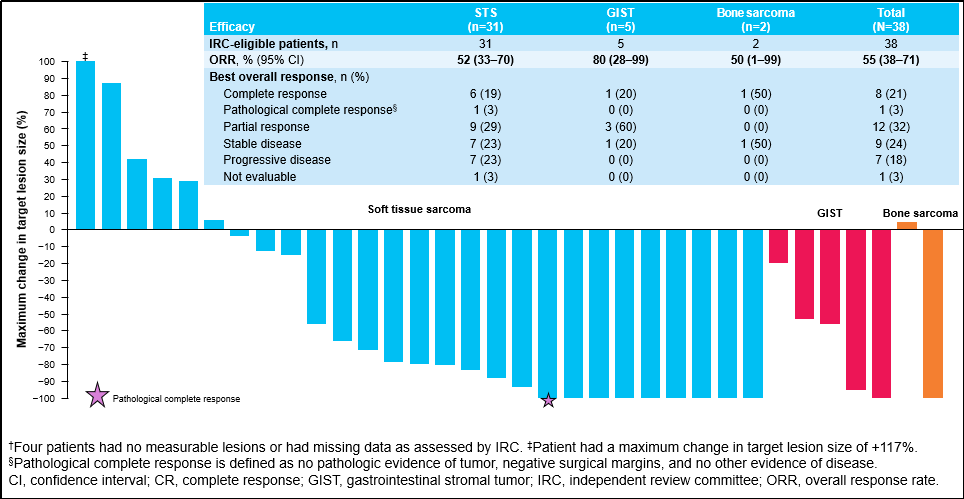
截止2023年7月20日,38例患者符合IRC疗效评价标准。其中31例(82%)患者为软组织肉瘤,5例(13%)为胃肠道间质瘤,2例(5%)为骨肉瘤。15例(39%)患者为初治,12例(32%)和11例(29%)患者分别接受过1线或≥2线全身治疗。
疗效结果:
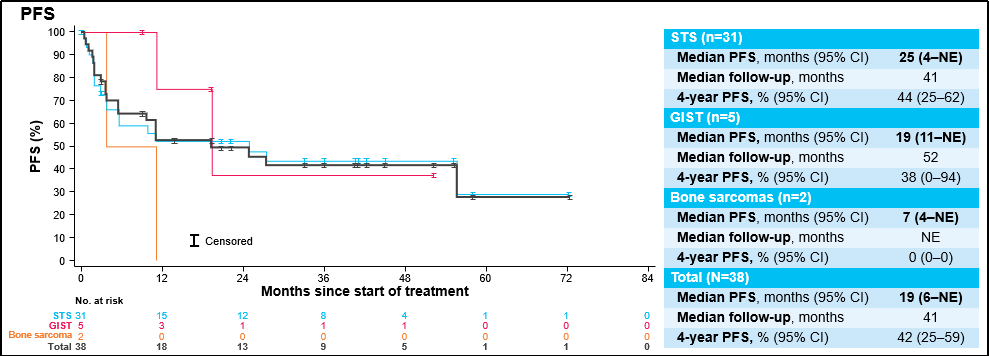
无论组织学如何,拉罗替尼都是有效的,所有患者的ORR为55%,其中GIST的ORR为80%。中位至缓解时间为1.8个月(范围1.0-22.9)。数据截止时,20例(53%)患者有进展,但由于持续的临床获益,其中13例患者在进展后继续治疗≥4周。
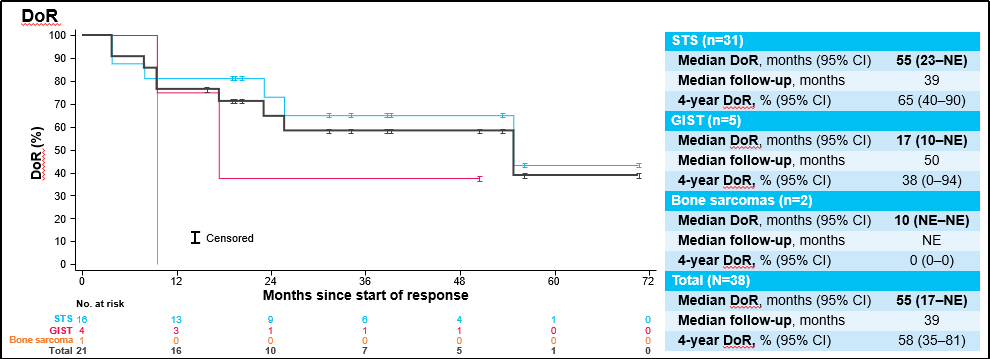
中位随访39个月时,所有患者的mDoR为55个月,4年DoR率为58%;中位随访41个月时,所有患者的mPFS为19个月,4年PFS率为42%;中位随访46个月时,所有患者的mOS为仍未达到,4年OS率为60% 。
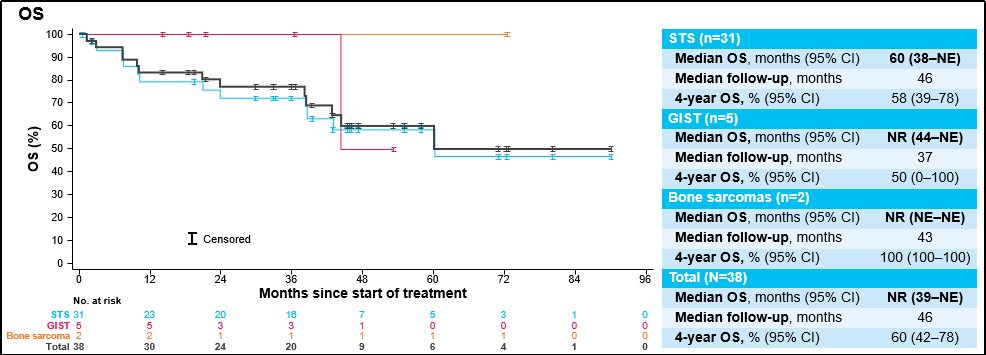
安全性结果:
TRAEs多为1/2级,仅1例为3级TRAE(体重增加)。有2例5级不良事件(均因疾病进展),均未考虑与拉罗替尼相关;没有患者因TRAEs停药;2例(5%)患者报告了与拉罗替尼相关的剂量调整。
总结
在2024CTOS大会上公布的拉罗替尼最新数据中,对于儿童或成人TRK融合肉瘤患者,拉罗替尼均展现快速且持久的缓解、延长的生存期和良好的安全性,同时,这些数据强调了检测NTRK基因融合对识别可能受益于拉罗替尼的肿瘤患者的重要性。相信随着更多关于拉罗替尼研究结果的公布,未来将进一步影响临床实践,不断续写NTRK基因融合肿瘤治疗新华章。
专家点评
张伟令教授:对于NTRK基因融合发生率相对更高的儿童患者,其本身的脆弱性带来更大治疗挑战。放疗和化疗是TRK抑制剂问世前的主要非手术治疗方法,但对于儿童来说其较大副作用对近期和远期健康均会产生深远影响。2018年,拉罗替尼作为全球首个不区分癌症种类,只针对特定基因突变的靶向药在美国获批上市,目前已在全球40多个国家/地区获批用于治疗儿童 NTRK 基因融合肿瘤7,为更多儿童肿瘤患者提供了新的治疗选择。今年CTOS大会的更新数据显示,既往治疗线数较多的情况下,拉罗替尼在儿童TRK融合肉瘤患者中仍表现出ORR的提高、DoR的延长以及PFS和OS的改善,更凸显了拉罗替尼在儿童肿瘤治疗中的重要地位。
本次国家医保目录更新,我们看到拉罗替尼成功纳入了2025年国家医保目录,填补了12岁以下儿童NTRK融合实体瘤患者临床治疗的空白,减轻患者家庭压力及社会负担,为儿童肿瘤患者保驾护航。
齐丽莎教授:NTRK基因融合是近年来肿瘤研究领域的热点之一,NTRK融合肿瘤不局限于某些组织类型,在身体的各个部位都可能发生。近年来,拉罗替尼在TRK融合肿瘤患者中的长期随访数据不断更新,证实拉罗替尼兼具疗效和安全性的显著优势,为该群体带来更多生存希望。建议所有晚期成人实体瘤和儿童实体瘤患者均进行NTRK融合基因检测,并且根据不同肿瘤的特性采取不同的检测策略。精准治疗,检测先行,全面及时的NTRK基因融合检测能够为患者带来最精准的治疗选择和更多的生存机会,因此强化NTRK基因融合的早期识别观念至关重要,以确保拉罗替尼的精准靶向治疗更早且更好地发挥作用。而拉罗替尼纳入医保可谓是一大福音,将有更多TRK融合肿瘤患者受惠于拉罗替尼所带来的更精准的临床治疗。
[1] 中国实体瘤NTRK融合基因临床诊疗专家共识.
[2] Forsythe A, et al. Ther Adv Med Oncol 2020;12:1–10.
[3] Albert CM, et al. Efficacy and Safety of Larotrectinib as First-line Treatment in Patients with TRK Fusion Sarcomas. 2024 CTOS
[4] Federman N, et al. Updated Efficacy, Safety, and Treatment Discontinuation Outcomes of Larotrectinib in Pediatric Patients with TRK Fusion Sarcomas. 2024 CTOS.
[5] Livingston JA, et al. Long-term Follow-up Efficacy and Safety of Larotrectinib in Adult Patients with TRK Fusion Sarcomas. 2024 CTOS.
[6] Kummar S, et al. Cancer. 2023 Sep 28.
[7] 拉罗替尼治疗TRK融合儿童肿瘤中国专家共识.
排版编辑:肿瘤资讯-jyy











 苏公网安备32059002004080号
苏公网安备32059002004080号


