乳腺包裹型乳头状癌 (encapsulated papillary carcinoma, EPC )被 WHO (2012)乳腺肿瘤分类正式纳入乳腺乳头状肿 瘤的组织学亚型 ,病理学界对这一独特病理实体的认 识已 显著提升。随着学术交流的深入、诊断实践的积累以及文献 资料的丰富, EPC 的病理特征、鉴别诊断及临床处理策略逐 渐清晰。然而,面对不断增长的病例数及病例复杂性的增 加,病理诊断仍面临新的挑战。本文结合最新文献研究与临 床实践经验,对乳腺 EPC 的病理诊断进行深入的再探讨,提 出更加明确并具有可操作性的诊断思路与处理方法。
曾祥菲,魏兵.乳腺包裹型乳头状癌的病理诊断[J].临床与实验病理学杂志,2024,40(09):901-906+916.DOI:10.13315/j.cnki.cjcep.2024.09.002.
相关诊断术语
在 WHO (2012)乳腺肿瘤分类正式引入乳腺 EPC 这一 诊断术语之前,同类的乳头状肿瘤在病理诊断中常遭遇分类 上的混淆,它们往往被笼统地归类为导管内乳头状癌 ( intra - ductal papillary carcinoma,IPC)或囊内乳头状癌(intracystic papillary carcinoma,ICPC)。使用乳腺EP C这一诊断术语 前,该类型乳头状肿瘤通常被诊断为 IPC 或 ICPC 。既往文 献亦将 ICPC 等同于 IPC ,然而仅37%的 IPC 位于囊性扩张 的导管或腔隙中,提示 ICPC 的诊断更适用于肉眼检查存在 囊腔的病例。自 2005年以来的研究证实既往诊断的多数乳 腺大导管起源的“ IPC / ICPC ”病例实为乳腺 EPC ,这一 发现促使了 EPC 作为更规范、更准确的诊断术语的广泛采 用,从而显著提升了该类肿瘤诊断的精确性。同时, 在 WHO (2019)乳腺肿瘤分类的修订中,将导管周缘保留肌上皮层 的 IPC 病例重新命名为乳头状型导管原位癌,以更精确地反 映其病理特征 。本文为了保持术语的连 贯性和历史背景 的理解,将继续保留“IPC”的诊断名称。
乳腺乳头状肿瘤病理诊断的基本思路
结合临床实践和相关文献,笔者总结出图 1中的诊断思路,将乳腺乳头状肿瘤根据结构特点分为Ⅰ型和Ⅱ型肿瘤。 Ⅰ型乳头状肿瘤具有易于识别的分枝状结构,乳头轴心表面被覆柱状细胞(图2)。Ⅰ型肿瘤的柱状细 胞与发生于乳腺 终末导管小叶单位的柱状细胞病变基本一致,可以出现不同 程度的层次增加和细胞非典型性。Ⅰ型肿瘤诊断的关键指 标是肌上皮的存留范围,肌上皮的免疫组化染色至关重要。Ⅱ型乳头状肿瘤的乳头表面被覆不同级别的导管上皮增生, 包括普通型增生、非典型增生和导管原位癌(ductal carcino-ma in situ,DCIS),增生细胞在乳头表面形成筛状、实性和微 乳头状结构(图3、4)。Ⅱ型肿瘤诊断的关键指标是增生导 管上皮的性质和分布范围,核心的免疫组化标记是 CK 5/6和 ER 。Ⅰ型和Ⅱ型结构可以混合存在或以某种结构为主。 该诊断流程适用于大/中导管发生的乳头状肿瘤,对起源于 小导管的周围型乳头状肿瘤仅做参考使用。乳腺 EPC 可呈 单纯的Ⅰ型或Ⅱ型结构,两种结构混合或以其中一种结构为 主者亦常见。
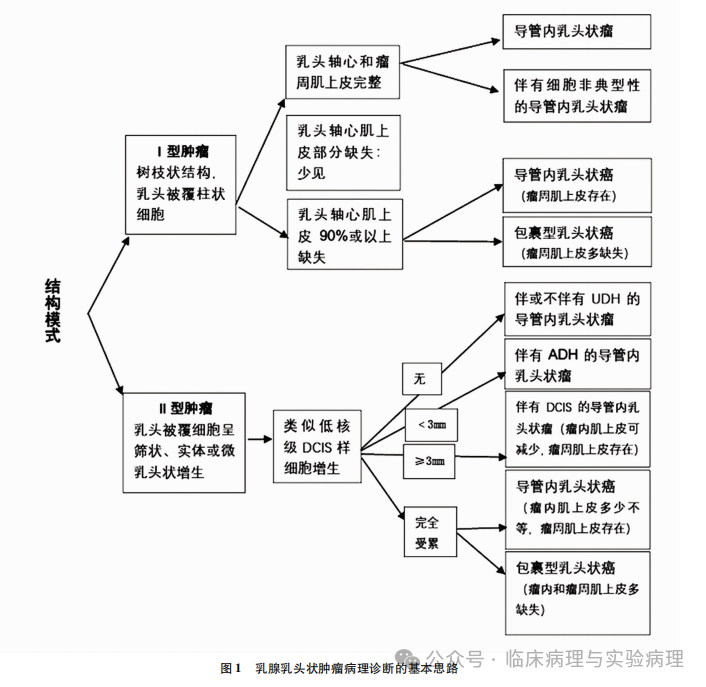
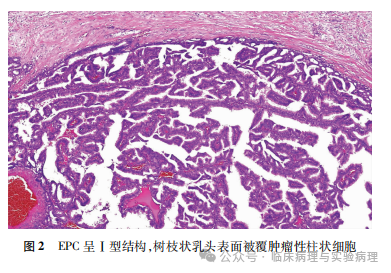
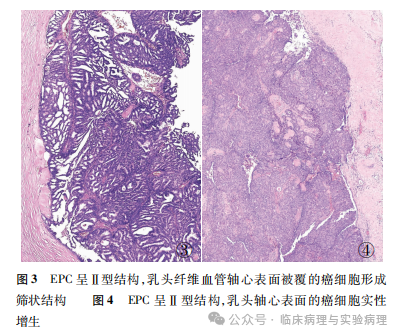
当发生于大/中导管的Ⅱ型乳头状癌呈实性结构或以实性结构为主时,需要避免将其误诊为原位实性乳头状癌。尽管两种乳头状癌均具有实性乳头状结构、均好发于老年女性,但“原位实性乳头状癌”特指具有特殊的形态学和免疫表型(包括细胞内外黏液分泌、嗜酸性颗粒状胞质、细胞可以呈梭形或浆细胞样外观、不同程度表达神经内分泌标记等)的多发性小导管乳头状癌。
乳腺EPC周缘的肌上皮状态
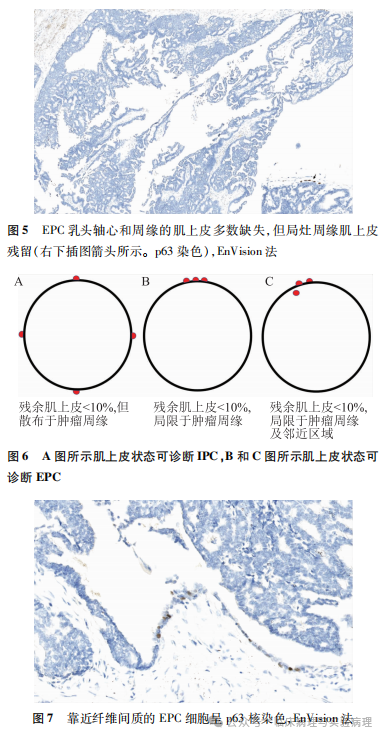
2006年Collins等发表在AJSP上的研究全面评估了乳腺ICPC瘤内和瘤周的肌上皮状态。该研究纳入的全部病例在肿瘤结节内外均缺乏肌上皮标记阳性染色的肌上皮层,根据WHO的诊断标准均属于乳腺EPC。然而,最先建议使用“EPC”诊断名称的Hill等研究中,EPC包含肿瘤周缘完全缺乏肌上皮的病例,同时也有个别肿瘤其周缘仍保留少量肌上皮。Mulligan等报道1例伴腋窝淋巴结转移的EPC,其周缘亦见局灶肌上皮存留。Wynveen等报道的病例甚至在局限的导管周缘和临近的乳头轴心同时保留肌上皮。WHO(2019)乳腺肿瘤分类中的描述是“EPC周缘的肌上皮通常缺失,但偶尔可以存在”。因此乳腺EPC的诊断并不需要肿瘤周缘肌上皮完全缺失(图5)。如果一张具有代表性的肿瘤HE切片通过肌上皮染色证实了EPC的诊断,进一步更换组织块再行肌上皮标记染色并非必须。另一方面,WHO乳腺肿瘤分类及前述研究并未明确“诊断EPC最低可以接受的残留肌上皮数量”。笔者的经验是:如果乳腺乳头状癌周缘超过90%区域肌上皮缺失且残留肌上皮局灶聚集分布而非散布于肿瘤周缘,此时可以考虑诊断EPC(图6)。需要特别注意的是EPC肿瘤细胞可以出现p63核染色,特别是靠近纤维间质的周边肿瘤细胞(图7),此时勿将其误判为p63阳性染色的固有肌上皮。
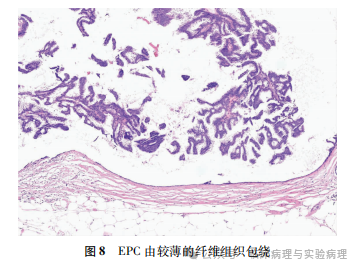
乳腺EPC的纤维包膜
根据EPC的命名,该肿瘤应该具有纤维包膜。位于囊腔中的EPC往往具有显著的纤维包膜,加深了病理医师将“厚纤维包膜”作为诊断条件的印象。然而,日常工作中常常遇到“缺乏厚纤维包膜的EPC”而导致命名争议。Patel等指出在部分EPC病例,纤维包膜仅仅是局灶可见,或者仅表现为很少的数层胶原纤维,甚至完全缺乏,因此“有界限的(cir-cumscribed)乳头状癌”更能客观地描述此组肿瘤。WHO(2019)乳腺肿瘤分类在EPC的定义中指出该肿瘤被纤维包膜包绕,包膜厚薄不一。基于实际操作性,笔者支持乳腺EPC的诊断无需肿瘤必须具有厚的纤维包膜(图8),但此时肿瘤应严格具备EPC其他的形态学特征。
Ghannam等使用天狼猩红染色和偏振光显微镜(可区分Ⅰ型和Ⅲ型胶原纤维)对乳腺EPC纤维包膜的胶原构成和几何分布特点进行研究,试图阐明纤维包膜是否为增厚的基膜物质(basement membrane,BM)。与对照组(正常乳腺组织、DCIS、伴基膜样物质的浸润性乳腺癌、包裹型甲状腺乳头状癌)相比,EPC纤维包膜中的胶原纤维类似于浸润性癌周的基膜样物质,与正常乳腺组织和原位癌周的BM显著不同。该研究提出乳腺EPC周围的纤维包膜并非固有BM沉积,而是纤维间质反应性改变,支持乳腺EPC是惰性浸润性癌。该研究从另一种角度说明,作为浸润性癌的反应性改变,EPC的纤维包膜可以厚薄不一。实际工作中甚至可以遇到缺乏间质促纤维反应的浸润性癌。
伴淋巴结转移EPC的分期
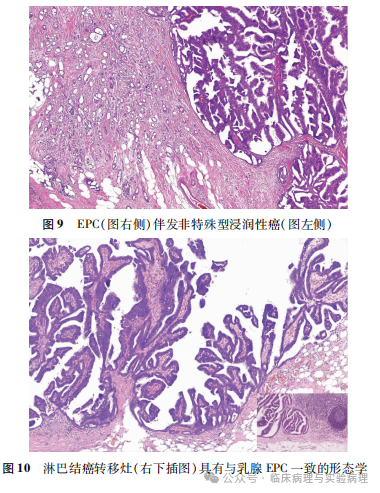
WHO(2012)和WHO(2019)乳腺肿瘤分类均将EPC分期为“pTis”,以避免过度治疗。2024年NCCN乳腺癌临床实践指南中EPC的处理与DCIS并列。WHO(2012)乳腺肿瘤分类对EPC生物学行为未予肯定说明,提出其可能是“一种最低限度的浸润性癌/低级别惰性浸润性癌”,或者是“原位癌与浸润性癌之间的过渡状态”。WHO(2019)乳腺肿瘤分类明确指出EPC是一种自限性惰性浸润性癌,预后类似于原位癌。当EPC同时伴有传统型浸润性癌时,肿瘤的组织学分级、分期和生物标志物(ER、PR和HER2)检测均仅仅针对传统型浸润性癌进行(图9)。WHO(2019)乳腺肿瘤分类发布后的相关研究进一步支持乳腺EPC预后良好。Jackson等研究显示伴或不伴有传统型浸润性癌的EPC预后均极佳,支持对EPC患者可以忽略腋窝分期手术。该研究中伴有的传统型浸润性癌均为pT1分期,多数是ER阳性/HER2阴性的低级别非特殊型浸润癌。
尽管临床可以相对保守地处理乳腺EPC(如充分的局部切除、不常规术后辅助化疗、前哨淋巴结活检替代腋窝淋巴结清扫等),但该肿瘤的转移潜能以及标本取材镜检的有限性仍需引起充分的重视。WHO(2019)乳腺肿瘤分类提到EPC伴有淋巴结转移罕见,但并未指出如何对此类肿瘤进行pT分期。随着病例积累,伴发有限/微小腋窝淋巴结转移的EPC逐渐增多,如何合理地病理分期值得关注。诸如“pTisN1”或“pTisN1mi”的分期可能难以被临床医师接受。笔者认为可以将淋巴结转移癌与EPC原发灶进行形态学对比,然后根据转移灶的形态学给予不同病例不同的pTN分期。如果淋巴结转移灶的形态学与EPC形态学一致(图10),建议将原发灶中EPC的体积用于确定pT分期(不再分为pTis)并针对EPC进行组织学分级和肿瘤标志物检测。如果淋巴结转移灶的形态学(缺乏乳头状结构)与EPC形态学不一致,则可将乳腺原发灶的分期判定为pTx,提示淋巴结转移灶可能来源于乳腺隐匿存在的其他浸润性癌成分。
聚集性多导管/多结节型EPC
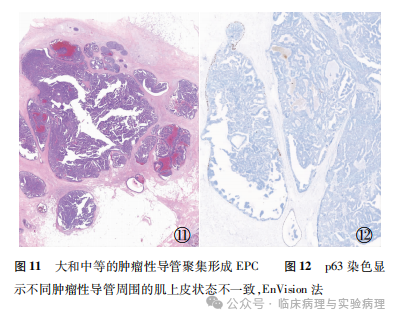
病理医师通常印象中,乳腺EPC位于扩张的单一导管或囊腔内。然而在实际工作中,肉眼观察呈单病灶的EPC肿瘤,镜下常表现为多个肿瘤性导管的聚集和融合,其中的导管可以是中等大小或大/中导管混合(图11)。最早使用EPC诊断名称的Hill等在其研究中展示的病例包含了聚集性多导管型EPC。WHO(2019)乳腺肿瘤分类指出EPC可以由多个肿瘤结节聚集形成。
多导管型EPC相关的诊断问题表现在两个方面。一方面是病灶中不同肿瘤性导管的肌上皮状态可能存在较大变异。如部分肿瘤性导管内外均缺乏肌上皮层而满足EPC的诊断标准,但另一些导管可能出现轴心肌上皮缺失而周缘肌上皮不同程度地保留(图12)。此时肿瘤整体的周缘肌上皮缺失可能达不到前文提到的90%标准,导致其诊断命名的争议(EPC vs IPC)。为了避免肿瘤潜在的转移风险,笔者的处理方式是将其诊断为“乳头状癌,包含EPC和IPC成分”。另一个衍生的诊断难点是中等大小的肿瘤性导管可能散在分布或数量偏少,肉眼观察不显示扩张的导管或囊腔。如果其肌上皮状态满足EPC诊断条件,可以接受将其诊断为EPC。如果乳头状肿瘤是轮廓规则的周围型小导管病变,当导管内外均缺失肌上皮时,将其归入“DCIS与膨胀性浸润性癌的鉴别诊断”进行考量更为合适。
EPC肿瘤内部伴发传统型浸润性癌
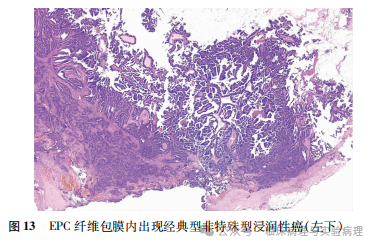
根据WHO(2019)乳腺肿瘤分类,诊断EPC基础上伴发的传统型浸润性癌必须是肿瘤成分突破纤维包膜、呈不规则浸润形态,组织学类型通常为非特殊型。其需要与陷入纤维包膜的EPC细胞和穿刺导致的肿瘤细胞移位鉴别。
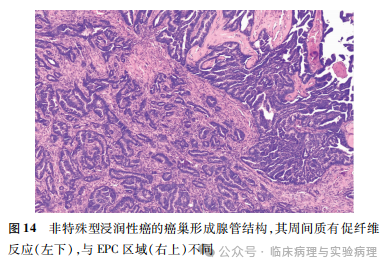
令人困惑的是,少量“EPC”病例的主体病变满足EPC诊断的各项标准,但在肿瘤纤维包膜内的局部区域出现经典型非特殊型浸润性癌的组织学改变(图13、14),肌上皮染色证实上述区域缺乏肌上皮层。此类肿瘤的“浸润癌”出现在肿瘤内部而不是肿瘤包膜以外,其是否应诊断为EPC伴有浸润性癌尚无文献供参考。Rakha等报道的一组高级别EPC病例中观察到类似现象,如经典的浸润性微乳头状癌或黏液癌成分出现在肿瘤内部而非包膜外。Rakha等将其视为高级别EPC伴有浸润性癌。另一个类似的情况是,早期诊断DCIS伴微浸润要求浸润灶侵出特化的乳腺小叶间质。Silver和Tavassoli则认为由于乳腺小叶内的特化间质中也含有脉管,因此微浸润的诊断不需要肿瘤细胞侵出特化的小叶间质。WHO(2012)乳腺肿瘤分类采纳了Silver等关于微浸润诊断的建议。因此,当EPC瘤内出现明确的传统型浸润性癌改变时,笔者支持将其诊断为“EPC伴有浸润性癌”,并将后一种成分用于该肿瘤的pT分期。
高级别/高核级EPC
Rakha等于2015年报道了一组高级别乳腺EPC,其特点是肿瘤细胞具有核多形性和活跃的核分裂、激素受体阴性、肿瘤体积更大、更容易伴有间质浸润。该研究10例随访病例中有1例单纯型高级别EPC患者死于肿瘤复发。基于其组织学特点和临床生物学行为,该研究建议高级别EPC的处理方式应参照传统型浸润性癌进行。Liu等研究进一步显示高级别EPC较低/中级别EPC更容易出现实性结构、三阴型或基底样免疫表型、更高的Ki67指数且好发于年轻女性,提示其侵袭性的生物学潜能。WHO(2019)乳腺肿瘤分类引用了上述研究,提出高级别EPC、三阴型或HER2阳性型EPC应该按照浸润性乳腺癌进行分级、分期和临床治疗。Tariq等的系列病例中尚包含1例激素受体强阳性的乳腺高级别EPC。
Patel等对WHO(2019)乳腺肿瘤分类的观点提出质疑,认为在组织学缺乏明确间质浸润的情况下将高级别EPC定义为浸润性癌缺乏说服力;病理医师对肿瘤核级别判定的主观性可能导致中等核级肿瘤被误判为高核级而出现过度诊断和治疗。需要注意的是前述三组研究纳入的高级别EPC病例数均较少(分别为12例、5例和6例)、随访时间较短(平均或中位随访时间分别为28个月、28个月和21个月),随访期内仅1例患者出现复发死亡。因此进一步积累病例和长期随访有助于阐明高级别EPC是否真正具有侵袭性的生物学行为。
日常工作中,为了避免临床医师将高级别EPC与经典型低/中级别EPC(pTis分期)混淆,前者的诊断名称可以使用“高级别EPC(浸润性癌)”。描述性诊断如“高核级乳头状癌,具有EPC结构,呈膨胀性浸润”可能更为客观。
乳腺高级别EPC的组织学结构可以是Ⅰ型或Ⅱ型(图15、16)。少量高级别非特殊型浸润性癌呈结节状生长,其周间质的促纤维反应可以形成厚薄不一的纤维包裹(类似于EPC的纤维包膜)。此种情况下,鉴别肿瘤是结节状增生的浸润性癌还是Ⅱ型高级别EPC较为困难,主要原因是很难区分肿瘤内的纤维间质是Ⅱ型乳头状结构的纤维血管轴心还是浸润性癌巢的纤维分隔(图17)。鉴于高级别EPC被WHO乳腺肿瘤分类定义为浸润性乳腺癌,上述情况难以明确时,可以选择直接诊断非特殊型浸润性癌。

大汗腺型EPC的诊断
2009年Seal等报道了5例乳腺单纯性大汗腺型EPC。该组肿瘤乳头轴心表面被覆的大汗腺细胞从单层到形成假乳头和/或筛状结构的复层上皮,显示不同程度的细胞异型性,肿瘤内外均缺乏肌上皮层,无一例出现区域淋巴结转移和复发。2011年Tramm等报道了一组肌上皮减少甚至完全缺失的良性或非浸润性大汗腺病变,其中包括1例肌上皮完全缺失但缺乏细胞异型性的大汗腺型导管内乳头状瘤。紧随其后的病例报道提供了2例内外均缺乏肌上皮层的大汗腺型乳头状病变,最终诊断考虑或倾向为良性大汗腺型乳头状瘤。作者均强调单纯的肌上皮缺失不足以诊断大汗腺型EPC。
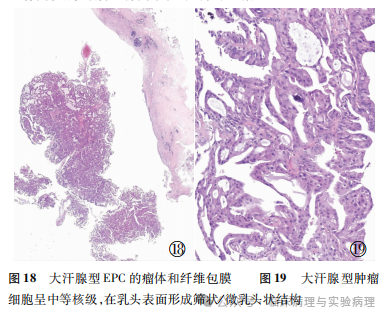
导管内大汗腺型上皮增生的良恶性质判定是乳腺病理诊断的难点,目前尚缺乏国际公认的诊断标准。尽管部分学者提出了相关的诊断建议,但涉及的形态学指标存在主观性,病理医师间的诊断重复性欠佳。不仅如此,当大汗腺细胞增生发生于复杂的背景病变(如腺病、乳头状瘤和复杂硬化性病变等)基础上时,如何准确区分非典型大汗腺增生和低级别大汗腺型DCIS更为困难。肌上皮的存留状态是评估乳腺导管内乳头状肿瘤性质的关键指标,但良性大汗腺型乳头状瘤可以完全缺乏肌上皮层。此外,诊断经典型乳腺EPC要求肿瘤细胞的核级为低或中等,高核级EPC应视为浸润性癌。这一诊断原则同样适合于乳腺大汗腺型EPC的诊断。以上因素使得乳腺低/中核级大汗腺型EPC的诊断需要格外慎重。此时综合考量乳头表面大汗腺增生的细胞异型性和结构异型性非常重要。鉴于增生大汗腺细胞常常存在某种程度的“细胞异型性”,结构异型性在低/中核级大汗腺型EPC的诊断中更为关键,要求增生细胞在乳头表面形成复杂的筛状/微乳头状结构(甚至实性结构)(图18、19)。乳头状肿瘤主体周围的乳腺组织中查见经典型大汗腺型DCIS可以作为支持肿瘤主体为乳头状癌的证据。
回顾前述Seal等报道的5例大汗腺型EPC,其中关于细胞异型性的描述是“肿瘤显示不同程度的细胞异型性,3例肿瘤仅为轻度核多形性,1例肿瘤显示核增大伴突出的核仁。4例肿瘤可见核分裂但未找见病理性核分裂。4例肿瘤可见灶性单个细胞坏死”。然而该文图3和图4中肿瘤的细胞异型性不易识别,图3中乳头表面仅被覆单层细胞,因此图示肿瘤尚难以排除为缺乏肌上皮的导管内乳头状瘤。
鉴别诊断
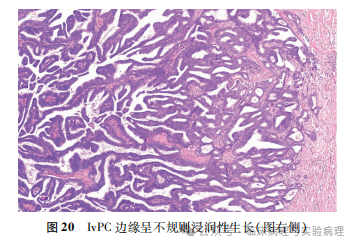
WHO(2019)乳腺肿瘤分类将浸润性乳头状癌(invasive papillary carcinoma,IvPC)定义为肿瘤细胞被覆纤维血管轴心而形成的浸润性癌。该分类指出乳腺IvPC相当少见,多数病例实际上是乳腺EPC、实性乳头状癌或转移性乳头状癌。WHO(2019)指出IvPC的组织学显示“frankly invasive growth pattern”,笔者认为可以将其理解为IvPC的生长方式是破坏性浸润,不同于EPC的膨胀性浸润。如果仅仅观察肿瘤的内部结构,IvPC与EPC很难区分。破坏性浸润与膨胀性浸润最显著的鉴别点在于对肿瘤边缘的观察。IvPC位于边缘的肿瘤细胞团巢参差不齐地侵入周围间质(图20),而EPC周缘相对规则平滑,可见上皮被覆或上皮脱落的导管壁/囊壁结构,或表现为肿瘤细胞膨胀性推挤周围的纤维间质。乳腺单纯的IvPC少见,但其常常可以作为混合型浸润性乳腺癌的构成成分出现。此外,乳腺IvPC几乎总是表现为Ⅰ型结构,因为Ⅱ型IvPC很难从非特殊型浸润癌中区分出来。
当乳腺组织出现破坏性浸润的乳头状癌时,询问病史并加做组织来源标记以确认其是否为转移性癌至关重要。尤其应警惕与源自女性生殖系统的浆液性癌、乳头状肺腺癌以及甲状腺乳头状癌进行鉴别诊断。此外,由乳腺IPC或EPC发展而来的浸润性癌通常失去真性乳头结构,以非特殊型浸润癌居多,此时应避免使用IvPC的诊断名称。
结语
作为老年女性常见的乳腺乳头状癌亚型,EPC仍然存在未被深入认识的形态学和免疫表型特征,某些病理诊断标准尚存争议,值得进一步积累病例以及长期随访加以阐明。
本文仅供专业人士参看,文中内容仅代表临床病理与实验病理公众号立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。版权归文章作者所有,作者拥有所有法定权利。











 苏公网安备32059002004080号
苏公网安备32059002004080号


