由福建省抗癌协会癌痛专业委员会和福建省抗癌协会中西医整合肿瘤专委会青年委员会主办的【十邑论坛】开播啦!论坛于每周四推出,带您用中文听原汁原味的欧洲肿瘤内科学(ESMO)研究。本期十邑论坛带来了捷克马斯克纪念癌症研究所的Radka Lordick Obermannová博士在2024年ESMO大会上关于胃癌治疗的精彩讲解。【肿瘤资讯】特邀泉州市第一医院洪燕妮教授进行相关研究解读。
福建省抗癌协会癌痛专委会委员
福建省抗癌协会肿瘤心脏病学专业委员会委员
福建省抗癌协会中西医整合肿瘤专业委员会青年委员会委员
福建省抗癌协会肿瘤营养与支持治疗专业委员会青年委员会委员
泉州市抗癌协会免疫治疗专业委员会委员
胃癌是全球范围内发病率和死亡率均较高的恶性肿瘤,其治疗一直是临床研究的热点。近年来,随着靶向治疗和免疫治疗的快速发展,胃癌的治疗取得了显著进步。然而,仍有许多问题亟待解决,例如如何优化围手术期治疗方案、如何提高免疫治疗的疗效等。
2024年欧洲肿瘤内科学会(ESMO)年会上,多位学者分享了关于胃癌治疗的最新研究进展,其中SPACE-FLOT研究和SHR1701研究两项重要研究引起了广泛关注。SPACE-FLOT研究评估了病理反应对指导胃食管癌患者术后辅助化疗的作用,而SHR1701研究则探索了一种新型双功能抗体联合化疗一线治疗HER2阴性胃癌的疗效和安全性。
SPACE-FLOT研究:病理反应指导辅助化疗
SPACE-FLOT研究是一项国际多中心、真实世界队列研究,旨在评估病理反应对指导胃食管癌患者术后辅助化疗的价值。该研究纳入了来自12个国家43家医院的近1900名患者,根据患者的病理缓解情况分为最小缓解组、部分缓解组和完全缓解组。研究的主要终点为无病生存期(DFS),次要终点为总生存期(OS)(图1)。
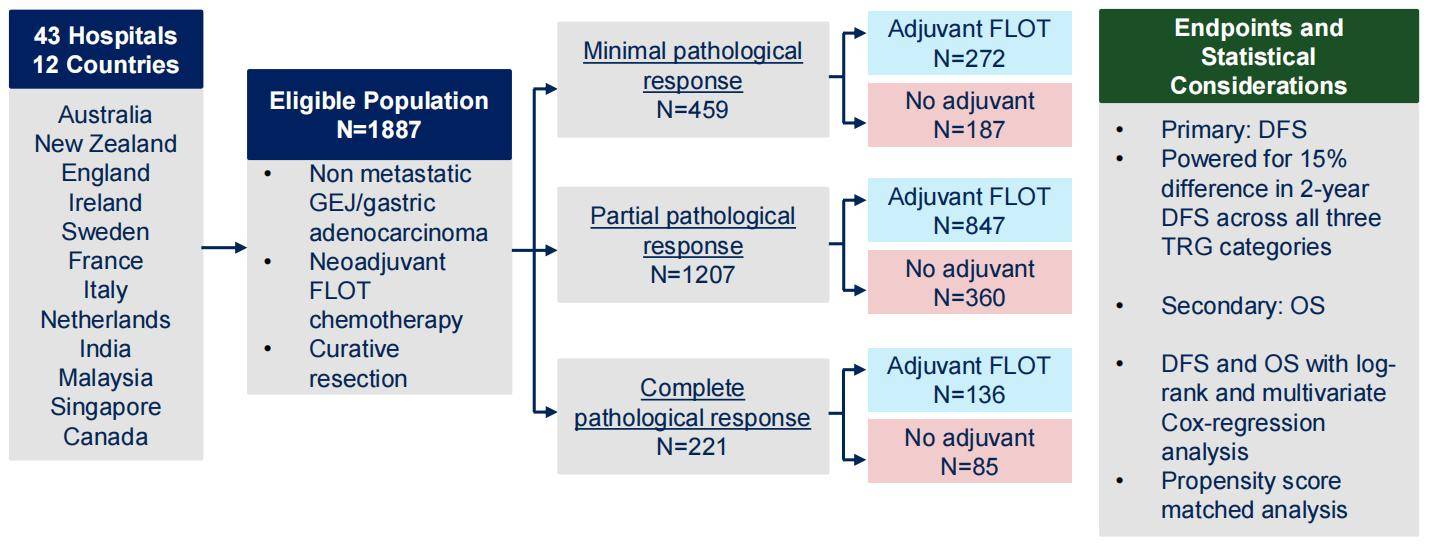
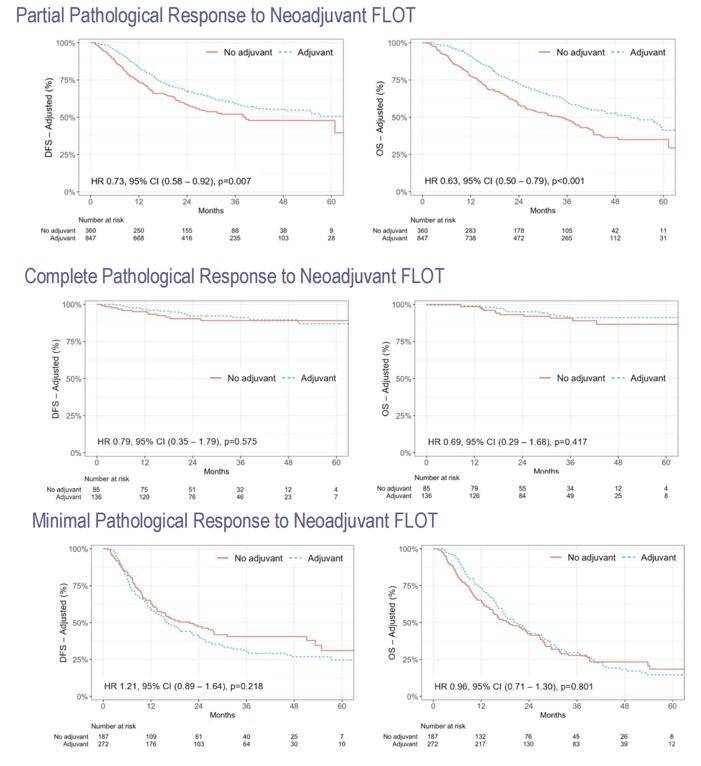
研究结果显示,只有部分病理缓解组的患者才能从术后FLOT辅助化疗中获益,其DFS和OS均显著改善,DFS的风险比(HR)为0.73(p = 0.007),OS的HR为0.63(p < 0.001)。而对于完全病理缓解和最小病理缓解的患者,FLOT辅助化疗并未显示出明显的获益(p > 0.05)(图2)。这一结果提示,在临床实践中,我们可以考虑根据患者的病理反应制定个体化的辅助化疗方案。对于完全病理缓解的患者,可以考虑省略辅助化疗;对于部分病理缓解的患者,则建议进行辅助化疗;而对于最小病理缓解的患者,也可以考虑省略化疗。
当前,2024年ESMO指南推荐对局部晚期胃食管癌或胃癌患者采用围手术期FLOT方案化疗,即术前4个周期和术后4个周期的FLOT方案。这一推荐主要基于2019年的FLOT-4研究结果,该研究证实了FLOT方案新辅助化疗可以带来OS获益,确立了FLOT方案在围手术期治疗中的地位。最近,美国放射肿瘤学会公布的ESOPEC研究数据也进一步支持了这一观点。ESOPEC研究比较了可切除的局部晚期食管癌或胃食管结合部腺癌患者分别接受围手术期FLOT化疗(FLOT组)和新辅助放化疗(CROSS组)的治疗效果。结果显示,围手术期化疗组的OS明显优于新辅助放化疗组,中位OS分别为66个月和37个月,3年OS率分别为57.4%和50.7%,5年OS率分别为50.6%和38.7%(图3)。
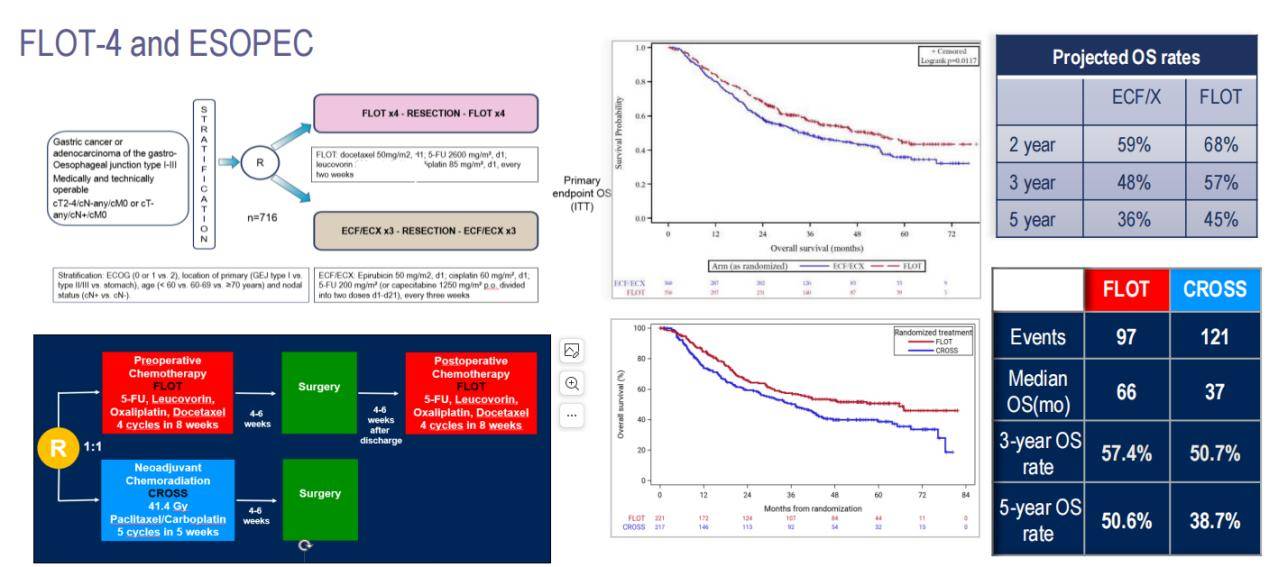
FLOT-4和ESOPEC研究结果显示,即使接受了新辅助化疗和手术治疗,仍有相当一部分患者存在淋巴结阳性或显微镜下切缘阳性,这些患者术后复发风险较高,在FLOT-4研究中这类高风险患者的比例高达67%。
EORTC 1707 VESTIGE研究针对这类高复发风险患者,评估了术后免疫治疗与辅助化疗的疗效差异。研究结果显示,免疫治疗并未给这些患者带来额外的生存获益,接受新辅助FLOT方案治疗且预后不良(ypN+或R1切除)的患者仍然会受益于辅助FLOT方案化疗(图4)。
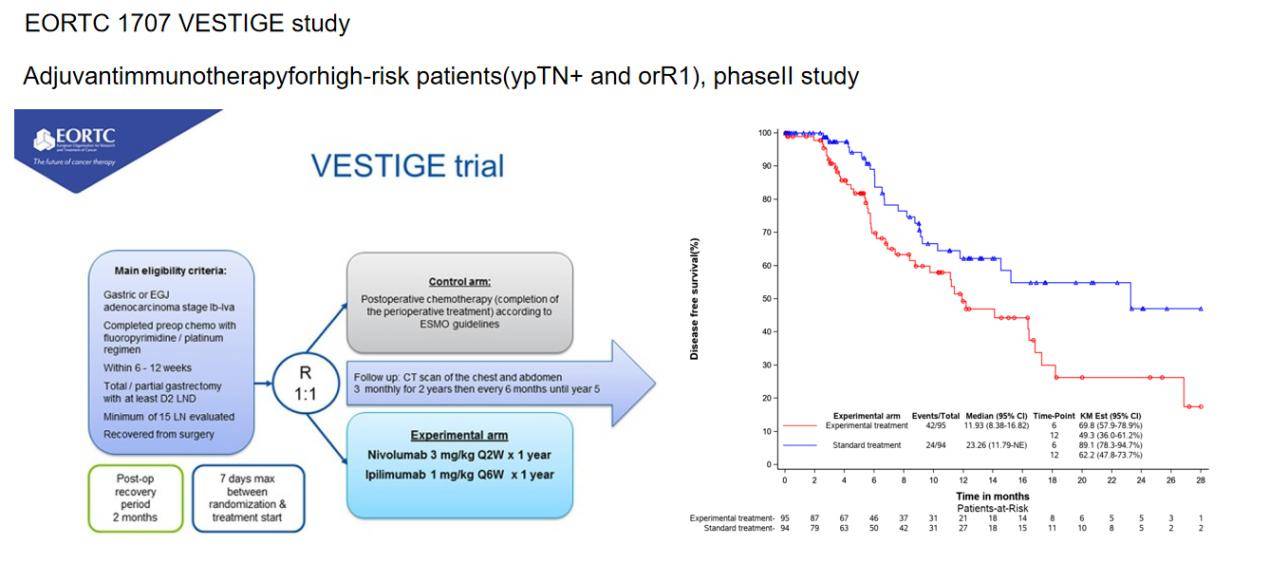
总之,SPACE-FLOT研究虽然是一项基于真实世界证据的回顾性研究,但也提供了一些有价值的信息。研究结果提示,病理反应或许可以用于指导胃食管癌患者的辅助化疗决策。然而,该研究也存在一些局限性,例如基线特征的不平衡、缺乏标准化的治疗评估以及肿瘤退缩分级评估本身存在的问题等。在临床实践中,需要结合患者的具体情况、病理反应以及其他预后因素,制定个体化的治疗方案。对于病理完全缓解的患者,是否可以省略术后辅助化疗仍需进一步研究;对于病理部分缓解的患者,强烈建议术后采用FLOT方案辅助治疗;而对于病理微小缓解的患者,基于EORTC 1707 VESTIGE研究结果,术后给予FLOT方案化疗仍然是最佳选择。
SHR 1701研究:双功能抗体一线治疗HER2阴性胃癌
LBA 60的研究是一项随机、三期临床试验,旨在评估SHR 1701联合化疗对比安慰剂联合化疗一线治疗HER2阴性胃癌或胃食管结合部腺癌的疗效和安全性。
目前,HER2阴性胃癌的标准治疗方案是PD-1抑制剂联合化疗,但只有约20%的患者能够获得长期缓解。转化生长因子β(TGF-β)信号通路与肿瘤微环境和抗PD-1治疗耐药密切相关。临床前研究表明,阻断TGF-β信号通路可以降低免疫抑制,调节T细胞数量,并恢复对PD-1抑制剂的敏感性。
SHR1701是一种双功能融合蛋白,可以同时靶向PD-L1和TGF-β受体II,旨在克服抗PD-1治疗的耐药性。前期I期研究结果显示,SHR1701在胃癌患者中展现出良好的疗效,客观缓解率(ORR)达到20%(RECIST v1.1)和25.7%(iRECIST)(图5)。
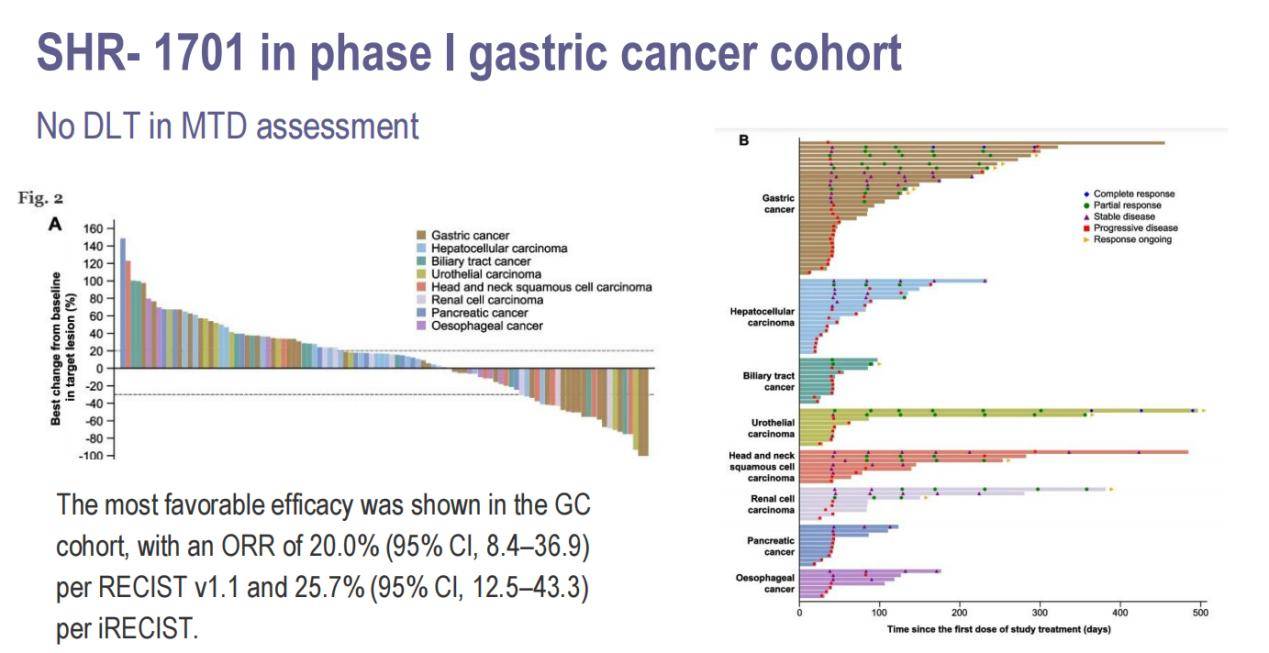
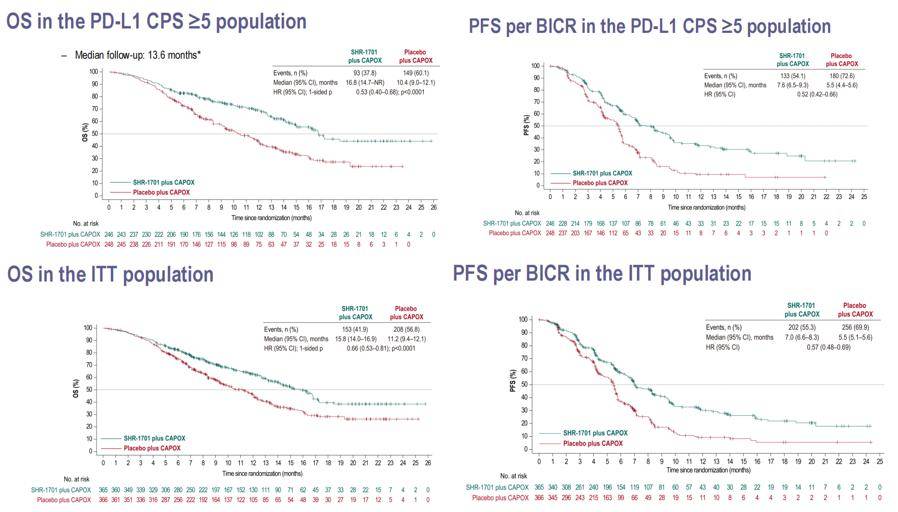
在这项III期研究中,患者被随机分配到SHR1701联合化疗组或安慰剂联合化疗组。值得注意的是,该研究并未采用PD-L1 CPS阳性患者的标准治疗方案(PD-1抑制剂联合化疗)。结果显示,在PD-L1 CPS≥5的患者中,SHR1701联合化疗组的中位OS为16.8个月,而安慰剂组为10.4个月,HR为0.53。在ITT人群中,SHR1701联合化疗组的中位OS为15.8个月,而安慰剂组为11.2个月,HR为0.66。此外,SHR-1701联合化疗组的中位PFS也显著优于安慰剂组。在PD-L1 CPS≥5的人群中,SHR-1701联合化疗组的中位PFS为7.6个月,而安慰剂组为5.5个月。在ITT人群中,SHR-1701联合化疗组的中位PFS为7.0个月,而安慰剂组为5.5个月(图6)。安全性方面,SHR1701联合化疗的副作用可接受。
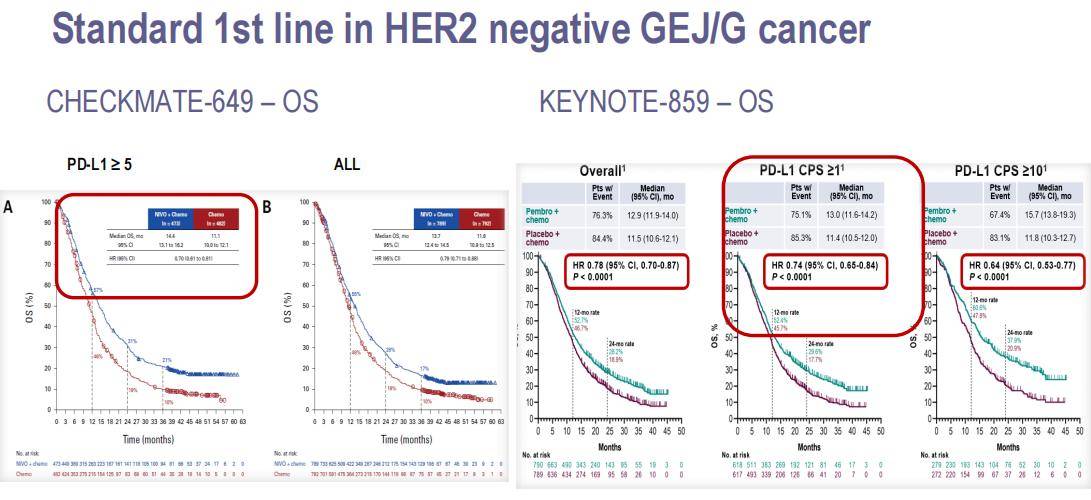
目前,ESMO指南推荐PD-L1 CPS≥1的胃癌患者接受PD-1抑制剂联合化疗的治疗方案,该推荐主要基于两项大型III期临床试验:CheckMate 649和KEYNOTE 859。这两项研究均显示,在化疗的基础上添加免疫检查点抑制剂可以带来显著的生存获益(图7)。
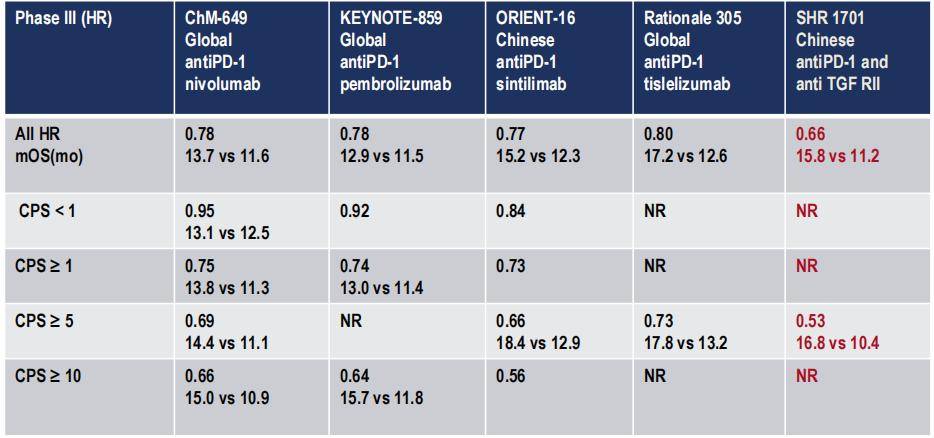
将SHR1701研究的结果与这些已发表的PD-1抑制剂联合化疗的研究进行比较,可以发现SHR-1701联合化疗的HR值更低,预示着更好的疗效。具体来说,在所有人群中,SHR-1701联合化疗的中位OS的HR值为0.66;在PD-L1 CPS≥5的患者中,中位OS的HR值为0.53(表1)。这些数据令人印象深刻,表明SHR1701联合化疗可能是一种更有前景的治疗方案。
表1. SHR-1701联合化疗与其他PD-1抑制剂联合化疗III期临床试验结果比较。
总的来说,SHR-1701联合化疗治疗HER2阴性胃癌的研究结果展现出显著的疗效优势。然而,该研究也存在一些局限性,例如缺乏与标准治疗方案(PD-1抑制剂联合化疗)的直接对比、缺乏PD-L1 CPS<5和MSI-H亚组的数据,以及随访时间较短等。未来,需要更多更大规模、更长时间随访的临床研究来进一步验证SHR-1701的疗效和安全性,并评估其在不同人群中的适用性。
大家可以自行下载对应幻灯,再配合本音频听,效果更好。
排版编辑:xiaodong











 苏公网安备32059002004080号
苏公网安备32059002004080号


